1 . Ⅰ.化学反应速率和化学平衡影响因素较多,经常采用变量控制思想分析问题。某小组利用 溶液和酸性
溶液和酸性 溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:
溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:
请回答:
(1)已知 酸性溶液与
酸性溶液与 溶液反应有
溶液反应有 生成,用化学方程式表示该实验的实验原理:
生成,用化学方程式表示该实验的实验原理:___________ 。
(2)根据表中的实验数据,可以得到的结论是___________ 。
(3)利用实验3中数据计算,用 溶液的浓度变化表示的反应速率为
溶液的浓度变化表示的反应速率为
___________ 。
Ⅱ.研究 的综合利用对促进“低碳经济”的发展有重要意义。工业上以
的综合利用对促进“低碳经济”的发展有重要意义。工业上以 、,为原料生产尿素
、,为原料生产尿素 ,
,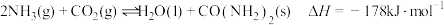 ,
,
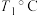 时,在1L的密闭容器中充入
时,在1L的密闭容器中充入 和模拟工业生产,
和模拟工业生产, ,图中是
,图中是 平衡转化率
平衡转化率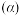 与
与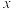 的关系。
的关系。
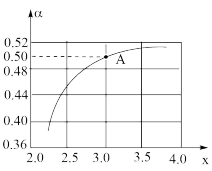
(4)图中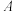 点
点 的平衡转化率
的平衡转化率
___________ %(结果保留3位有效数字)。
(5)当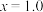 时,若起始的压强为
时,若起始的压强为 ,水为液态平衡时压强变为起始的
,水为液态平衡时压强变为起始的 ,则该反应的平衡常数
,则该反应的平衡常数 =
=___________ ( 为以分压表示的平衡常数,分压=总压
为以分压表示的平衡常数,分压=总压 体积分数)。
体积分数)。
 溶液和酸性
溶液和酸性 溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:
溶液反应来探究“条件对化学反应速率的影响”,进行如表中的实验:| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
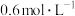  溶液 溶液 |  |   溶液 溶液 |  稀硫酸 稀硫酸 | ||
| 1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
请回答:
(1)已知
 酸性溶液与
酸性溶液与 溶液反应有
溶液反应有 生成,用化学方程式表示该实验的实验原理:
生成,用化学方程式表示该实验的实验原理:(2)根据表中的实验数据,可以得到的结论是
(3)利用实验3中数据计算,用
 溶液的浓度变化表示的反应速率为
溶液的浓度变化表示的反应速率为
Ⅱ.研究
 的综合利用对促进“低碳经济”的发展有重要意义。工业上以
的综合利用对促进“低碳经济”的发展有重要意义。工业上以 、,为原料生产尿素
、,为原料生产尿素 ,
,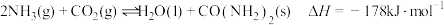 ,
,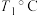 时,在1L的密闭容器中充入
时,在1L的密闭容器中充入 和模拟工业生产,
和模拟工业生产, ,图中是
,图中是 平衡转化率
平衡转化率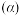 与
与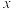 的关系。
的关系。
(4)图中
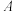 点
点 的平衡转化率
的平衡转化率
(5)当
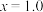 时,若起始的压强为
时,若起始的压强为 ,水为液态平衡时压强变为起始的
,水为液态平衡时压强变为起始的 ,则该反应的平衡常数
,则该反应的平衡常数 =
= 为以分压表示的平衡常数,分压=总压
为以分压表示的平衡常数,分压=总压 体积分数)。
体积分数)。
您最近一年使用:0次
解题方法
2 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如表:(不考虑溶液混合所引起的体积变化)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=____ ;通过实验____ (填实验序号)可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1____ (填“>”或“<”)8。
(3)写出相应反应的离子方程式:____ 。
| 实验序号 | 实验温度/K | 物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | 3 | 0.1 | 1 | t1 |
(2)C组实验中溶液褪色时间t1
(3)写出相应反应的离子方程式:
您最近一年使用:0次
名校
3 .  又称次氯酸酐,是强氧化剂,极易溶于水,沸点为
又称次氯酸酐,是强氧化剂,极易溶于水,沸点为 ,
, 以上分解为
以上分解为 和
和 ,高浓度时易爆炸。某学习小组利用
,高浓度时易爆炸。某学习小组利用 和潮湿的碳酸钠反应生成
和潮湿的碳酸钠反应生成 ,再用水吸收
,再用水吸收 制备
制备 溶液,装置如下,回答下列问题:
溶液,装置如下,回答下列问题:
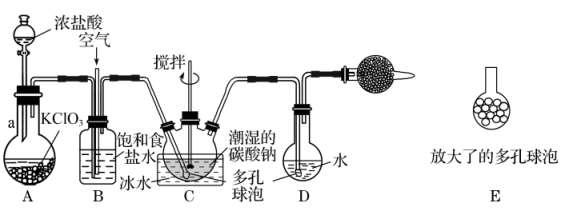
(1)仪器a的名称是_______ ,A中发生反应的离子方程式为_______ 。
(2)实验中须控制 与空气(不参与反应)的体积比为1∶3,装置B的作用
与空气(不参与反应)的体积比为1∶3,装置B的作用_______ (答出2条即可)
(3)装置C中生成 、
、 ,反应的化学方程式为
,反应的化学方程式为_______ ,为使反应充分进行,实验中采取的措施有_______ 。
(4)若装置C不冷却,则进入装置D中的 会大量减少,可能的原因是
会大量减少,可能的原因是_______ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取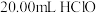 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为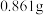 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为_______  (
( 可被
可被 还原成
还原成 )。
)。
 又称次氯酸酐,是强氧化剂,极易溶于水,沸点为
又称次氯酸酐,是强氧化剂,极易溶于水,沸点为 ,
, 以上分解为
以上分解为 和
和 ,高浓度时易爆炸。某学习小组利用
,高浓度时易爆炸。某学习小组利用 和潮湿的碳酸钠反应生成
和潮湿的碳酸钠反应生成 ,再用水吸收
,再用水吸收 制备
制备 溶液,装置如下,回答下列问题:
溶液,装置如下,回答下列问题:
(1)仪器a的名称是
(2)实验中须控制
 与空气(不参与反应)的体积比为1∶3,装置B的作用
与空气(不参与反应)的体积比为1∶3,装置B的作用(3)装置C中生成
 、
、 ,反应的化学方程式为
,反应的化学方程式为(4)若装置C不冷却,则进入装置D中的
 会大量减少,可能的原因是
会大量减少,可能的原因是(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取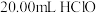 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为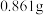 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
4 . 某化学实验小组用下图装置(略去夹持仪器)制备亚硝酸钠,并测定其产品的质量分数。
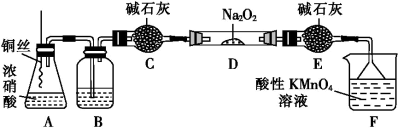
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2均能与KMnO4反应生成和Mn2+。
(1)上图中盛装碱石灰的仪器名称是_______ ,A中这样使用铜丝的优点是_______ ,装置E中的碱石灰的作用是_______ 。
(2)装置A中发生反应的化学方程式为_______ ;装置B中盛放的药品是_______ (填序号)。
①浓硫酸 ②NaOH溶液 ③水 ④四氯化碳
(3)该小组取5.0 g制取的样品溶于水配成250 mL溶液,取25.00 mL所配制的溶液于锥形瓶中,用0.100 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一次实验数据出现异常,造成这种异常的原因可能是_______ (填字母)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为_______ ;
③该样品中亚硝酸钠的质量分数为_______ 。

已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2均能与KMnO4反应生成和Mn2+。
(1)上图中盛装碱石灰的仪器名称是
(2)装置A中发生反应的化学方程式为
①浓硫酸 ②NaOH溶液 ③水 ④四氯化碳
(3)该小组取5.0 g制取的样品溶于水配成250 mL溶液,取25.00 mL所配制的溶液于锥形瓶中,用0.100 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为
③该样品中亚硝酸钠的质量分数为
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.(化学与生活)2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
(1)汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为CO2和___________ (填化学式)。
(2)明矾可用作废水处理的混凝剂,Al3+水解生成的___________ (填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
(3)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是___________ (填化学式)。在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式为___________ (请写出其总反应方程式)。
Ⅱ.(化学反应原理)
(4)对反应N2O4(g)⇌2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1___________ T2(填“>”“<”或“=”)。

(5)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为___________ 。
②该反应的平衡常数K的值为___________ 。(结果保留小数点后两位)
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是___________ mol/L。
(1)汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为CO2和
(2)明矾可用作废水处理的混凝剂,Al3+水解生成的
(3)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是
Ⅱ.(化学反应原理)
(4)对反应N2O4(g)⇌2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1

(5)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为
②该反应的平衡常数K的值为
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是
您最近一年使用:0次
名校
解题方法
6 . K2Cr2O7中学化学重要氧化剂。从废料(含Cr3+、Al3+、Fe2+、Fe3+和Cu2+等)提取重铬酸钾的流程如下:[已知:Cr(OH)3是两性氢氧化物,+6价铬在酸性溶液中主要以Cr2O 存在,在碱性溶液中主要以CrO
存在,在碱性溶液中主要以CrO 存在。]
存在。]

回答下列问题:
(1)“氧化1”中加入双氧水溶液和稀硫酸调节pH=1,双氧水的作用是___________ ,为了提高反应速率,适当加热,但是温度不宜过高,其原因是___________ 。
(2)“除杂1”加入过量NaOH溶液,过滤,得到滤渣成分是___________ (填化学式)。将滤渣溶于过量氨水、___________ (填实验步骤)得到铁红。
(3)“氧化2”中通入氯气,写出离子方程式:___________ 。
(4)“除杂2”中向含 、
、 的溶液通入过量CO2,CO2的作用是
的溶液通入过量CO2,CO2的作用是___________ 。
(5)“结晶”析出Na2Cr2O7,在饱和Na2Cr2O7溶液中加入KCl粉末,Na2Cr2O7转化成K2Cr2O7晶体(两种氯化物留在母液中),预测:Ksp(K2Cr2O7)___________ Ksp(Na2Cr2O7)(填“>”“<”或“=”)。
 存在,在碱性溶液中主要以CrO
存在,在碱性溶液中主要以CrO 存在。]
存在。]
回答下列问题:
(1)“氧化1”中加入双氧水溶液和稀硫酸调节pH=1,双氧水的作用是
(2)“除杂1”加入过量NaOH溶液,过滤,得到滤渣成分是
(3)“氧化2”中通入氯气,写出离子方程式:
(4)“除杂2”中向含
 、
、 的溶液通入过量CO2,CO2的作用是
的溶液通入过量CO2,CO2的作用是(5)“结晶”析出Na2Cr2O7,在饱和Na2Cr2O7溶液中加入KCl粉末,Na2Cr2O7转化成K2Cr2O7晶体(两种氯化物留在母液中),预测:Ksp(K2Cr2O7)
您最近一年使用:0次
7 . 氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯(ClO2),ClO2是一种优良消毒剂。
(1)请补充空白并配平化学方程式。___________KClO3+___________HCl(浓) → ___________KCl+___________ClO2↑___________Cl2↑+ ___________ ,
,___________
(2)浓盐酸在反应中显示出来的性质是___________。
(3)若反应中生成标准状况下13.44 L气体,则消耗还原剂的物质的量为___________ 。
(4)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式___________ 。取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
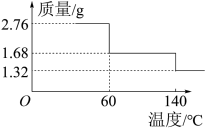
①试确定60 ℃时CaO2·xH2O中x=___________ 。
②该样品中CaO2的质量分数为___________ (精确到0.1%)。
(1)请补充空白并配平化学方程式。___________KClO3+___________HCl(浓) → ___________KCl+___________ClO2↑___________Cl2↑+ ___________
 ,
,(2)浓盐酸在反应中显示出来的性质是___________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式

①试确定60 ℃时CaO2·xH2O中x=
②该样品中CaO2的质量分数为
您最近一年使用:0次
2021-10-25更新
|
163次组卷
|
2卷引用:甘肃省民乐县第一中学2021-2022学年高三上学期10月诊断考试化学试题
8 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示:
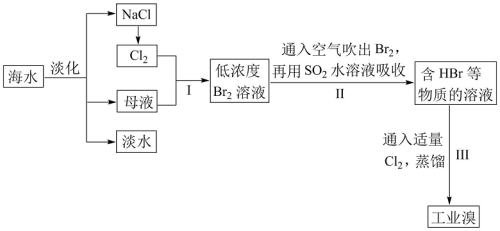
(1)请列举海水淡化的一种方法:___________
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是___________
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为___________ ,由此反应可知,除保护环境外,在工业生产中还应解决的问题是___________ 。

(1)请列举海水淡化的一种方法:
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为
您最近一年使用:0次
2021-10-23更新
|
281次组卷
|
3卷引用:甘肃省临夏县中学2020-2021学年高一下学期期末考试(理科B卷)化学试题
甘肃省临夏县中学2020-2021学年高一下学期期末考试(理科B卷)化学试题甘肃省临夏县中学2020-2021学年高一下学期期末考试(理科A卷)化学试题(已下线)8.1 自然资源的开发利用——同步学习必备知识
名校
解题方法
9 . 某化学小组探究“NO2能与赤热的铜反应生成氧化铜和氮气”。已知:
Ⅰ.NO和Cu不反应
Ⅱ.NO和FeSO4溶液反应:NO + FeSO4= FeSO4·NO(棕色)
Ⅲ.NO和酸性KMnO4溶液反应生成NO 和Mn2+
和Mn2+
设计实验装置如图所示(各装置中液态试剂均足量 )。

回答下列问题:
(1)写出A中发生反应的离子方程式:____________ 。
(2)关闭K1、K3、打开K2,滴加浓硝酸一段时间后关闭K2、打开K3,再点燃C处酒精灯,这样操作的目的是___________ 。
(3)实验过程中观察到下列现象:
①D中浅绿色溶液变成棕色,得出实验结论-NO2的还原产物________ (填代号)。
a.一定是NO和N2b.一定有NO c.一定无NO d.可能有NO
②E中有明显现象,该现象是____________ ,写出发生反应的离子方程式:____________ 。
(4)实验结束时关闭K3,打开K2、将导管末端插入NaOH溶液中,然后熄灭酒精灯,再__________ (填操作),打开K1鼓入大量空气处理装置内污染气体。若实验探究结论成立,E中针筒活塞显示V mL(已换算成标准状况)不再发生变化,此时铜全部被氧化为CuO,则V=____________ (用含 m的代数式表示)。
Ⅰ.NO和Cu不反应
Ⅱ.NO和FeSO4溶液反应:NO + FeSO4= FeSO4·NO(棕色)
Ⅲ.NO和酸性KMnO4溶液反应生成NO
 和Mn2+
和Mn2+设计实验装置如图所示(各装置中

回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)关闭K1、K3、打开K2,滴加浓硝酸一段时间后关闭K2、打开K3,再点燃C处酒精灯,这样操作的目的是
(3)实验过程中观察到下列现象:
①D中浅绿色溶液变成棕色,得出实验结论-NO2的还原产物
a.一定是NO和N2b.一定有NO c.一定无NO d.可能有NO
②E中有明显现象,该现象是
(4)实验结束时关闭K3,打开K2、将导管末端插入NaOH溶液中,然后熄灭酒精灯,再
您最近一年使用:0次
2021-10-21更新
|
273次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题
名校
解题方法
10 . 含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
I.氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)N在元素周期表中的位置:______________ 。
(2)过程i通入NH3和CO2的顺序是_____________________ 。
(3)用平衡移动原理解释过程ii加NaCl(s)有利于析出更多NH4Cl(s)的原因是___________ 。
(4)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为________ 。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
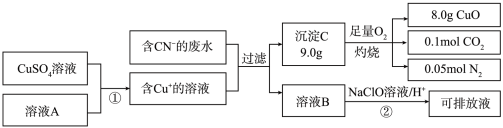
(5)溶液A具有的性质是(填“氧化性”或“还原性”)_______ . C的化学式为:______ 。
(6)反应② 可将CN-转化为无害物质,其离子方程式为:_____________ 。
I.氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)N在元素周期表中的位置:
(2)过程i通入NH3和CO2的顺序是
(3)用平衡移动原理解释过程ii加NaCl(s)有利于析出更多NH4Cl(s)的原因是
(4)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:

(5)溶液A具有的性质是(填“氧化性”或“还原性”)
(6)反应② 可将CN-转化为无害物质,其离子方程式为:
您最近一年使用:0次
2021-10-21更新
|
102次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题



