名校
解题方法
1 . 六聚偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由Ca3(PO4)2、焦炭、石英砂为原料制备六偏磷酸钠的方法如下:
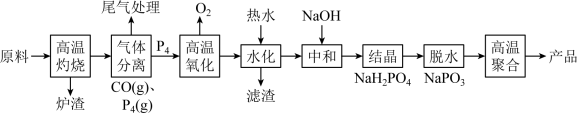
回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是_______ 。
(2)“高温灼烧”发生反应的化学方程式是_______ 。
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是_______ 。
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是_______ 、_______ (填化学式)。
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式_______ 。
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为_______ (结果保留两位小数)。
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是_______ 。

回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是
(2)“高温灼烧”发生反应的化学方程式是
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 钼是电子工业的重要材料,制备它的原料之一是钼铅矿(主要成分是PbMoO4,模拟部分工艺流如图:

已知:Mo有多种化合价,常见化合价有+2、+3、+4、+6;
(1)浸渣的主要成分是________ (填化学式)。
(2)写出流程中用热还原法制单质钼的化学方程式________ 。
(3)铵化时,加HNO3的作用是________ 。
(4)检验(NH4)2MoO4晶体洗净的方法是________ 。
(5)可循环利用的物质有________ (填化学式)。
(6)钼基硫化合物Cu2Mo6S8常用作锂离子电池正极材料,具有较高的功率密度和能量密度,该电池放电时的总反应为xLi+Cu2Mo6S8=LixCu2Mo6S8,写出该电池充电时阳极的电极反应式:________ 。

已知:Mo有多种化合价,常见化合价有+2、+3、+4、+6;
(1)浸渣的主要成分是
(2)写出流程中用热还原法制单质钼的化学方程式
(3)铵化时,加HNO3的作用是
(4)检验(NH4)2MoO4晶体洗净的方法是
(5)可循环利用的物质有
(6)钼基硫化合物Cu2Mo6S8常用作锂离子电池正极材料,具有较高的功率密度和能量密度,该电池放电时的总反应为xLi+Cu2Mo6S8=LixCu2Mo6S8,写出该电池充电时阳极的电极反应式:
您最近一年使用:0次
3 . 2019年诺贝尔化学奖颁给美国科学家约翰·古迪纳夫、斯坦利·惠廷厄姆和日本科学家吉野彰,以表彰他们在锂离子电池的发展方面作出的贡献。获奖科学家的重要贡献之一是研发出了电极材料磷酸亚铁锂( )。
)。 的一种制备方法如下:
的一种制备方法如下:
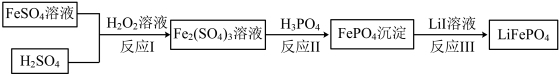
已知: 能电离出
能电离出 。回答下列问题:
。回答下列问题:
(1)Li在元素周期表中的位置是_______ 。
(2) 中,铁元素的化合价为
中,铁元素的化合价为_______ 。
(3)将反应Ⅰ补充完整:_______ 。
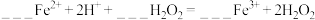
(4)写出以上制备流程标出的物质中,所有共价化合物的化学式:_______ (提示:不止一种)。
 )。
)。 的一种制备方法如下:
的一种制备方法如下:
已知:
 能电离出
能电离出 。回答下列问题:
。回答下列问题:(1)Li在元素周期表中的位置是
(2)
 中,铁元素的化合价为
中,铁元素的化合价为(3)将反应Ⅰ补充完整:
(4)写出以上制备流程标出的物质中,所有共价化合物的化学式:
您最近一年使用:0次
4 . 实验室用酸性蚀刻废液(含Cu2+、H+、 、Cl-等)和碱性蚀刻废液[NH
、Cl-等)和碱性蚀刻废液[NH 、
、 、NH3·H2O等]制备CuI(白色固体,难溶于水,易被空气中的氧气氧化)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体,难溶于水,易被空气中的氧气氧化)的实验流程如下:

(1)步骤Ⅰ中发生了多个反应,其 与NH3·H2O反应生成Cu(OH)Cl的离子方程式为
与NH3·H2O反应生成Cu(OH)Cl的离子方程式为_______ 。
(2)步骤Ⅳ需控制pH为1~2,80℃下进行,加热温度不能过高的原因是_______ 。
(3)步骤Ⅴ目的是制备纯净的硫酸铜晶体,具体步骤是80℃下蒸发浓缩、_______ 、过滤洗涤。
步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
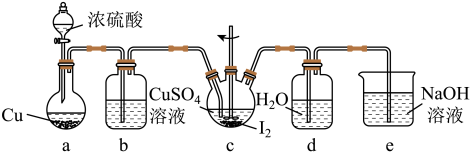
(4)装置c中搅拌的目的是:_______ ,发生反应的离子方程式为_______ 。
(5)实验结束后,制得的CuI固体过滤后用装置d所得溶液来洗涤,目的是_______ ,然后再用无水乙醇洗涤。
(6)装置e的作用是:_______ 。
 、Cl-等)和碱性蚀刻废液[NH
、Cl-等)和碱性蚀刻废液[NH 、
、 、NH3·H2O等]制备CuI(白色固体,难溶于水,易被空气中的氧气氧化)的实验流程如下:
、NH3·H2O等]制备CuI(白色固体,难溶于水,易被空气中的氧气氧化)的实验流程如下:
(1)步骤Ⅰ中发生了多个反应,其
 与NH3·H2O反应生成Cu(OH)Cl的离子方程式为
与NH3·H2O反应生成Cu(OH)Cl的离子方程式为(2)步骤Ⅳ需控制pH为1~2,80℃下进行,加热温度不能过高的原因是
(3)步骤Ⅴ目的是制备纯净的硫酸铜晶体,具体步骤是80℃下蒸发浓缩、
步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

(4)装置c中搅拌的目的是:
(5)实验结束后,制得的CuI固体过滤后用装置d所得溶液来洗涤,目的是
(6)装置e的作用是:
您最近一年使用:0次
名校
5 . 高铁酸盐是优良的多功能水处理剂。某实验小组采用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。
资料:K2FeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为___________
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________ ,充分反应后得到紫色固体,反应方程式为___________ 。反应中KOH必须过量的原因是___________ 。
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用___________ 。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的 氧化为
氧化为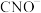 ,实验表明,pH=9时
,实验表明,pH=9时 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:___________ 。

(5)资料表明,酸性溶液中氧化性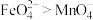 。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。
。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。
请设计实验证明最后所得浅紫色溶液中含有
___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的
 氧化为
氧化为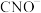 ,实验表明,pH=9时
,实验表明,pH=9时 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:
(5)资料表明,酸性溶液中氧化性
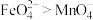 。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。
。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有

您最近一年使用:0次
名校
解题方法
6 . 工业上用黄铁矿 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
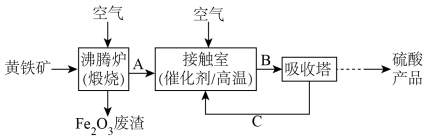
回答下列问题:
(1)在接触室中发生的反应是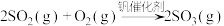 ,该反应属于
,该反应属于_______ (填字母)。
a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为_______ 。
(3)利用 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为_______ 。
(4)我国 排放标准限值为
排放标准限值为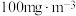 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为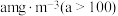 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水_______ L(用含a、b的代数式表示),才能使该烟气 排放值为
排放值为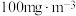 。
。
(5) 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:_______ 。
(6)大气中的水蒸气在紫外线作用下会转化为活泼的 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式_______ 。
 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
回答下列问题:
(1)在接触室中发生的反应是
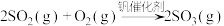 ,该反应属于
,该反应属于a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为
(3)利用
 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为(4)我国
 排放标准限值为
排放标准限值为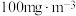 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为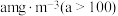 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水 排放值为
排放值为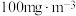 。
。(5)
 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:(6)大气中的水蒸气在紫外线作用下会转化为活泼的
 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
您最近一年使用:0次
名校
解题方法
7 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
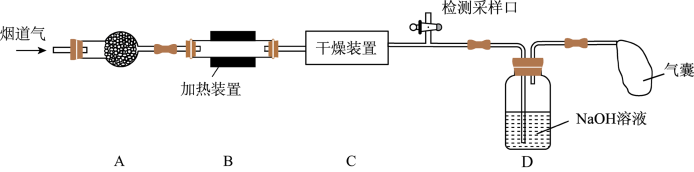
(1)装置A中放置无碱玻璃棉,其目的是除去___________ ,为保证检测的准确性,装置C中盛放的化学试剂可以是___________ (填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜( )
)
(2)装置D中主要发生: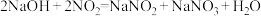 ;
;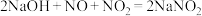

①若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为___________ (填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性 溶液,将溶液中的NO
溶液,将溶液中的NO 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是___________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理,HClO氧化NO生成 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是___________ 。
 )、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
)、粉尘和少量水蒸气。课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图所示:
(1)装置A中放置无碱玻璃棉,其目的是除去
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(
 )
)(2)装置D中主要发生:
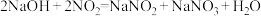 ;
;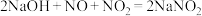

①若反应后尾气无残留,则参加反应的
 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
②可使用适量酸性
 溶液,将溶液中的NO
溶液,将溶液中的NO 全部氧化为
全部氧化为 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性NaClO溶液来处理,HClO氧化NO生成
 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是
您最近一年使用:0次
名校
8 . 以冶炼铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为 (含少量杂质
(含少量杂质 、FeO、
、FeO、 ),其制备实验流程如下:
),其制备实验流程如下:

已知: 极易溶于水;
极易溶于水; 、
、 、
、 为酸性氧化物。
为酸性氧化物。
(1)写出铝灰与硫酸反应涉及的所有离子方程式_______________ 、___________ 、____________ 。
(2)图中“滤渣”的主要成分为____________ (填化学式)。
(3)加30% 溶液发生的离子反应方程式为
溶液发生的离子反应方程式为_______________________ 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
 ,将产生的气体通过如图所示的装置。
,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是____________ (填化学式)。
② 溶液褪色(
溶液褪色( 被还原为
被还原为 ),发生的离子反应方程式为
),发生的离子反应方程式为____________ 。
 (含少量杂质
(含少量杂质 、FeO、
、FeO、 ),其制备实验流程如下:
),其制备实验流程如下:
已知:
 极易溶于水;
极易溶于水; 、
、 、
、 为酸性氧化物。
为酸性氧化物。(1)写出铝灰与硫酸反应涉及的所有离子方程式
(2)图中“滤渣”的主要成分为
(3)加30%
 溶液发生的离子反应方程式为
溶液发生的离子反应方程式为(4)煅烧硫酸铝铵晶体,发生的主要反应为:

 ,将产生的气体通过如图所示的装置。
,将产生的气体通过如图所示的装置。
①集气瓶中收集到的气体是
②
 溶液褪色(
溶液褪色( 被还原为
被还原为 ),发生的离子反应方程式为
),发生的离子反应方程式为
您最近一年使用:0次
名校
解题方法
9 . 某研究性学习小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。已知:Cl2易溶于CCl4而HCl不溶于CCl4

按要求回答问题:
(1)装置A中仪器H的名称是_______ ,写出装置A制取Cl2的化学方程式_______ 。
(2)装置B中的试剂是_______ ,现象是_______ 。装置D和E中出现的不同现象说明氯气没有漂白性,氯水有漂白性。
(3)装置F的作用是_______ 。
(4)有一种“地康法”制取氯气的反应原理如图所示:
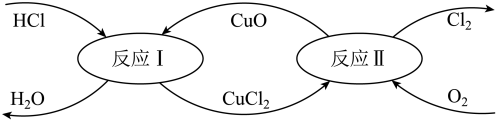
①反应I属于_______ 反应。(填四种基本反应类型之一)
②在450℃条件下,反应II的化学方程式为_______ 。
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:_______ 。

按要求回答问题:
(1)装置A中仪器H的名称是
(2)装置B中的试剂是
(3)装置F的作用是
(4)有一种“地康法”制取氯气的反应原理如图所示:

①反应I属于
②在450℃条件下,反应II的化学方程式为
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . “绿水青山就是金山银山”,现在人们越来越注重对环境的保护,污水的处理和废旧电池的回收成为环境保护的重要课题。
Ⅰ.工业上常用还原沉淀法处理含铬废水(Cr2O 和CrO
和CrO ),其流程为
),其流程为
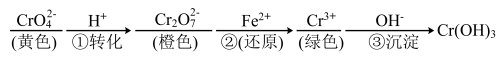
已知步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
(1)步骤①中存在反应2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是
+H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是_______ ,原因是 _______ 。
(2)步骤③中,当将溶液的pH调节至_______ 时,可认为废水中的铬元素已基本除尽。(当溶液中c(Cr3+)≤10-5mol·L-1时,可视作该离子沉淀完全)
Ⅱ.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
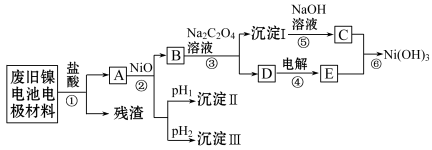
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
回答下列问题:
(3)根据上表数据判断步骤②依次析出沉淀Ⅱ_______ 和沉淀Ⅲ_______ (填化学式),则pH1_______ pH2(填“>”“=”或“<”)。
(4)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是_______ 。第③步反应后的操作名称是 _______ 。
(5)试写出⑥的离子方程式_______ 。
Ⅰ.工业上常用还原沉淀法处理含铬废水(Cr2O
 和CrO
和CrO ),其流程为
),其流程为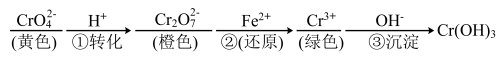
已知步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。
Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)·c3(OH-)=10-32。(1)步骤①中存在反应2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是
+H2O,若向K2Cr2O7溶液中加NaOH浓溶液,能出现的现象是(2)步骤③中,当将溶液的pH调节至
Ⅱ.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(3)根据上表数据判断步骤②依次析出沉淀Ⅱ
(4)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是
(5)试写出⑥的离子方程式
您最近一年使用:0次



