高铁酸盐是优良的多功能水处理剂。某实验小组采用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。
资料:K2FeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为___________
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________ ,充分反应后得到紫色固体,反应方程式为___________ 。反应中KOH必须过量的原因是___________ 。
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用___________ 。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的 氧化为
氧化为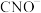 ,实验表明,pH=9时
,实验表明,pH=9时 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:___________ 。

(5)资料表明,酸性溶液中氧化性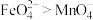 。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。
。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。
请设计实验证明最后所得浅紫色溶液中含有
___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液,难溶于有机溶剂;具有强氧化性,在酸性或中性溶液中紫色快速褪去并产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持、加热等装置略)

(1)B中所用试剂为
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为
(3)C中混合物经过滤、洗涤、干燥,得纯净高铁酸钾晶体,洗涤时洗涤剂可选用
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的
 氧化为
氧化为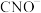 ,实验表明,pH=9时
,实验表明,pH=9时 去除效果最佳。配平反应离子方程式:
去除效果最佳。配平反应离子方程式:
(5)资料表明,酸性溶液中氧化性
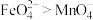 。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。
。验证实验:将少量K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有

更新时间:2023-06-26 19:45:54
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】亚硝酸钙是白色粉末,易潮解,易溶于水,微溶于乙醇、乙醚。实验室用NO和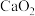 (淡黄色固体)制备无水亚硝酸钙的装置(夹持装置略)如图所示。
(淡黄色固体)制备无水亚硝酸钙的装置(夹持装置略)如图所示。

回答下列问题:
(1)实验开始先通 ,一段时间后,向三颈烧瓶中滴加稀硝酸制取NO,B中产生大量气泡时,D处开始加热。仪器a的名称为
,一段时间后,向三颈烧瓶中滴加稀硝酸制取NO,B中产生大量气泡时,D处开始加热。仪器a的名称为_______ ,B中盛放的试剂是_______ 。
(2)装置E中,酸性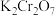 可将剩余的NO氧化为
可将剩余的NO氧化为 ,溶液逐渐由橙色变为绿色
,溶液逐渐由橙色变为绿色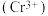 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(3)上述装置存在一处缺陷,会导致亚硝酸钙产率降低,改进的方法是_______ 。
(4)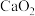 完全还原后,进行的操作是:①停止滴加稀硝酸,停止通电;②……;③冷却后,将所得产品完全转移到试剂瓶中密封保存;④……
完全还原后,进行的操作是:①停止滴加稀硝酸,停止通电;②……;③冷却后,将所得产品完全转移到试剂瓶中密封保存;④……
操作②是_______ 。
(5)测定所得亚硝酸钙中硝酸钙的含量。
实验原理: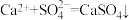 ;
;
 ;
;
 ;
;
 。
。
实验步骤:I.准确称取m g所得亚硝酸钙,置于150mL烧杯中,加入100mL蒸馏水和n g硫酸钠(足量),搅拌均匀,将溶液与沉淀全部移入250mL容量瓶,加入稀释至刻度,摇匀,干过滤;(忽略固体对溶液体积的影响)
II.取25.00mL滤液于500mL锥形瓶中,加入足量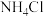 饱和溶液,煮沸5min;
饱和溶液,煮沸5min;
III.冷却后用少量蒸馏水洗涤锥形瓶内壁,再加入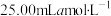 硫酸亚铁铵
硫酸亚铁铵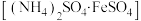 溶液,在不断摇动下,沿瓶壁缓慢加入20mL硫酸(1∶1)。
溶液,在不断摇动下,沿瓶壁缓慢加入20mL硫酸(1∶1)。
IV.加4滴指示剂,迅速用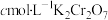 标准液滴定至终点,消耗
标准液滴定至终点,消耗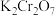 标准液V mL。
标准液V mL。
所得亚硝酸钙中硝酸钙的质量百分含量为_______ ;下列情况会导致硝酸钙的质量百分含量测量值偏大的是_______ (填标号)。
a.步骤I中,称量后样品发生了潮解
b.步骤II中,煮沸时间仅有3min
c.步骤III中量取的硫酸亚铁铵溶液的实际体积小于25.00mL
d.滴定终点时,发现尖嘴管内有气泡生成
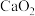 (淡黄色固体)制备无水亚硝酸钙的装置(夹持装置略)如图所示。
(淡黄色固体)制备无水亚硝酸钙的装置(夹持装置略)如图所示。
回答下列问题:
(1)实验开始先通
 ,一段时间后,向三颈烧瓶中滴加稀硝酸制取NO,B中产生大量气泡时,D处开始加热。仪器a的名称为
,一段时间后,向三颈烧瓶中滴加稀硝酸制取NO,B中产生大量气泡时,D处开始加热。仪器a的名称为(2)装置E中,酸性
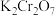 可将剩余的NO氧化为
可将剩余的NO氧化为 ,溶液逐渐由橙色变为绿色
,溶液逐渐由橙色变为绿色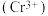 ,该反应的离子方程式为
,该反应的离子方程式为(3)上述装置存在一处缺陷,会导致亚硝酸钙产率降低,改进的方法是
(4)
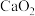 完全还原后,进行的操作是:①停止滴加稀硝酸,停止通电;②……;③冷却后,将所得产品完全转移到试剂瓶中密封保存;④……
完全还原后,进行的操作是:①停止滴加稀硝酸,停止通电;②……;③冷却后,将所得产品完全转移到试剂瓶中密封保存;④……操作②是
(5)测定所得亚硝酸钙中硝酸钙的含量。
实验原理:
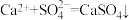 ;
; ;
; ;
; 。
。实验步骤:I.准确称取m g所得亚硝酸钙,置于150mL烧杯中,加入100mL蒸馏水和n g硫酸钠(足量),搅拌均匀,将溶液与沉淀全部移入250mL容量瓶,加入稀释至刻度,摇匀,干过滤;(忽略固体对溶液体积的影响)
II.取25.00mL滤液于500mL锥形瓶中,加入足量
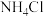 饱和溶液,煮沸5min;
饱和溶液,煮沸5min;III.冷却后用少量蒸馏水洗涤锥形瓶内壁,再加入
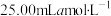 硫酸亚铁铵
硫酸亚铁铵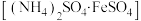 溶液,在不断摇动下,沿瓶壁缓慢加入20mL硫酸(1∶1)。
溶液,在不断摇动下,沿瓶壁缓慢加入20mL硫酸(1∶1)。IV.加4滴指示剂,迅速用
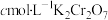 标准液滴定至终点,消耗
标准液滴定至终点,消耗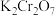 标准液V mL。
标准液V mL。所得亚硝酸钙中硝酸钙的质量百分含量为
a.步骤I中,称量后样品发生了潮解
b.步骤II中,煮沸时间仅有3min
c.步骤III中量取的硫酸亚铁铵溶液的实际体积小于25.00mL
d.滴定终点时,发现尖嘴管内有气泡生成
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。试回答下面问题。(AgOH不稳定,很快分解为Ag2O沉淀和水)
(1)A的化学式是_________ ,G的化学式是_________ 。判断理由是__________ 。A与G反应的离子方程式: _________ 。
(2)写出其余几种物质的化学式:B________ ,C_________ ,D_______ ,E_______ ,F_______ 。
(3)写出F分别与B、C、D、E反应的离子方程式:
①_________
②_________
③_________
④_________
A | B | C | D | E | F | G | |
A | — | — | — | — | — | — | ↓ |
B | — | — | — | — | ↓ | ↓ | ↓ |
C | — | — | — | ↓ | — | ↓ | ↓ |
D | — | ↓ | — | ↓ | ↓ | ↓ | |
E | — | ↓ | — | ↓ | — | ↓ | — |
F | — | ↓ | ↓ | ↓ | ↓ | — | ↓ |
G | ↓ | ↓ | ↓ | ↓ | — | ↓ | — |
(2)写出其余几种物质的化学式:B
(3)写出F分别与B、C、D、E反应的离子方程式:
①
②
③
④
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
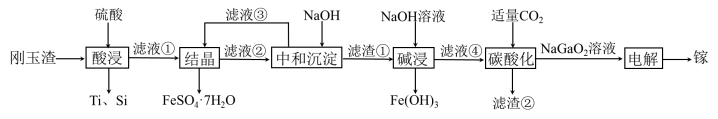
回答下列问题:
(1)镓原子结构示意图为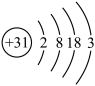 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
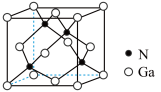
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为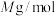 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为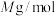 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
【推荐1】近年来,我国(PCB)印刷电路板制造业发展迅速,总产值居世界第一。工业上常用CuCl2和盐酸的混合液作为蚀刻液,蚀刻PCB表面的铜箔。
已知:①一定条件下,Cu与Cu2+反应可生成+ 1价铜。
②氯化亚铜(CuCl)难溶于水,可与Cl-形成CuCl32-进入溶液。
Ⅰ.蚀刻过程中将Cu转化为CuCl32-去除。
(1)蚀刻过程的离子方程式有_______ 、CuCl+2Cl- CuCl32-。
CuCl32-。
(2)蚀刻液中的盐酸可大大提高蚀刻效率,结合上述反应解释原因:______________ 。
Ⅱ.蚀刻一段时间后,将蚀刻废液中的CuCl32-转化为Cu2+,即可再生循环利用,常用方法如下:
(1)化学再生:加入H2O2溶液可使蚀刻液再生,该反应的离子方程式是______________ 。
(2)电解再生(电极不参与反应):按下图装置,使蚀刻液再生并回收金属Cu。

①在______ 极(填“a”或“b)”)回收得到金属Cu。
②结合电极反应解释阳极区蚀刻液再生的原理:________ 。
③实际电解过程中,通常在两极上均产生少量气体,则流出液1、流出液2混合后,还需补充试剂________ ,得到可循环使用的再生液。
④研究表明:其他条件不变,使用无膜电解槽再生时,一段时间后,电极上析出的Cu总量反而会随电解时间的增长而减少。解释Cu的总量减少的原因:________ 。
已知:①一定条件下,Cu与Cu2+反应可生成+ 1价铜。
②氯化亚铜(CuCl)难溶于水,可与Cl-形成CuCl32-进入溶液。
Ⅰ.蚀刻过程中将Cu转化为CuCl32-去除。
(1)蚀刻过程的离子方程式有
 CuCl32-。
CuCl32-。(2)蚀刻液中的盐酸可大大提高蚀刻效率,结合上述反应解释原因:
Ⅱ.蚀刻一段时间后,将蚀刻废液中的CuCl32-转化为Cu2+,即可再生循环利用,常用方法如下:
(1)化学再生:加入H2O2溶液可使蚀刻液再生,该反应的离子方程式是
(2)电解再生(电极不参与反应):按下图装置,使蚀刻液再生并回收金属Cu。

①在
②结合电极反应解释阳极区蚀刻液再生的原理:
③实际电解过程中,通常在两极上均产生少量气体,则流出液1、流出液2混合后,还需补充试剂
④研究表明:其他条件不变,使用无膜电解槽再生时,一段时间后,电极上析出的Cu总量反而会随电解时间的增长而减少。解释Cu的总量减少的原因:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
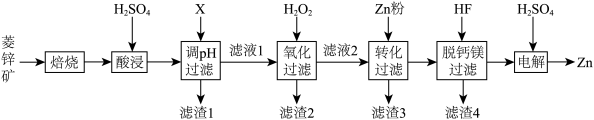
【推荐2】以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
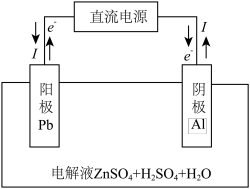
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】树叶上镀铜可以长久保存,且具有一定艺术性和鉴赏价值。某兴趣小组探究榕树叶表面镀铜的工艺。
资料:酸性条件下,
 。
。
(1)由废铜屑制备酸性硫酸铜溶液。取一定量的废铜屑置于___________ (填仪器名称)中焙烧,再用稍过量的稀硫酸溶解冷却后的粉末,得到酸性硫酸铜溶液。
(2)除蜡。除去榕树叶表面酯类蜡质层的方法是___________ 。
(3)敏化。洗净后的树叶用新制的1% 溶液浸泡敏化30s。久置的
溶液浸泡敏化30s。久置的 溶液易变质,若变质过程只生成
溶液易变质,若变质过程只生成 溶液和
溶液和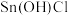 沉淀,其化学方程式为
沉淀,其化学方程式为___________ 。
(4)活化。将敏化后的树叶洗净,放入银氨溶液与甲醛混合溶液中,控制40℃左右浸泡5min。

①配制银氨溶液:将___________ (填试剂)滴入溶液A,直到出现___________ 现象时停止滴加。
②控制40℃应采用的加热方式为___________ ,实验后、容器壁上的银镜可用___________ (填试剂)的稀溶液除去。
(5)电镀。将活化后的树叶放入酸性硫酸铜溶液中进行电镀。电镀时,铜阳极反应的历程如下:
a. ;
;
b.
①纯铜作阳极时,电镀时会产生阳极泥(铜粉),说明铜阳极反应的决速步骤是___________ (填“a”或“b”)。
②电镀时,通过搅拌等方式向酸性硫酸铜溶液中鼓入空气,能减少阳极泥的产生,其原因是___________ 。
③Cu的密度为 ,电镀过程的电化当量为
,电镀过程的电化当量为 。若流经树叶表面的电流密度为
。若流经树叶表面的电流密度为 且阴极没有副反应,则形成0.050cm厚度铜镀层需要
且阴极没有副反应,则形成0.050cm厚度铜镀层需要___________ min。(铜的电化当量是一个常数,指单位电量所析出铜的质量大小,其中电量=电流×时间;电流密度,是指单位面积所通过的电流大小)
资料:酸性条件下,

 。
。(1)由废铜屑制备酸性硫酸铜溶液。取一定量的废铜屑置于
(2)除蜡。除去榕树叶表面酯类蜡质层的方法是
(3)敏化。洗净后的树叶用新制的1%
 溶液浸泡敏化30s。久置的
溶液浸泡敏化30s。久置的 溶液易变质,若变质过程只生成
溶液易变质,若变质过程只生成 溶液和
溶液和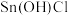 沉淀,其化学方程式为
沉淀,其化学方程式为(4)活化。将敏化后的树叶洗净,放入银氨溶液与甲醛混合溶液中,控制40℃左右浸泡5min。

①配制银氨溶液:将
②控制40℃应采用的加热方式为
(5)电镀。将活化后的树叶放入酸性硫酸铜溶液中进行电镀。电镀时,铜阳极反应的历程如下:
a.
 ;
;b.

①纯铜作阳极时,电镀时会产生阳极泥(铜粉),说明铜阳极反应的决速步骤是
②电镀时,通过搅拌等方式向酸性硫酸铜溶液中鼓入空气,能减少阳极泥的产生,其原因是
③Cu的密度为
 ,电镀过程的电化当量为
,电镀过程的电化当量为 。若流经树叶表面的电流密度为
。若流经树叶表面的电流密度为 且阴极没有副反应,则形成0.050cm厚度铜镀层需要
且阴极没有副反应,则形成0.050cm厚度铜镀层需要
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】下图是无机物A~H在一定条件下的转化关系(反应条件及部分产物未列出)。其中,其中①、②是化工生产中重要的反应。B是非金属单质,G是金属单质,H是黄绿色气体。

(1)反应②的化学方程式为____ ,该反应在化工生产中的目的是____ 。
(2)检验I中阳离子的实验操作为____ 。
(3)在化工生产中每燃烧0.12 kg A就会放出853 kJ热量,则A燃烧的热化学方程式为___ 。

(1)反应②的化学方程式为
(2)检验I中阳离子的实验操作为
(3)在化工生产中每燃烧0.12 kg A就会放出853 kJ热量,则A燃烧的热化学方程式为
您最近一年使用:0次
【推荐2】化合物X由3种元素组成。某兴趣小组按如下流程进行实验:
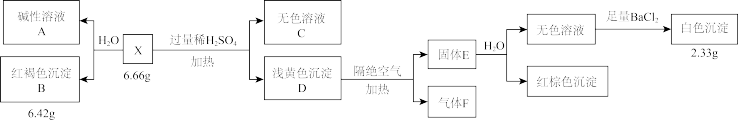
已知:A溶液焰色试验呈黄色,恰好中和A溶液消耗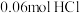 ,气体F中含有水蒸气
,气体F中含有水蒸气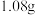 。
。
请回答:
(1)组成X的三种元素名称为_______ ,D的化学式为_______ 。
(2)溶液C中溶质的成分是_______ (用化学式表示)。
(3)X与稀硫酸反应的化学方程式是_______ 。
(4)设计实验,检验气体F中的另外2种气体_______ 。

已知:A溶液焰色试验呈黄色,恰好中和A溶液消耗
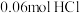 ,气体F中含有水蒸气
,气体F中含有水蒸气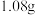 。
。请回答:
(1)组成X的三种元素名称为
(2)溶液C中溶质的成分是
(3)X与稀硫酸反应的化学方程式是
(4)设计实验,检验气体F中的另外2种气体
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
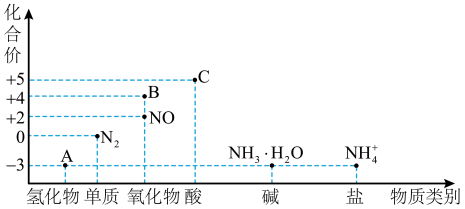
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是:___________ 。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:___________ 。
(3)实验室中,检验溶液中含有 的操作方法是
的操作方法是___________ 。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:___________ ,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为___________ mol。
Ⅱ.A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图所示的转化关系。由此推断:
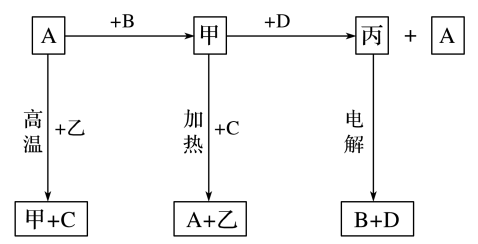
(5)甲的化学式为___________ ,丙的化学式为___________ 。
(6)写出甲和D反应的化学方程式___________ 。
(7)为检验化合物甲中元素的化合价,需要用到的药品有___________(填字母)。

回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是:
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:
(3)实验室中,检验溶液中含有
 的操作方法是
的操作方法是(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:
Ⅱ.A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图所示的转化关系。由此推断:

(5)甲的化学式为
(6)写出甲和D反应的化学方程式
(7)为检验化合物甲中元素的化合价,需要用到的药品有___________(填字母)。
| A.稀硫酸 | B.盐酸 | C.硫氰化钾溶液 | D.高锰酸钾溶液 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】缺铁性贫血是常见病,补铁剂是治疗缺铁性贫血的常用药物,种类很多。葡萄糖酸亚铁 是常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组的同学用如图装置制备
是常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组的同学用如图装置制备 ,并利用
,并利用 与葡萄糖酸反应得到葡萄糖酸亚铁。
与葡萄糖酸反应得到葡萄糖酸亚铁。
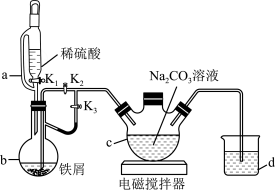
(1)实验中恒压滴液漏斗上侧管a的优点是_______ 。
(2)实验开始时,应打开活塞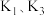 ,关闭
,关闭 ,让反应产生的氢气将装置中的空气排净。一段时间后,要使蒸馏烧瓶b中制得的
,让反应产生的氢气将装置中的空气排净。一段时间后,要使蒸馏烧瓶b中制得的 溶液进入三颈烧瓶c中,操作方法及实验原理为
溶液进入三颈烧瓶c中,操作方法及实验原理为_______ 。
(3)将制得的碳酸亚铁悬浊液过滤、洗涤,证明沉淀已经洗涤干净的实验操作及现象为_______ 。
(4)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为_______ 。
(5)实验结束后,小组的同学用酸性 溶液测定所得葡萄糖酸亚铁晶体的纯度时,发现产品的纯度大于100%,其原因是
溶液测定所得葡萄糖酸亚铁晶体的纯度时,发现产品的纯度大于100%,其原因是_______ 。经查阅文献后,小组同学发现可用EDTA(简写为 )标准溶液滴定。取
)标准溶液滴定。取 葡萄糖酸亚铁晶体溶于盐酸,加入过量的
葡萄糖酸亚铁晶体溶于盐酸,加入过量的 标准溶液,充分反应后,再用
标准溶液,充分反应后,再用 的含
的含 标准溶液滴定过量的EDTA至终点,消耗含
标准溶液滴定过量的EDTA至终点,消耗含 标准溶液的体积为
标准溶液的体积为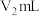 (反应的离子方程式为
(反应的离子方程式为 ,
, 为金属离子),则葡萄糖酸亚铁晶体的质量分数为
为金属离子),则葡萄糖酸亚铁晶体的质量分数为_______ (用 列式表示)。
列式表示)。
 是常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组的同学用如图装置制备
是常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组的同学用如图装置制备 ,并利用
,并利用 与葡萄糖酸反应得到葡萄糖酸亚铁。
与葡萄糖酸反应得到葡萄糖酸亚铁。
(1)实验中恒压滴液漏斗上侧管a的优点是
(2)实验开始时,应打开活塞
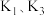 ,关闭
,关闭 ,让反应产生的氢气将装置中的空气排净。一段时间后,要使蒸馏烧瓶b中制得的
,让反应产生的氢气将装置中的空气排净。一段时间后,要使蒸馏烧瓶b中制得的 溶液进入三颈烧瓶c中,操作方法及实验原理为
溶液进入三颈烧瓶c中,操作方法及实验原理为(3)将制得的碳酸亚铁悬浊液过滤、洗涤,证明沉淀已经洗涤干净的实验操作及现象为
(4)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为
(5)实验结束后,小组的同学用酸性
 溶液测定所得葡萄糖酸亚铁晶体的纯度时,发现产品的纯度大于100%,其原因是
溶液测定所得葡萄糖酸亚铁晶体的纯度时,发现产品的纯度大于100%,其原因是 )标准溶液滴定。取
)标准溶液滴定。取 葡萄糖酸亚铁晶体溶于盐酸,加入过量的
葡萄糖酸亚铁晶体溶于盐酸,加入过量的 标准溶液,充分反应后,再用
标准溶液,充分反应后,再用 的含
的含 标准溶液滴定过量的EDTA至终点,消耗含
标准溶液滴定过量的EDTA至终点,消耗含 标准溶液的体积为
标准溶液的体积为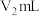 (反应的离子方程式为
(反应的离子方程式为 ,
, 为金属离子),则葡萄糖酸亚铁晶体的质量分数为
为金属离子),则葡萄糖酸亚铁晶体的质量分数为 列式表示)。
列式表示)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】实验小组探究银氨溶液与甲酸(HCOOH,其中C为 价)的反应及银镜产生的原因。
价)的反应及银镜产生的原因。
(1)配制银氨溶液。在洁净的试管中加入适量2% 溶液,逐滴滴入2%氨水,边滴边振荡,至
溶液,逐滴滴入2%氨水,边滴边振荡,至________ ,制得银氨溶液,测得溶液pH略大于7。
(2)进行甲酸的银镜反应实验。
查阅资料:i.银氨溶液中存在平衡: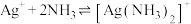

ii.白色AgOH沉淀不稳定,极易分解生成棕黑色
iii.含银元素的部分难溶物(如 、AgCl、
、AgCl、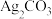 等)可溶于浓氨水,生成
等)可溶于浓氨水,生成
①与实验ii对照,实验i的目的是________ 。
②经检验,实验ii中白色浑浊的主要成分为甲酸银(HCOOAg),推断是甲酸银分解产生银镜,则甲酸银分解的产生的气体中一定含________ 。
③实验iii和实验iv是为了探究pH较高时的银镜反应。实验iv的现象________ (填“能”或“不能”)证明pH较高时是甲酸发生反应产生了银镜。
④甲同学认为实验iii、实验iv中,水浴前的棕黑色浊液中含有银单质,乙同学通过实验排除了这种可能性,其实验操作及实验现象是________ 。
(3)探究实验iv中的含碳产物。取实验iv试管中的产物静置后,取上层清液继续实验:________ 。
②根据上述实验可知,实验iv中银氨溶液与甲酸反应的化学方程式为________ 。
(4)综合以上实验,小组同学得出以下结论:
a.银氨溶液与甲酸反应时,若溶液pH较低,产生银镜的主要原因是甲酸银的分解。
b.银氨溶液与甲酸反应时,若溶液pH较高,产生银镜的原因可能有________________ (写出两点)。
 价)的反应及银镜产生的原因。
价)的反应及银镜产生的原因。(1)配制银氨溶液。在洁净的试管中加入适量2%
 溶液,逐滴滴入2%氨水,边滴边振荡,至
溶液,逐滴滴入2%氨水,边滴边振荡,至(2)进行甲酸的银镜反应实验。
| 编号 | 溶液X | 现象 |
i | 始终无明显现象 | ||
ii | 10滴5%HCOOH溶液 | 加HCOOH后立即产生白色浑浊,测得溶液pH略小于7;水浴开始时白色浊液变为土黄色,随后变黑,有气体产生;最终试管壁附着少量银镜,冷却测得溶液pH略小于5 | |
iii | 5滴10%NaOH溶液和5滴蒸馏水 | 加NaOH后立即产生棕黑色浑浊。最终试管壁附着光亮银镜,冷却测得溶液 | |
iv | 5滴10%NaOH溶液和5滴5%HCOOH溶液 | 加NaOH后立即产生棕黑色浑浊,加HCOOH后沉淀部分溶解。最终试管壁附着光亮银镜,冷却测得溶液 |
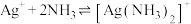

ii.白色AgOH沉淀不稳定,极易分解生成棕黑色

iii.含银元素的部分难溶物(如
 、AgCl、
、AgCl、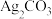 等)可溶于浓氨水,生成
等)可溶于浓氨水,生成
①与实验ii对照,实验i的目的是
②经检验,实验ii中白色浑浊的主要成分为甲酸银(HCOOAg),推断是甲酸银分解产生银镜,则甲酸银分解的产生的气体中一定含
③实验iii和实验iv是为了探究pH较高时的银镜反应。实验iv的现象
④甲同学认为实验iii、实验iv中,水浴前的棕黑色浊液中含有银单质,乙同学通过实验排除了这种可能性,其实验操作及实验现象是
(3)探究实验iv中的含碳产物。取实验iv试管中的产物静置后,取上层清液继续实验:

②根据上述实验可知,实验iv中银氨溶液与甲酸反应的化学方程式为
(4)综合以上实验,小组同学得出以下结论:
a.银氨溶液与甲酸反应时,若溶液pH较低,产生银镜的主要原因是甲酸银的分解。
b.银氨溶液与甲酸反应时,若溶液pH较高,产生银镜的原因可能有
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】氯化亚铜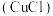 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
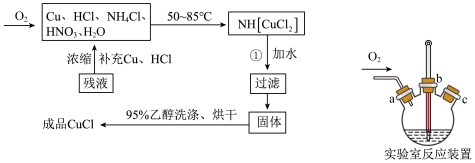
实验药品:铜丝 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。
(1)质量分数为20%的盐酸密度为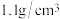 ,物质的量浓度为
,物质的量浓度为______ ;用浓盐酸配制20%盐酸需要的玻璃仪器有:______ 、烧杯、玻璃棒、胶头滴管。
(2)实验室制备 过程如下:
过程如下:
①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是______ ;
②加热至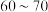 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为______ ;
三颈瓶中生成 的总的离子方程为
的总的离子方程为______ ;
将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用______ (填字母)。
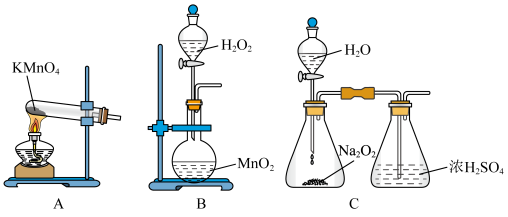
(4)下列说法不正确的是______
A.步骤Ⅰ中 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化
C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是______ 、______ (答出两条)。
(6)氯化亚铜的定量分析:
①称取样品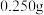 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;
②用 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:
已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
则样品中 的纯度为
的纯度为______ (结果保留3位有效数字)。
误差分析:下列操作会使滴定结果偏高的是______ 。
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
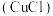 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
实验药品:铜丝
 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。(1)质量分数为20%的盐酸密度为
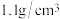 ,物质的量浓度为
,物质的量浓度为(2)实验室制备
 过程如下:
过程如下:①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭
 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是②加热至
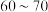 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为三颈瓶中生成
 的总的离子方程为
的总的离子方程为将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生
 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用
(4)下列说法不正确的是
A.步骤Ⅰ中
 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使
 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是
(6)氯化亚铜的定量分析:
①称取样品
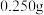 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;②用
 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
| 平衡实验次数 | 1 | 2 | 3 |
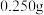 样品消耗硫酸锑标准溶液的体积 样品消耗硫酸锑标准溶液的体积 | 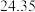 | 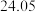 2 2 | 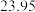 |
则样品中
 的纯度为
的纯度为误差分析:下列操作会使滴定结果偏高的是
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取
 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
您最近一年使用:0次




