1 . 四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四碘化锡的主要步骤如下:
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。
实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;
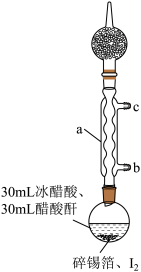
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。回答下列问题:
(1)图中仪器a的名称为________ ;冷却水从________ (填“b”或“c”)进入。
(2)仪器a上连接装有无水CaCl2的干燥管的目的是________ ;锡箔需剪碎的目的是________ ;加入醋酸酐的目的是________ 。
(3)烧瓶中发生反应的化学方程式为________ ;单质碘需过量的主要目的是________ 。
(4)反应已到终点的现象是________ 。
(5)步骤3和步骤4的目的是________ 。
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。
实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;

步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。回答下列问题:
(1)图中仪器a的名称为
(2)仪器a上连接装有无水CaCl2的干燥管的目的是
(3)烧瓶中发生反应的化学方程式为
(4)反应已到终点的现象是
(5)步骤3和步骤4的目的是
您最近一年使用:0次
2 . 草酸合铜酸钾是一种重要的化工原料,其晶体组成可表示为KxCuy(C2O4)z·wH2O。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=____ 。
②已知H2C2O4是一种二元弱酸,实验室可以用酸性高锰酸钾溶液标定草酸溶液的浓度,其离子方程式为_______ 。
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.7700 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900 g。
步骤Ⅱ 准确称取1.7700 g样品,用NH3·H2O/NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.05000 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
①第一次滴定消耗的EDTA标准溶液的体积明显偏大,可能的原因有____ (填字母)。
A.锥形瓶水洗后未干燥
B.滴定时锥形瓶中有液体溅出
C.装EDTA标准溶液的滴定管水洗后未润洗
D.开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式____ (写出计算过程)。
(1)实验室用CuSO4溶液和NaOH溶液混合制备Cu(OH)2,再将所得Cu(OH)2与KHC2O4溶液混合,可制备草酸合铜酸钾晶体。
①已知室温下,Ksp[Cu(OH)2]=2.2×10-20。制备Cu(OH)2的过程中,pH=7时,溶液中c(Cu2+)=
②已知H2C2O4是一种二元弱酸,实验室可以用酸性高锰酸钾溶液标定草酸溶液的浓度,其离子方程式为
(2)一种测定草酸合铜酸钾晶体组成的方法如下:
步骤Ⅰ 准确称取1.7700 g样品,充分加热,剩余固体为K2CO3与CuO的混合物,质量为1.0900 g。
步骤Ⅱ 准确称取1.7700 g样品,用NH3·H2O/NH4Cl溶液溶解、加水稀释,定容至100 mL。
步骤Ⅲ 准确量取步骤Ⅱ所得溶液25.00 mL于锥形瓶中,滴入指示剂,用浓度为0.05000 mol·L-1的EDTA标准溶液滴定至终点。(已知Cu2+与EDTA反应的化学计量数之比为1∶1)。
重复上述滴定操作两次,有关数据记录如下表:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 消耗EDTA标准溶液的体积/mL | 25.92 | 24.99 | 25.01 |
A.锥形瓶水洗后未干燥
B.滴定时锥形瓶中有液体溅出
C.装EDTA标准溶液的滴定管水洗后未润洗
D.开始滴定时,滴定管尖嘴部分未充满液体
②通过计算确定该样品的化学式
您最近一年使用:0次
名校
解题方法
3 . 用如图方法制备CuI(可用于检验实验室中的汞蒸气):
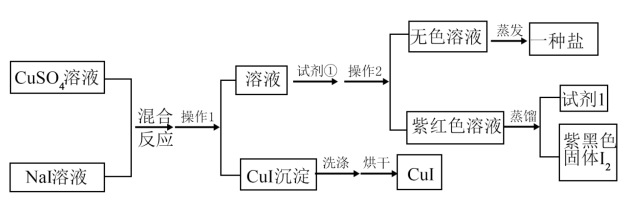
(1)CuI制备过程中,操作1的名称是___ 。操作2的名称是___ ,__ 。
(2)写出CuSO4和NaI反应的离子方程式__ 。

(1)CuI制备过程中,操作1的名称是
(2)写出CuSO4和NaI反应的离子方程式
您最近一年使用:0次
名校
4 . 实验室以NaClO3、H2SO4、SO2、H2O2和NaOH为原料,制备NaClO2和无水Na2SO4,其主要流程如下:
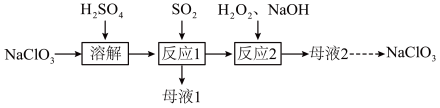
(1)反应1:SO2与溶解后的混合液反应,制得ClO2气体同时生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)ClO2是一种广谱型的消毒剂。已知在常温常压下,ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室应选用装置___________ 收集ClO2。

(3)在下图所示装置中发生反应2,生成NaClO2,反应过程中放出大量的热。
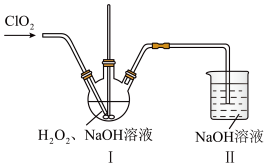
①装置Ⅰ中的反应为: ,其中ClO2表现了
,其中ClO2表现了___________ 性。用单线桥 法分析该反应,并标明电子转移数。___________ 若反应中转移4mol电子,则消耗ClO2的体积为___________ (折算为标准状况下)。装置Ⅰ应置于30℃左右的水浴中,其目的一方面保持适当的化学反应速率,另一方面防止温度过高,造成___________ 。
②装置Ⅱ中的反应为: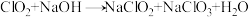 (未配平),其中氧化产物与还原产物的物质的量之比为
(未配平),其中氧化产物与还原产物的物质的量之比为___________ 。装置Ⅱ的作用是___________ 。
(4)已知温度高于60℃时,NaClO2分解,反应为: ,其中X的化学式为
,其中X的化学式为___________ 。
(5)用“单位质量的漂白剂得到的电子数目”来衡量氧化性漂白剂的漂白能力,则NaClO2的漂白能力是Cl2的___________ 倍。

(1)反应1:SO2与溶解后的混合液反应,制得ClO2气体同时生成
 ,该反应的化学方程式为
,该反应的化学方程式为(2)ClO2是一种广谱型的消毒剂。已知在常温常压下,ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室应选用装置

(3)在下图所示装置中发生反应2,生成NaClO2,反应过程中放出大量的热。

①装置Ⅰ中的反应为:
 ,其中ClO2表现了
,其中ClO2表现了②装置Ⅱ中的反应为:
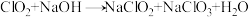 (未配平),其中氧化产物与还原产物的物质的量之比为
(未配平),其中氧化产物与还原产物的物质的量之比为(4)已知温度高于60℃时,NaClO2分解,反应为:
 ,其中X的化学式为
,其中X的化学式为(5)用“单位质量的漂白剂得到的电子数目”来衡量氧化性漂白剂的漂白能力,则NaClO2的漂白能力是Cl2的
您最近一年使用:0次
解题方法
5 . 氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
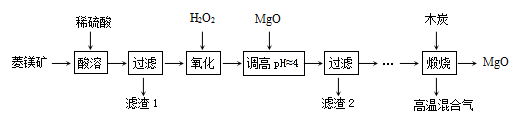
已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为___________ 。
(2)滤渣1的化学式为___________ 。
(3)“氧化”流程的目的把Fe2+氧化成Fe3+,再调节pH把Fe3+除去,写出“氧化”流程的离子方程式为___________ 。
(4)高温煅烧过程中,同时存在以下反应: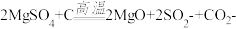 ;
;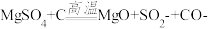 ;
;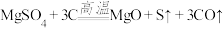 。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
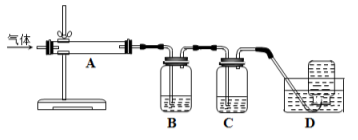
D中收集的气体是___________ (填化学式)。

已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为
(2)滤渣1的化学式为
(3)“氧化”流程的目的把Fe2+氧化成Fe3+,再调节pH把Fe3+除去,写出“氧化”流程的离子方程式为
(4)高温煅烧过程中,同时存在以下反应:
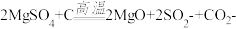 ;
;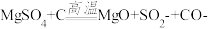 ;
;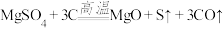 。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
D中收集的气体是
您最近一年使用:0次
名校
解题方法
6 . 脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
(1)NO2的消除。可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
①写出碳酸钠溶液消除NO2的化学方程式:___________ 。
②经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量___________ 的杂质。
(2)NO的消除。
①HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂白粉的化学方程式是___________ 。
次氯酸盐脱除NO的主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O 2HNO2
2HNO2
c.HClO+HNO2=HNO3+HCl
②下列分析正确的是___________ 。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
③研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是___________ (用离子方程式表示); 60~80 ℃ NO脱除率下降的原因是___________ 。

(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为___________ 。


(4)利用电化学装置可消除氮氧化物污染,变废为宝。上图为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为___________ 。
(1)NO2的消除。可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
①写出碳酸钠溶液消除NO2的化学方程式:
②经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量
(2)NO的消除。
①HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂白粉的化学方程式是
次氯酸盐脱除NO的主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O
 2HNO2
2HNO2c.HClO+HNO2=HNO3+HCl
②下列分析正确的是
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
③研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是

(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为


(4)利用电化学装置可消除氮氧化物污染,变废为宝。上图为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为
您最近一年使用:0次
名校
解题方法
7 . 二氧化氯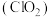 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时, 可将废水中的
可将废水中的 氧化成
氧化成 和
和 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
(2)某小组按照文献中制备 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。

①装置A用于生成 气体,该反应的化学方程式是
气体,该反应的化学方程式是_______ 。
②通入氮气的作用有两个,一个是起到搅拌作用,二是_______ 装置B的作用是_______ 。
(3)测定装置C中 溶液的浓度:取
溶液的浓度:取 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化,然后加入
酸化,然后加入_______ 作指示剂,用 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液( ),消耗标准溶液的体积为
),消耗标准溶液的体积为 ,滴定终点的现象是
,滴定终点的现象是_______ 。
(4)计算C中 溶液的物质的量浓度,写出计算过程
溶液的物质的量浓度,写出计算过程_______ 。
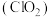 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:(1)在处理废水时,
 可将废水中的
可将废水中的 氧化成
氧化成 和
和 ,该反应的离子方程式是
,该反应的离子方程式是(2)某小组按照文献中制备
 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。
①装置A用于生成
 气体,该反应的化学方程式是
气体,该反应的化学方程式是②通入氮气的作用有两个,一个是起到搅拌作用,二是
(3)测定装置C中
 溶液的浓度:取
溶液的浓度:取 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化,然后加入
酸化,然后加入 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液( ),消耗标准溶液的体积为
),消耗标准溶液的体积为 ,滴定终点的现象是
,滴定终点的现象是(4)计算C中
 溶液的物质的量浓度,写出计算过程
溶液的物质的量浓度,写出计算过程
您最近一年使用:0次
2021-09-19更新
|
286次组卷
|
5卷引用:【全国百强校】重庆市西南大学附属中学校2019届高三第十次月考理科综合化学试题
名校
8 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。
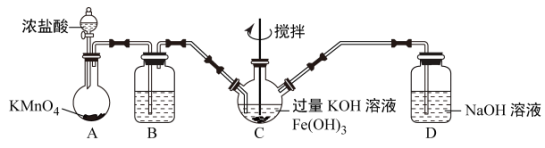
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
您最近一年使用:0次
2021-09-17更新
|
322次组卷
|
2卷引用:江苏省南京市第二十九中学2020-2021学年高一上学期10月月考化学试卷
解题方法
9 . 金属钛无毒、密度小而强度高,广泛用于航天材料、人造骨骼的制造等,有航天金属和生命金属的美誉。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:_______ ;B溶于氨水所得产物为:_______ ;
②A水解的化学反应方程式为:_______ ,理论计算可知,该反应的平衡常数很大,增加HCl浓度不足以抑制反应的进行,可是在浓盐酸中,A却几乎不水解,原因是:_______ ;
③C溶液与适量氯化铜溶液反应的化学方程式为:_______
(2)已知钛的元素电势图(E /V)为:
/V)为:
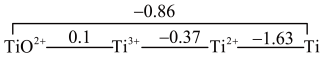
则:Ti2+_______ (填“能”或“不能”)在水溶液中稳定存在;Ti溶于热浓盐酸的化学反应方程式为_______ 。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:
②A水解的化学反应方程式为:
③C溶液与适量氯化铜溶液反应的化学方程式为:
(2)已知钛的元素电势图(E
 /V)为:
/V)为: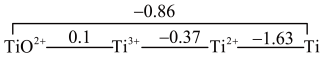
则:Ti2+
您最近一年使用:0次
名校
解题方法
10 . 某实验小组研究KI和酸性KMnO4溶液的反应。
资料:i.MnO 在酸性条件下最终被还原为Mn2+
在酸性条件下最终被还原为Mn2+
ii.酸性条件下氧化性:KMnO4>KIO3>I2
(1)实验Ⅰ中溶液呈棕黄色,推测生成了___________ ;
(2)实验小组继续对实验Ⅱ反应中初始阶段的产物成分进行探究:

①经检验,实验Ⅱ初始阶段I-的氧化产物不是I2,则“实验现象a”为___________ ;
②黑色固体是___________ ;
③经检验,在“紫色清液”中存在 ,写出生成
,写出生成 的离子方程式
的离子方程式___________ ;下列实验方案中,可用于检验“紫色清液"中 的是
的是___________ (填字母);
A.用洁净的玻璃棒蘸取“紫色清液”滴在淀粉一碘化钾试纸上,观察试纸是否变蓝色。
B.取少量“紫色清液”于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变蓝色。
C.取少量“紫色清液”于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
(3)探究实验Ⅱ中棕褐色沉淀消失的原因。

用离子方程式解释实验Ⅱ中棕褐色沉淀消失的原因:___________ ;
(4)实验后的反思:导致实验Ⅰ和实验Ⅱ中KI和酸性KMnO4溶液反应产物变化的因素是(写出两点):___________ 、___________ 。
| 实验序号 | Ⅰ | Ⅱ |
| 实验操作 |  |  |
| 实验现象 | KMnO4溶液的紫色褪去,溶液变为棕黄色 | KMnO4紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
 在酸性条件下最终被还原为Mn2+
在酸性条件下最终被还原为Mn2+ii.酸性条件下氧化性:KMnO4>KIO3>I2
(1)实验Ⅰ中溶液呈棕黄色,推测生成了
(2)实验小组继续对实验Ⅱ反应中初始阶段的产物成分进行探究:

①经检验,实验Ⅱ初始阶段I-的氧化产物不是I2,则“实验现象a”为
②黑色固体是
③经检验,在“紫色清液”中存在
 ,写出生成
,写出生成 的离子方程式
的离子方程式 的是
的是A.用洁净的玻璃棒蘸取“紫色清液”滴在淀粉一碘化钾试纸上,观察试纸是否变蓝色。
B.取少量“紫色清液”于试管中,向其中加入几滴淀粉溶液,溶液不变蓝,再加入过量NaHSO3溶液,观察溶液是否变蓝色。
C.取少量“紫色清液”于试管中,向其中加入稀硝酸酸化,再加入几滴硝酸银溶液,观察是否生成黄色沉淀。
(3)探究实验Ⅱ中棕褐色沉淀消失的原因。

用离子方程式解释实验Ⅱ中棕褐色沉淀消失的原因:
(4)实验后的反思:导致实验Ⅰ和实验Ⅱ中KI和酸性KMnO4溶液反应产物变化的因素是(写出两点):
您最近一年使用:0次
2021-05-15更新
|
1293次组卷
|
6卷引用:2020年北京高考化学真题变式题11-19
2020年北京高考化学真题变式题11-19江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题(已下线)题型04 氧化还原反应方程式的配平及其计算-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)北京市通州区2021届高三一模化学试题(已下线)微专题35 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2022年高考化学考点微专题广东实验中学2021-2022学年高三上学期11月月考化学试题



