1 . 金属钛被广泛应用于飞机、火箭和人造卫星等领域,可通过如图所示的转化制取:

(1)“反应1”生成TiCl4,化学反应方程式为:___________ ,若有0.2molCl2参与反应,反应生成TiCl4的物质的量是___________ 。
(2)“反应2”须在无氧和非水性溶剂中进行,原因是___________ 。用双线桥法表示该反应电子转移的方向和数目:
______________ 。
(3)工业制备金属钠时,发生反应的化学方程式是___________ 。

(1)“反应1”生成TiCl4,化学反应方程式为:
(2)“反应2”须在无氧和非水性溶剂中进行,原因是

(3)工业制备金属钠时,发生反应的化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 利用钒铬渣[主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2]制取Na2Cr2O7的工艺流程如图。

(1)写出基态钒原子核外电子排布式___________ ,基态铬原子外围电子轨道表示式___________ 。
(2)“酸浸”时,稀硫酸一般需过量,其目的是___________ 。
(3)已知:钒铬渣酸浸滤液初始温度大约在90℃左右。“氧化1”过程中用Na2S2O8或H2O2作氧化剂时,沉钒率与氧化温度的关系如图所示。

①该过程中,钒元素由VOSO4转化为(VO2)2SO4,则参加反应的氧化剂与还原剂物质的量之比为___________ 。
②该过程中采用Na2S2O8作氧化剂的优点是___________ 。
(4)“氧化2”过程中发生反应的离子方程式为___________ 。
(5)通过上述流程制取的Na2Cr2O7可测定钒铬渣中Cr(OH)3含量。取由2.060 g钒铬渣样品转化获得的Na2Cr2O7(含少量Na2CrO4)溶液,向其中加入2 mol·L-1 H2SO4溶液和足量KI溶液(铬元素的还原产物为Cr3+),放于暗处5 min,然后再加入几滴淀粉溶液,用0.1000 mol·L-1 Na2S2O3标准溶液滴定( ),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。___________ 。

(1)写出基态钒原子核外电子排布式
(2)“酸浸”时,稀硫酸一般需过量,其目的是
(3)已知:钒铬渣酸浸滤液初始温度大约在90℃左右。“氧化1”过程中用Na2S2O8或H2O2作氧化剂时,沉钒率与氧化温度的关系如图所示。

①该过程中,钒元素由VOSO4转化为(VO2)2SO4,则参加反应的氧化剂与还原剂物质的量之比为
②该过程中采用Na2S2O8作氧化剂的优点是
(4)“氧化2”过程中发生反应的离子方程式为
(5)通过上述流程制取的Na2Cr2O7可测定钒铬渣中Cr(OH)3含量。取由2.060 g钒铬渣样品转化获得的Na2Cr2O7(含少量Na2CrO4)溶液,向其中加入2 mol·L-1 H2SO4溶液和足量KI溶液(铬元素的还原产物为Cr3+),放于暗处5 min,然后再加入几滴淀粉溶液,用0.1000 mol·L-1 Na2S2O3标准溶液滴定(
 ),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
您最近一年使用:0次
名校
解题方法
3 . 亚氯酸钠(NaClO2)是一种杀菌漂白剂,可用于棉纺漂白,食品消毒,水处理等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:

已知:①ClO2浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
②NaClO2在温度高于60℃易分解生成NaClO3和NaCl。
(1)在“ClO2发生器”中,NaClO3与SO2反应生成ClO2和Na2SO4,该反应的化学方程式为___________ 。要证明产物中有 生成,检验的方法是:取少量产物溶于水形成溶液,
生成,检验的方法是:取少量产物溶于水形成溶液,___________ 。
(2)向“ClO2发生器”中鼓入空气的作用是(填字母)___________ 。
a.将SO2氧化成SO3,增强酸性
b.将NaClO2氧化成ClO2
c.稀释ClO2,以防分解爆炸
(3)“吸收塔”的作用是将产生的C1O2反应转化为NaClO2,在此过程中,若参加反应的H2O2为1mol,则电子转移的物质的量为___________ 。“吸收塔”中需要控制温度不超过20℃,其原因___________ 。
(4)NaClO2的溶解度曲线如图所示。从NaClO2溶液中获得NaClO2晶体的操作是:将NaClO2溶液___________ 、___________ ,过滤,洗涤,干燥。


已知:①ClO2浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
②NaClO2在温度高于60℃易分解生成NaClO3和NaCl。
(1)在“ClO2发生器”中,NaClO3与SO2反应生成ClO2和Na2SO4,该反应的化学方程式为
 生成,检验的方法是:取少量产物溶于水形成溶液,
生成,检验的方法是:取少量产物溶于水形成溶液,(2)向“ClO2发生器”中鼓入空气的作用是(填字母)
a.将SO2氧化成SO3,增强酸性
b.将NaClO2氧化成ClO2
c.稀释ClO2,以防分解爆炸
(3)“吸收塔”的作用是将产生的C1O2反应转化为NaClO2,在此过程中,若参加反应的H2O2为1mol,则电子转移的物质的量为
(4)NaClO2的溶解度曲线如图所示。从NaClO2溶液中获得NaClO2晶体的操作是:将NaClO2溶液

您最近一年使用:0次
名校
4 . 亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示。
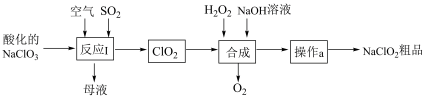
已知:①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解;NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2.
(1)反应I的的氧化剂是
___________ ;反应中需同时鼓入空气的主要目的是
___________ 。
(2)“合成”过程中发生反应的化学方程式是
___________ 。
(3)在“合成”时反应容器应控制温度低于5℃的原因是:
___________ 。
(4)“操作a”:减压条件下55℃蒸发至
___________ 、
___________ 、用介于38℃~60℃的温水洗涤、低于60℃干燥,得到NaClO2固体。
(5)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1:取待测ClO2溶液20.00mL于锥形瓶中;
步骤2:用稀H2SO4调节溶液pH <2.0,加入足量的KI晶体充分反应;
步骤3:加入几滴淀粉溶液,逐滴加入0.1 mol· L-1的Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液20.00mL;
已知:2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI
试计算溶液中ClO2的物质的量浓度(写出计算过程)______________ 。

已知:①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解;NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2.
(1)反应I的的氧化剂是
(2)“合成”过程中发生反应的化学方程式是
(3)在“合成”时反应容器应控制温度低于5℃的原因是:
(4)“操作a”:减压条件下55℃蒸发至
(5)将ClO2溶于水得到溶液,为测定其浓度,进行以下实验操作:
步骤1:取待测ClO2溶液20.00mL于锥形瓶中;
步骤2:用稀H2SO4调节溶液pH <2.0,加入足量的KI晶体充分反应;
步骤3:加入几滴淀粉溶液,逐滴加入0.1 mol· L-1的Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液20.00mL;
已知:2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI
试计算溶液中ClO2的物质的量浓度(写出计算过程)
您最近一年使用:0次
解题方法
5 . KIO3是常见的食盐加碘剂,某小组制备KIO3晶体的流程如图,请回答下列问题:

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g/cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为________ 。
(2)步骤②进行萃取操作时,需要放气,图中正确的放气图示是________ (填字母)。
a. b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是________ 。
(4)步骤⑧后,往滤液中加入一定量________ ,再次抽滤,可提高产品收率。
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液29.40mL。已知:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为________ 。
②KIO3在酸性条件下氧化KI的离子方程式为________ 。
③产品的质量分数为________ (写出计算过程,保留4位有效数字)。
在确认滴定操作无误的情况下,质量分数异常的原因可能是________ 。

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g/cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为
(2)步骤②进行萃取操作时,需要放气,图中正确的放气图示是
a.
 b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是
(4)步骤⑧后,往滤液中加入一定量
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液29.40mL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②KIO3在酸性条件下氧化KI的离子方程式为
③产品的质量分数为
在确认滴定操作无误的情况下,质量分数异常的原因可能是
您最近一年使用:0次
2023-09-21更新
|
113次组卷
|
2卷引用:江苏省常州市八校2022-2023学年高三上学期10月联合调研化学试题
6 . 铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中, (Ⅲ)以
(Ⅲ)以 形态存在:
形态存在: (Ⅱ)主要以
(Ⅱ)主要以 和
和 形态存在,其毒性是
形态存在,其毒性是 (Ⅲ)的100倍,处理含
(Ⅲ)的100倍,处理含 (Ⅵ)废水的常用方法是先将其转化为
(Ⅵ)废水的常用方法是先将其转化为 (Ⅲ),再进一步将
(Ⅲ),再进一步将 转化为
转化为 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。
(1)探究 (Ⅵ)的存在形式:
(Ⅵ)的存在形式: (Ⅵ)在水溶液中常有
(Ⅵ)在水溶液中常有 和
和 两种存在形式,该废水中两种离子的浓度与溶液
两种存在形式,该废水中两种离子的浓度与溶液 的关系如下图所示:
的关系如下图所示:
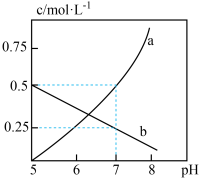
①加酸可以使 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
②计算该反应的平衡常数为______ 。(已知 时,
时,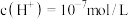 )
)
(2) (Ⅵ)转化为
(Ⅵ)转化为
在 时,向该废水中加入
时,向该废水中加入 溶液将
溶液将 (Ⅵ)还原为
(Ⅵ)还原为 ,然后再向其中加入浓氨水调节溶液
,然后再向其中加入浓氨水调节溶液 。
。
①加入 溶液后,发生反应的离子方程式为
溶液后,发生反应的离子方程式为______ 。
②还原 (Ⅵ)时,需控制溶液的
(Ⅵ)时,需控制溶液的 ,若酸性过高会造成的后果是
,若酸性过高会造成的后果是______ 。
(3) 也可用于直接还原去除废水中的
也可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 .废水的初始
.废水的初始 对去除溶液中的
对去除溶液中的 (Ⅵ)和总
(Ⅵ)和总 的影响关系如下图所示:
的影响关系如下图所示:
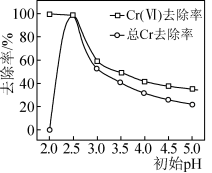
废水初始 时,
时, 和
和 反应生成
反应生成 、
、 和氢气,最终溶液的
和氢气,最终溶液的 约为9,反应生成的
约为9,反应生成的 转化为
转化为 沉淀得到有效去除,废水初始
沉淀得到有效去除,废水初始 时,虽然
时,虽然 (Ⅵ)的去除率达到100%,但总
(Ⅵ)的去除率达到100%,但总 的去除率为0.0%,其原因是
的去除率为0.0%,其原因是______ 。
 (Ⅲ)以
(Ⅲ)以 形态存在:
形态存在: (Ⅱ)主要以
(Ⅱ)主要以 和
和 形态存在,其毒性是
形态存在,其毒性是 (Ⅲ)的100倍,处理含
(Ⅲ)的100倍,处理含 (Ⅵ)废水的常用方法是先将其转化为
(Ⅵ)废水的常用方法是先将其转化为 (Ⅲ),再进一步将
(Ⅲ),再进一步将 转化为
转化为 沉淀,减少水体中总铬含量。
沉淀,减少水体中总铬含量。(1)探究
 (Ⅵ)的存在形式:
(Ⅵ)的存在形式: (Ⅵ)在水溶液中常有
(Ⅵ)在水溶液中常有 和
和 两种存在形式,该废水中两种离子的浓度与溶液
两种存在形式,该废水中两种离子的浓度与溶液 的关系如下图所示:
的关系如下图所示:
①加酸可以使
 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为②计算该反应的平衡常数为
 时,
时,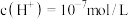 )
)(2)
 (Ⅵ)转化为
(Ⅵ)转化为
在
 时,向该废水中加入
时,向该废水中加入 溶液将
溶液将 (Ⅵ)还原为
(Ⅵ)还原为 ,然后再向其中加入浓氨水调节溶液
,然后再向其中加入浓氨水调节溶液 。
。①加入
 溶液后,发生反应的离子方程式为
溶液后,发生反应的离子方程式为②还原
 (Ⅵ)时,需控制溶液的
(Ⅵ)时,需控制溶液的 ,若酸性过高会造成的后果是
,若酸性过高会造成的后果是(3)
 也可用于直接还原去除废水中的
也可用于直接还原去除废水中的 ,反应时消耗大量
,反应时消耗大量 .废水的初始
.废水的初始 对去除溶液中的
对去除溶液中的 (Ⅵ)和总
(Ⅵ)和总 的影响关系如下图所示:
的影响关系如下图所示:
废水初始
 时,
时, 和
和 反应生成
反应生成 、
、 和氢气,最终溶液的
和氢气,最终溶液的 约为9,反应生成的
约为9,反应生成的 转化为
转化为 沉淀得到有效去除,废水初始
沉淀得到有效去除,废水初始 时,虽然
时,虽然 (Ⅵ)的去除率达到100%,但总
(Ⅵ)的去除率达到100%,但总 的去除率为0.0%,其原因是
的去除率为0.0%,其原因是
您最近一年使用:0次
名校
解题方法
7 . 葡萄糖酸锌是一种抗缺锌药物,可由 为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备
为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备 的流程如图。
的流程如图。

(1)碱洗的目的是___________ 。
(2)氧化时发生反应的离子方程式为___________ 。
(3)取“氧化”过程中的上层清液,滴加酸性 稀溶液,紫红色褪去,可能的原因是
稀溶液,紫红色褪去,可能的原因是_____ 。
(4)由过滤所得的滤液为原料制备 ,请补充完整相应的实验方案:向滤液中
,请补充完整相应的实验方案:向滤液中___________ ,过滤、晾干,得到 。
。
实验中须用到的试剂:锌粉、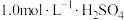 。
。
(5)以 为原料可制得葡萄糖酸锌
为原料可制得葡萄糖酸锌 。为测定葡萄糖酸锌样品的纯度,进行下列实验。
。为测定葡萄糖酸锌样品的纯度,进行下列实验。
步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的 ,振荡。
,振荡。
步骤3:用 锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知:
锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知: 与EDTA反应的化学计量比为1∶1)。
与EDTA反应的化学计量比为1∶1)。
①计算此产品中锌元素的质量分数:___________ 。(写出计算过程)
②葡萄糖酸锌中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(样品纯或不纯)___________ 。
 为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备
为原料制得。工业上以废锌铁合金(主要成分为Zn,含有少量的Fe、Fe2O3、ZnO、CuO和油污等杂质)为原料制备 的流程如图。
的流程如图。
(1)碱洗的目的是
(2)氧化时发生反应的离子方程式为
(3)取“氧化”过程中的上层清液,滴加酸性
 稀溶液,紫红色褪去,可能的原因是
稀溶液,紫红色褪去,可能的原因是(4)由过滤所得的滤液为原料制备
 ,请补充完整相应的实验方案:向滤液中
,请补充完整相应的实验方案:向滤液中 。
。实验中须用到的试剂:锌粉、
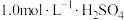 。
。(5)以
 为原料可制得葡萄糖酸锌
为原料可制得葡萄糖酸锌 。为测定葡萄糖酸锌样品的纯度,进行下列实验。
。为测定葡萄糖酸锌样品的纯度,进行下列实验。步骤1:称取5.200g样品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,滴入少量的铬黑T作指示剂。
步骤2:向锥形瓶中加入过量的
 ,振荡。
,振荡。步骤3:用
 锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知:
锌标准溶液滴定过量的EDTA至终点,消耗锌标准溶液16.00mL(已知: 与EDTA反应的化学计量比为1∶1)。
与EDTA反应的化学计量比为1∶1)。①计算此产品中锌元素的质量分数:
②葡萄糖酸锌中锌元素的含量为14.28%,对照①计算结果,产生误差的可能原因是(样品纯或不纯)
您最近一年使用:0次
解题方法
8 . 某电镀废水中含有氰化物、铬(Ⅵ)等污染物,需要经过处理后才能排放。
(1)废水中铬(Ⅵ)主要以 和
和 形式存在,处理的方法是将铬(Ⅵ)还原为
形式存在,处理的方法是将铬(Ⅵ)还原为 ,再转化为
,再转化为 沉淀。常温下,
沉淀。常温下, 与
与 在溶液中存在平衡:
在溶液中存在平衡: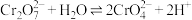 ,该反应的平衡常数
,该反应的平衡常数 。
。
①若废水中Cr(Ⅵ)的总的物质的量浓度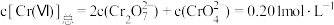 ,要将废水中
,要将废水中 调节为100:1,则需调节溶液的
调节为100:1,则需调节溶液的
___________ 。(忽略调节pH时溶液体积的变化)
②一种还原酸性废水中Cr(Ⅵ)的方法是向其中加入 ,写出
,写出 所发生反应的离子方程式:
所发生反应的离子方程式:___________ 。
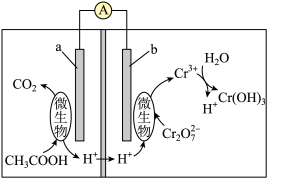
③一种还原酸性废水中Cr(Ⅵ)的方法是加入铁屑。实验发现,在不改变铁屑总量的情况下,加入一定的烟道灰(一种细小的炭粒),铬(Ⅵ)还原速率加快。加入烟道灰后铬(Ⅵ)还原速率加快的原因是___________ 。
④某微生物电池还原Cr(Ⅵ)的工作原理如图所示。电池工作时a电极发生的电极反应式为___________ 。
(2)通过电激发产生 和
和 可处理废水中的
可处理废水中的 ,其可能反应机理如图所示。
,其可能反应机理如图所示。
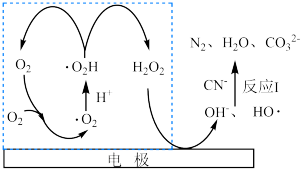
①反应Ⅰ的离子方程式为___________ 。
②虚线方框内的过程可描述为___________ 。
(1)废水中铬(Ⅵ)主要以
 和
和 形式存在,处理的方法是将铬(Ⅵ)还原为
形式存在,处理的方法是将铬(Ⅵ)还原为 ,再转化为
,再转化为 沉淀。常温下,
沉淀。常温下, 与
与 在溶液中存在平衡:
在溶液中存在平衡: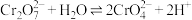 ,该反应的平衡常数
,该反应的平衡常数 。
。①若废水中Cr(Ⅵ)的总的物质的量浓度
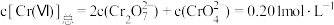 ,要将废水中
,要将废水中 调节为100:1,则需调节溶液的
调节为100:1,则需调节溶液的
②一种还原酸性废水中Cr(Ⅵ)的方法是向其中加入
 ,写出
,写出 所发生反应的离子方程式:
所发生反应的离子方程式:③一种还原酸性废水中Cr(Ⅵ)的方法是加入铁屑。实验发现,在不改变铁屑总量的情况下,加入一定的烟道灰(一种细小的炭粒),铬(Ⅵ)还原速率加快。加入烟道灰后铬(Ⅵ)还原速率加快的原因是
④某微生物电池还原Cr(Ⅵ)的工作原理如图所示。电池工作时a电极发生的电极反应式为

(2)通过电激发产生
 和
和 可处理废水中的
可处理废水中的 ,其可能反应机理如图所示。
,其可能反应机理如图所示。
①反应Ⅰ的离子方程式为
②虚线方框内的过程可描述为
您最近一年使用:0次
名校
9 . 莫尔盐[ ,相对分子质量为392]能溶于水,难溶于无水乙醇,是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某兴趣小组欲制备莫尔盐并测定其纯度,采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
,相对分子质量为392]能溶于水,难溶于无水乙醇,是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某兴趣小组欲制备莫尔盐并测定其纯度,采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:

(1)仪器a的名称为_______ 。配制硫酸铵饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是_______ 。
(2)待C中逸出 较为纯净后,
较为纯净后,_______ (填具体操作),A中液体会自动流入B中。此时B中发生的主要反应的化学方程式为_______ 。
(3)制备结束后,将B中固液混合物过滤,所得莫尔盐可用_______ (填试剂名称)进行洗涤。
(4)装置C的作用为_______ 。
(5)实验小组对样品进行纯度检测,取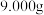 样品配成
样品配成 溶液,从中取出
溶液,从中取出 溶液,用
溶液,用 的酸性
的酸性 溶液滴定,消耗酸性
溶液滴定,消耗酸性 溶液
溶液 ,该样品的纯度为
,该样品的纯度为_______ (保留至0.1%),写出计算过程。
 ,相对分子质量为392]能溶于水,难溶于无水乙醇,是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某兴趣小组欲制备莫尔盐并测定其纯度,采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
,相对分子质量为392]能溶于水,难溶于无水乙醇,是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某兴趣小组欲制备莫尔盐并测定其纯度,采用的方法是先在封闭体系中利用铁和稀硫酸制备硫酸亚铁溶液,再用制得的硫酸亚铁溶液和硫酸铵饱和溶液反应制得。实验装置如图所示,回答下列问题:
(1)仪器a的名称为
(2)待C中逸出
 较为纯净后,
较为纯净后,(3)制备结束后,将B中固液混合物过滤,所得莫尔盐可用
(4)装置C的作用为
(5)实验小组对样品进行纯度检测,取
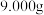 样品配成
样品配成 溶液,从中取出
溶液,从中取出 溶液,用
溶液,用 的酸性
的酸性 溶液滴定,消耗酸性
溶液滴定,消耗酸性 溶液
溶液 ,该样品的纯度为
,该样品的纯度为
您最近一年使用:0次
2023-07-31更新
|
267次组卷
|
2卷引用:江苏省苏州市2022-2023学年高一上学期12月期末考试化学试题
解题方法
10 . 实验室制备 并探究其性质及应用的方案如下。回答下列问题:
并探究其性质及应用的方案如下。回答下列问题:
(1)制备 (部分固定装置略)
(部分固定装置略)
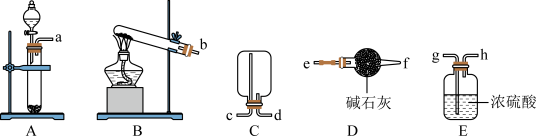
①制备二氧化硫可以选择装置_______ (填大写字母),其反应的化学方程式为_______ 。
②利用图中装置收集一瓶干燥的 ,其连接顺序:发生装置
,其连接顺序:发生装置
_______ (按气流方向,填小写字母)。
(2)制备大苏打
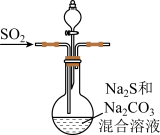
已知 在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和
在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和 。
。
①将 通入装有
通入装有 、
、 混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入
混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入 气体,当溶液中再次出现
气体,当溶液中再次出现_______ 现象时,反应基本结束。
②将①反应后的溶液蒸发浓缩,冷却结晶,过滤,洗涤,_______ ,可得到 固体。
固体。
③为提高结晶效果,冷却结晶时可往溶液中加入_______ 。
 并探究其性质及应用的方案如下。回答下列问题:
并探究其性质及应用的方案如下。回答下列问题:(1)制备
 (部分固定装置略)
(部分固定装置略)
①制备二氧化硫可以选择装置
②利用图中装置收集一瓶干燥的
 ,其连接顺序:发生装置
,其连接顺序:发生装置
(2)制备大苏打


已知
 在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和
在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和 。
。①将
 通入装有
通入装有 、
、 混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入
混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入 气体,当溶液中再次出现
气体,当溶液中再次出现②将①反应后的溶液蒸发浓缩,冷却结晶,过滤,洗涤,
 固体。
固体。③为提高结晶效果,冷却结晶时可往溶液中加入
您最近一年使用:0次



