名校
解题方法
1 . 以含钼( )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下:
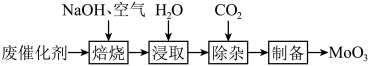
(1)焙烧。将废催化剂和足量 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有 、
、 、
、___________ 。欲提高单位时间内钼的浸取率,可以采取的措施有___________ (任写一点)。
(3)除杂。向浸取后的滤液中通入过量 ,过滤。通入过量
,过滤。通入过量 的目的
的目的___________ 。
(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的 小于6,使
小于6,使 转化为
转化为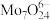 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为___________ 。
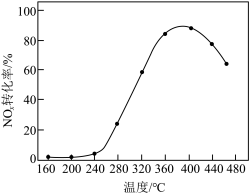
(5)应用。将 制成
制成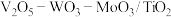 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度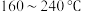 之间,
之间, 转化率不高的原因是
转化率不高的原因是___________ 。
 )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下:
(1)焙烧。将废催化剂和足量
 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有
 、
、 、
、(3)除杂。向浸取后的滤液中通入过量
 ,过滤。通入过量
,过滤。通入过量 的目的
的目的(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的
 小于6,使
小于6,使 转化为
转化为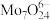 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为(5)应用。将
 制成
制成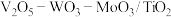 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度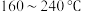 之间,
之间, 转化率不高的原因是
转化率不高的原因是
您最近一年使用:0次
2024-01-28更新
|
830次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题2024届江苏省连云港市高三第一次调研考试(一模)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
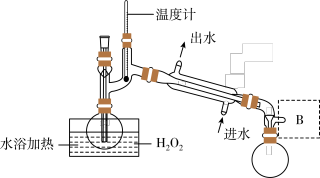
2 . ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。

已知:
2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
请回答:
(1)仪器A的作用是_______ ;冰水浴冷却的目的是_______ ,_______ (写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因_______ 。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_______ (用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过如图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是_______ ,馏出物是_______ 。

已知:
2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
请回答:
(1)仪器A的作用是
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①
(4)H2O2浓度对反应速率有影响。通过如图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是

您最近一年使用:0次
名校
解题方法
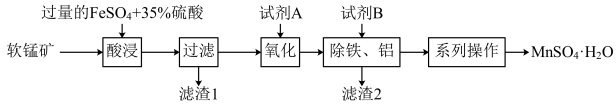
3 . 硫酸锰晶体(MnSO4·H2O)常用作动物饲料的添加剂。工业上以软锰矿(含MnO2和少量的Fe2O3、Al2O3、SiO2)为原料制备硫酸锰晶体的流程如图:
已知几种金属离子沉淀的pH如表所示:
回答下列问题:
(1)“酸浸”前需要将软锰矿粉碎,粉碎的目的是______ ,“酸浸”中MnO2和FeSO4反应的离子方程式为______ 。
(2)“滤渣1”的主要成分是_______ 填化学式)。“系列操作”包括______ 、降温结晶、过滤、洗涤、干燥等。
(3)从绿色化学角度分析,试剂A宜选择______ (填标号)。
a.HNO3 b.H2O2 c.Cl2 d.O3
(4)如果省略“氧化”工艺,产品中可能会混有______ (填化学式)。
(5)测定产品纯度:准确称取wg样品,加适量ZnO及H2O煮沸、冷却后,转移至锥形瓶中,用cmol•L-1KMnO4标准溶液滴定至溶液呈红色且半分钟不褪色,消耗KMnO4标准溶液VmL。MnSO4·H2O样品的纯度为______ (用含w、c、V的代数式表示)。
已知:①2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4。
②杂质不与KMnO4反应。

已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.8 |
回答下列问题:
(1)“酸浸”前需要将软锰矿粉碎,粉碎的目的是
(2)“滤渣1”的主要成分是
(3)从绿色化学角度分析,试剂A宜选择
a.HNO3 b.H2O2 c.Cl2 d.O3
(4)如果省略“氧化”工艺,产品中可能会混有
(5)测定产品纯度:准确称取wg样品,加适量ZnO及H2O煮沸、冷却后,转移至锥形瓶中,用cmol•L-1KMnO4标准溶液滴定至溶液呈红色且半分钟不褪色,消耗KMnO4标准溶液VmL。MnSO4·H2O样品的纯度为
已知:①2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4。
②杂质不与KMnO4反应。
您最近一年使用:0次
2023-03-02更新
|
211次组卷
|
3卷引用:湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题
湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题四川省绵阳市高中2022-2023学年高二理科突击班下学期3月月考化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(工业流程题)
名校
解题方法
4 . 四溴化乙炔( )是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分
)是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分 ,少量CaS、
,少量CaS、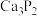 、
、 等)和
等)和 等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:
等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:

已知:四溴化乙炔熔点为1℃,沸点为244℃,密度为 ,难溶于水。
,难溶于水。
回答下列问题:
(1)装置Ⅰ中 与水反应的化学方程式为
与水反应的化学方程式为_______ ,该反应剧烈,为了得到平缓的乙炔气流,可采取的措施是_______ (任写一条)。
(2)装置Ⅱ的目的是除去 、
、 及
及 杂质,其中溶液与
杂质,其中溶液与 反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:
反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:_______ 。
(3)装置Ⅲ在液溴液面上加入一层水的目的是_______ ;装置Ⅲ中表明已反应完成的现象是_______ ;已知装置Ⅲ反应后的体系含有多种物质,简述获得纯净的四溴化乙炔的操作:_______ 。
(4)装置Ⅴ的目的是除去未反应的乙炔。在碱性条件下, 与
与 反应生成碳酸盐和
反应生成碳酸盐和 ,则该反应中参与反应的氧化剂和还原剂的物质的量之比为
,则该反应中参与反应的氧化剂和还原剂的物质的量之比为_______ 。
 )是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分
)是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分 ,少量CaS、
,少量CaS、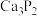 、
、 等)和
等)和 等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:
等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:
已知:四溴化乙炔熔点为1℃,沸点为244℃,密度为
 ,难溶于水。
,难溶于水。回答下列问题:
(1)装置Ⅰ中
 与水反应的化学方程式为
与水反应的化学方程式为(2)装置Ⅱ的目的是除去
 、
、 及
及 杂质,其中溶液与
杂质,其中溶液与 反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:
反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:(3)装置Ⅲ在液溴液面上加入一层水的目的是
(4)装置Ⅴ的目的是除去未反应的乙炔。在碱性条件下,
 与
与 反应生成碳酸盐和
反应生成碳酸盐和 ,则该反应中参与反应的氧化剂和还原剂的物质的量之比为
,则该反应中参与反应的氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
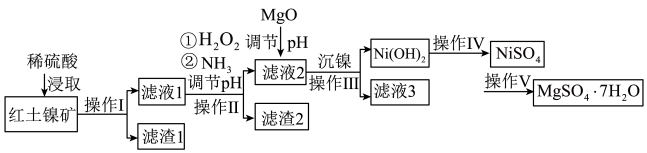
5 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;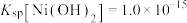 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;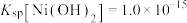 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1018次组卷
|
7卷引用: 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
6 . 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪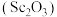 的一种流程如下:
的一种流程如下:
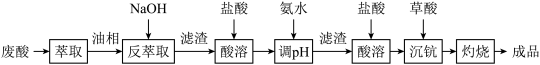
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________________ 。
(2)常温下,先加入氨水调节 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节 ,滤液中
,滤液中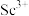 的浓度为
的浓度为__________ 。
{已知: 、
、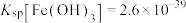 、
、 }
}
(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:___________________________ 。
(4)草酸钪“灼烧”氧化的化学方程式为________________________________________________ 。
(5)废酸中含钪量为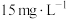 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为__________ 。
(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:
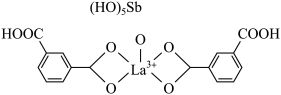
该结构中,中心离子 配位数为
配位数为__________ 。
(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:
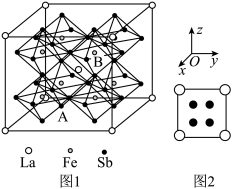
①若图中A点锑原子的坐标为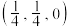 ,则B点铁原子的坐标为
,则B点铁原子的坐标为__________ 。
②若该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为__________ cm。
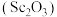 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)常温下,先加入氨水调节
 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是 ,滤液中
,滤液中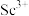 的浓度为
的浓度为{已知:
 、
、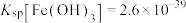 、
、 }
}(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:
(4)草酸钪“灼烧”氧化的化学方程式为
(5)废酸中含钪量为
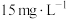 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:

该结构中,中心离子
 配位数为
配位数为(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:

①若图中A点锑原子的坐标为
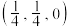 ,则B点铁原子的坐标为
,则B点铁原子的坐标为②若该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为
您最近一年使用:0次
2023-02-06更新
|
583次组卷
|
3卷引用:湖南师范大学附属中学2022-2023学年高三上学期月考卷(六)化学试题
名校
7 . 下表列出了①~⑦共7种元素在元素周期表中的位置。
回答下列问题:
(1)①可以形成原子空间排列方式不同的多种单质,这些不同的单质之间互称为_______ 。
(2)①③形成的高价态化合物的电子式为_______ 。
(3)⑤的单质在工业上常用于冶炼熔点较高的金属,如用 冶炼V,该反应的化学方程式为
冶炼V,该反应的化学方程式为_______ 。
(4)③⑤⑦三种元素的简单离子半径由大到小的顺序是_______ (填离子符号)。
(5)②和⑦对应的简单氢化物能相互反应,其产物中含有的化学键有_______ 。
(6)根据元素周期律,②的非金属性比⑥强,但②的单质却比⑥的单质稳定,原因是_______ 。
(7)④⑤的最高价氧化物对应水化物反应的离子方程式为_______ 。
(8)③④可形成两种化合物,其中呈淡黄色的物质为A,另一种为B.A中,阴、阳离子个数比为_______ ;将26.4 g这两种物质的混合物投入足量水中,反应后,水溶液增重24.8 g,则A与B的物质的量之比为_______ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)①可以形成原子空间排列方式不同的多种单质,这些不同的单质之间互称为
(2)①③形成的高价态化合物的电子式为
(3)⑤的单质在工业上常用于冶炼熔点较高的金属,如用
 冶炼V,该反应的化学方程式为
冶炼V,该反应的化学方程式为(4)③⑤⑦三种元素的简单离子半径由大到小的顺序是
(5)②和⑦对应的简单氢化物能相互反应,其产物中含有的化学键有
(6)根据元素周期律,②的非金属性比⑥强,但②的单质却比⑥的单质稳定,原因是
(7)④⑤的最高价氧化物对应水化物反应的离子方程式为
(8)③④可形成两种化合物,其中呈淡黄色的物质为A,另一种为B.A中,阴、阳离子个数比为
您最近一年使用:0次
名校
8 . 我国C919大飞机制造过程中用到的某些新型材料是以氯化亚铜作催化剂制备的。氯化亚铜是白色粉末,不溶于水、乙醇、硫酸,露置空气中迅速被氧化成绿色,在干燥空气中稳定。某实验小组设计如下装置,用二氧化硫、硫酸铜和氯化钠制备氯化亚铜。
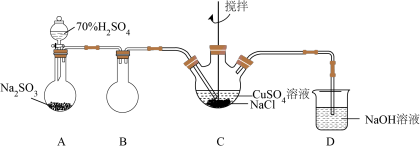
(1)装置A是制备二氧化硫的装置,A中反应方程式是___________ ,反应不选用稀硫酸的原因是___________ 。
(2)装置B的作用是___________ 。
(3)装置C中主要发生了两个反应,通入二氧化硫前, 与
与 在溶液中反应生成
在溶液中反应生成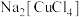 和
和 混合溶液;将
混合溶液;将 通入上述溶液中,
通入上述溶液中,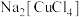 转化为
转化为 沉淀和茶褐色的
沉淀和茶褐色的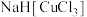 溶液,反应中的还原产物为
溶液,反应中的还原产物为___________ 。
(4)在无氧的条件下,向三颈烧瓶中加水稀释,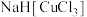 会完全水解转化为
会完全水解转化为 沉淀,完全沉淀的实验现象为
沉淀,完全沉淀的实验现象为___________ 。
(5)完全反应后,倾出清液,抽滤出沉淀,沉淀依次用水、无水乙醇洗涤多次,干燥得白色粉末固体,用无水乙醇洗涤的目的是___________ 。
(6)以碳棒为电极电解 溶液也可得到
溶液也可得到 。写出电解
。写出电解 溶液后的阴极上发生的反应为
溶液后的阴极上发生的反应为___________ 。
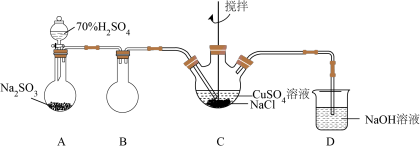
(1)装置A是制备二氧化硫的装置,A中反应方程式是
(2)装置B的作用是
(3)装置C中主要发生了两个反应,通入二氧化硫前,
 与
与 在溶液中反应生成
在溶液中反应生成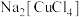 和
和 混合溶液;将
混合溶液;将 通入上述溶液中,
通入上述溶液中,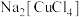 转化为
转化为 沉淀和茶褐色的
沉淀和茶褐色的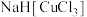 溶液,反应中的还原产物为
溶液,反应中的还原产物为(4)在无氧的条件下,向三颈烧瓶中加水稀释,
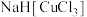 会完全水解转化为
会完全水解转化为 沉淀,完全沉淀的实验现象为
沉淀,完全沉淀的实验现象为(5)完全反应后,倾出清液,抽滤出沉淀,沉淀依次用水、无水乙醇洗涤多次,干燥得白色粉末固体,用无水乙醇洗涤的目的是
(6)以碳棒为电极电解
 溶液也可得到
溶液也可得到 。写出电解
。写出电解 溶液后的阴极上发生的反应为
溶液后的阴极上发生的反应为
您最近一年使用:0次
名校
解题方法
9 . 一种以废旧钴酸锂电池材料(主要成分为 ,含单质
,含单质 及为改善电池性能添加的单质
及为改善电池性能添加的单质 等)为原料回收钴酸锂的工艺流程如下:
等)为原料回收钴酸锂的工艺流程如下:

回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解后,再经“碱浸”处理,为提高碱浸速率,可采取的措施有___________ (任写一点)。
(2)用 溶液“碱浸”所得滤液中含有金属元素的阴离子为
溶液“碱浸”所得滤液中含有金属元素的阴离子为___________ 。
(3)“酸浸”时可将钴元素转化为 ,在此过程中加入的
,在此过程中加入的 作
作___________ 剂,同时“酸浸”过程中,由于有 的加入,铜也可以被氧化浸出,写出铜被浸出的离子方程式:
的加入,铜也可以被氧化浸出,写出铜被浸出的离子方程式:___________ 。
(4)“萃取铜”中的有机萃取剂用 表示,发生的萃取反应可表示为
表示,发生的萃取反应可表示为 。为回收铜,可用一定浓度的
。为回收铜,可用一定浓度的___________ (填“酸性溶液”或“碱性溶液”)将“有机相”中的铜反萃取到水相中。
(5)“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,“萃取铜”后的溶液需调 至5.0以上将铝离子沉淀除去。若
至5.0以上将铝离子沉淀除去。若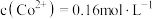 ,为避免析出
,为避免析出 沉淀,则调
沉淀,则调 不能超过
不能超过___________ 。{已知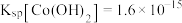 }
}
(6)“钴、锂共沉淀”时析出 和
和 ,经过滤、无水乙醇洗涤、
,经过滤、无水乙醇洗涤、 干燥后在
干燥后在 空气中煅烧,实验室中用于煅烧的陶瓷仪器名称
空气中煅烧,实验室中用于煅烧的陶瓷仪器名称___________ 。
 ,含单质
,含单质 及为改善电池性能添加的单质
及为改善电池性能添加的单质 等)为原料回收钴酸锂的工艺流程如下:
等)为原料回收钴酸锂的工艺流程如下:
回答下列问题:
(1)废旧钴酸锂电池需经放电、拆解后,再经“碱浸”处理,为提高碱浸速率,可采取的措施有
(2)用
 溶液“碱浸”所得滤液中含有金属元素的阴离子为
溶液“碱浸”所得滤液中含有金属元素的阴离子为(3)“酸浸”时可将钴元素转化为
 ,在此过程中加入的
,在此过程中加入的 作
作 的加入,铜也可以被氧化浸出,写出铜被浸出的离子方程式:
的加入,铜也可以被氧化浸出,写出铜被浸出的离子方程式:(4)“萃取铜”中的有机萃取剂用
 表示,发生的萃取反应可表示为
表示,发生的萃取反应可表示为 。为回收铜,可用一定浓度的
。为回收铜,可用一定浓度的(5)“碱浸”时少量未浸出的残余铝可在“酸浸”时浸出,“萃取铜”后的溶液需调
 至5.0以上将铝离子沉淀除去。若
至5.0以上将铝离子沉淀除去。若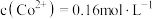 ,为避免析出
,为避免析出 沉淀,则调
沉淀,则调 不能超过
不能超过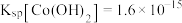 }
}(6)“钴、锂共沉淀”时析出
 和
和 ,经过滤、无水乙醇洗涤、
,经过滤、无水乙醇洗涤、 干燥后在
干燥后在 空气中煅烧,实验室中用于煅烧的陶瓷仪器名称
空气中煅烧,实验室中用于煅烧的陶瓷仪器名称
您最近一年使用:0次
名校
10 . 硫酸铁铵[ ]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含杂质氯化钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含杂质氯化钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。

请回答下列问题:
(1)滤渣A的主要成分:_______ 。
(2)下列物质中最适合的氧化剂B是_______ (填字母);反应的离子方程式为_______ 。
a. b.
b. c.
c. d.
d.
(3)加热蒸发步骤中可能用到的仪器是_______ (填字母)。
A.蒸发皿 B.坩埚 C.玻璃棒
(4)往硫酸亚铁溶液中加入氢氧化钠溶液产生的现象是_______ ,写出上述过程中沉淀颜色变化的化学方程式:_______ 。
(5)检验硫酸铁铵溶液中 的方法是
的方法是_______ 。
 ]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含杂质氯化钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含杂质氯化钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
请回答下列问题:
(1)滤渣A的主要成分:
(2)下列物质中最适合的氧化剂B是
a.
 b.
b. c.
c. d.
d.
(3)加热蒸发步骤中可能用到的仪器是
A.蒸发皿 B.坩埚 C.玻璃棒
(4)往硫酸亚铁溶液中加入氢氧化钠溶液产生的现象是
(5)检验硫酸铁铵溶液中
 的方法是
的方法是
您最近一年使用:0次





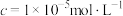 )时的pH
)时的pH

