1 . 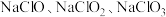 等含氯化合物在生活中有着重要应用。
等含氯化合物在生活中有着重要应用。
(1) 的制备。将
的制备。将 通入
通入 溶液中反应生成
溶液中反应生成 ,该反应为放热反应,温度过高会有副产物
,该反应为放热反应,温度过高会有副产物 生成。
生成。
①提高单位时间内 的产率,可以采取的可行措施为
的产率,可以采取的可行措施为______ 序号)。
A.适当减缓通入 速率 B.充分搅拌浆料 C.加水稀释
速率 B.充分搅拌浆料 C.加水稀释 溶液
溶液
②反应结束后,测得溶液中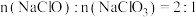 ,则该反应的化学方程式为
,则该反应的化学方程式为______ ;
③用 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。 溶液的初始
溶液的初始 越小,
越小, 转化率越高的原因是
转化率越高的原因是______ ; 的制备。
的制备。 是一种高效的消毒剂,其生产工艺流程如下。
是一种高效的消毒剂,其生产工艺流程如下。 和
和 中
中 的化合价分别为
的化合价分别为______ 、______ ;
②“吸收”时, 不能用
不能用 代替的理由是
代替的理由是______ ;
③实验室可以利用 与
与 反应可以制得
反应可以制得 。若生成
。若生成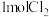 ,反应中转移的电子数为
,反应中转移的电子数为______ 。
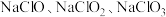 等含氯化合物在生活中有着重要应用。
等含氯化合物在生活中有着重要应用。(1)
 的制备。将
的制备。将 通入
通入 溶液中反应生成
溶液中反应生成 ,该反应为放热反应,温度过高会有副产物
,该反应为放热反应,温度过高会有副产物 生成。
生成。①提高单位时间内
 的产率,可以采取的可行措施为
的产率,可以采取的可行措施为A.适当减缓通入
 速率 B.充分搅拌浆料 C.加水稀释
速率 B.充分搅拌浆料 C.加水稀释 溶液
溶液②反应结束后,测得溶液中
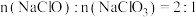 ,则该反应的化学方程式为
,则该反应的化学方程式为③用
 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。 溶液的初始
溶液的初始 越小,
越小, 转化率越高的原因是
转化率越高的原因是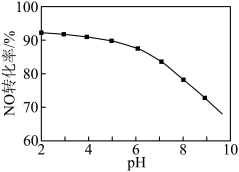
 的制备。
的制备。 是一种高效的消毒剂,其生产工艺流程如下。
是一种高效的消毒剂,其生产工艺流程如下。
 和
和 中
中 的化合价分别为
的化合价分别为②“吸收”时,
 不能用
不能用 代替的理由是
代替的理由是③实验室可以利用
 与
与 反应可以制得
反应可以制得 。若生成
。若生成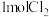 ,反应中转移的电子数为
,反应中转移的电子数为
您最近一年使用:0次
2 . 环境保护是化学的重要任务,请完成下列问题。
(1)采用“联合脱硫脱氮技术”处理烟气(含 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是___________ 。
②反应釜 中
中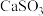 转化为
转化为 反应的化学方程式为
反应的化学方程式为___________ 。
(2)烟气(主要污染物 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
①烟气经 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为___________ 。
②尿素 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为___________ 。
(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为___________ 。
②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量___________ (填“大于”“小于”或“等于”) 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是___________ 。
(1)采用“联合脱硫脱氮技术”处理烟气(含
 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。

 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是②反应釜
 中
中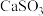 转化为
转化为 反应的化学方程式为
反应的化学方程式为(2)烟气(主要污染物
 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。①烟气经
 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为②尿素
 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用
 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收
 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
您最近一年使用:0次
解题方法
3 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,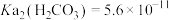 ,
,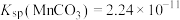
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: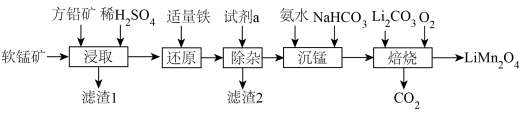
 ,
,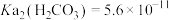 ,
,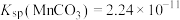
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
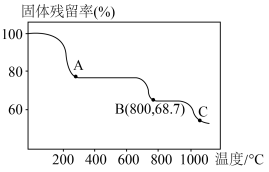
您最近一年使用:0次
解题方法
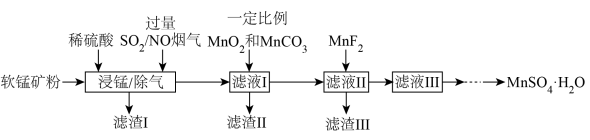
4 . 燃煤烟气中含有大量 和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备
和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备 ,部分流程如下。
,部分流程如下。
已知:①软锰矿(主要成分为 ,另含有少量
,另含有少量 、CaO、
、CaO、 等杂质)。
等杂质)。
② ;
;
③
 发生的主要化学方程式为
发生的主要化学方程式为________ 。
②滤渣Ⅰ的主要成分为________ 。(写化学式)
(2)“除气”过程,烟气中混入一定量 可提高NO脱除率,其可能的原因是:
可提高NO脱除率,其可能的原因是:________ 。
(3)“滤液Ⅰ”中加入等物质的量 和
和 ,反应的离子方程式为:
,反应的离子方程式为:________ 。
(4)“滤液Ⅱ”中用 可除去
可除去 ,结合反应方程式和定量计算说明原因
,结合反应方程式和定量计算说明原因________ 。(当反应平衡常数大于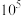 时,可认为反应完全)。
时,可认为反应完全)。
(5)“滤液Ⅲ”可制得 。已知:
。已知:
①在烟气吸收过程中,除生成 外,还容易产生连二硫酸锰(
外,还容易产生连二硫酸锰( ),当温度
),当温度
超过35℃, 会快速分解为
会快速分解为 和
和 。
。
②部分锰盐在不同温度下的溶解度和析出晶体的组成如图。 的实验方案为:
的实验方案为:________ 。(须使用的试剂为: L NaOH溶液,无水乙醇)
L NaOH溶液,无水乙醇)
 和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备
和NO。某实验室模拟“软锰矿浆同步脱硫脱硝技术”并制备 ,部分流程如下。
,部分流程如下。已知:①软锰矿(主要成分为
 ,另含有少量
,另含有少量 、CaO、
、CaO、 等杂质)。
等杂质)。②
 ;
;
③

 发生的主要化学方程式为
发生的主要化学方程式为②滤渣Ⅰ的主要成分为
(2)“除气”过程,烟气中混入一定量
 可提高NO脱除率,其可能的原因是:
可提高NO脱除率,其可能的原因是:(3)“滤液Ⅰ”中加入等物质的量
 和
和 ,反应的离子方程式为:
,反应的离子方程式为:(4)“滤液Ⅱ”中用
 可除去
可除去 ,结合反应方程式和定量计算说明原因
,结合反应方程式和定量计算说明原因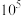 时,可认为反应完全)。
时,可认为反应完全)。(5)“滤液Ⅲ”可制得
 。已知:
。已知:①在烟气吸收过程中,除生成
 外,还容易产生连二硫酸锰(
外,还容易产生连二硫酸锰( ),当温度
),当温度超过35℃,
 会快速分解为
会快速分解为 和
和 。
。②部分锰盐在不同温度下的溶解度和析出晶体的组成如图。

 的实验方案为:
的实验方案为: L NaOH溶液,无水乙醇)
L NaOH溶液,无水乙醇)
您最近一年使用:0次
2024·黑龙江哈尔滨·三模
名校
5 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取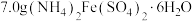 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入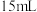 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至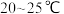 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加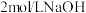 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于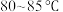 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,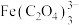 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
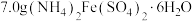 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入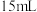 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至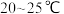 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加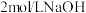 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于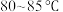 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
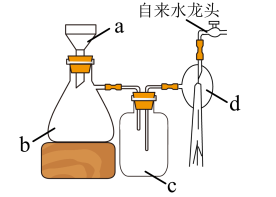
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,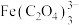 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
7日内更新
|
373次组卷
|
3卷引用:江苏省南京外国语学校2024届高三下学期二模化学试题
2024·陕西榆林·三模
名校
6 .  (三氯化六氨合钴,
(三氯化六氨合钴,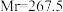 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知:①在 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示;
在水中的溶解度如图所示; 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。
制备步骤如下:
Ⅰ. 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。 锥形瓶内加入
锥形瓶内加入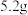 研细的
研细的 、
、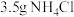 和
和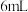 水,加热溶解后加入
水,加热溶解后加入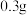 活性炭作催化剂。
活性炭作催化剂。
Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入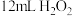 溶液。
溶液。
Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的 晶体
晶体 。
。
请回答下列问题:
(1)仪器a的名称为___________ 。
(2)用图中的装置组合制备 ,仪器的连接顺序为
,仪器的连接顺序为___________ 。装置B的作用是___________ 。
(3)制备三氯化六氨合钴的反应方程式为___________ 。
(4)在制备 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因___________ 。
(5)步骤Ⅲ中在加入 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是___________ 。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为___________ 、___________ 。
(7)制得 产品的产率为
产品的产率为___________ %(精确到0.1%)。
 (三氯化六氨合钴,
(三氯化六氨合钴,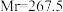 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;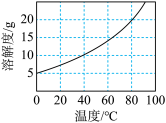
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入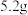 研细的
研细的 、
、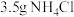 和
和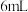 水,加热溶解后加入
水,加热溶解后加入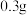 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
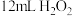 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
您最近一年使用:0次
名校
解题方法
7 . 某小组用如下装置(夹持装置已略去)制备并探究 的性质。
的性质。 的化学方程式是
的化学方程式是___________ 。
(2)a中控制生成 多少的操作是
多少的操作是___________ ;反应后a中若溶液颜色无色,试管底部有灰白色固体,确定产物中有 的操作是
的操作是___________ 。
(3)b用于探究 的性质。
的性质。
①b中为___________ 溶液时,可证明 有漂白性。
有漂白性。
②b中为 和淀粉混合溶液时,溶液蓝色褪去,可证明
和淀粉混合溶液时,溶液蓝色褪去,可证明 有还原性,反应的化学方程式为
有还原性,反应的化学方程式为___________ 。
③b中为 溶液时,反应后在溶液中可检验出
溶液时,反应后在溶液中可检验出 ,说明检验
,说明检验 的方法是
的方法是___________ 。
④b中为 溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子
溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子 的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为
的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为___________ 。随着反应进行,又出现淡黄色沉淀,溶液黄色消失,这是由于溶液中的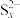 与过量
与过量 又继续反应了,写出反应的离子方程式
又继续反应了,写出反应的离子方程式___________ 。
(资料: 能与S反应生成
能与S反应生成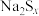 ,
,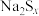 与酸反应生成S和
与酸反应生成S和 )。
)。
(4)c用于吸收 尾气,可选用的试剂是
尾气,可选用的试剂是___________ 。
A.NaOH溶液 B.澄清石灰水 C. 溶液
溶液
 的性质。
的性质。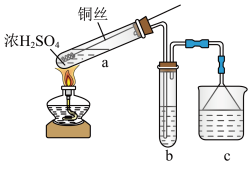
 的化学方程式是
的化学方程式是(2)a中控制生成
 多少的操作是
多少的操作是 的操作是
的操作是(3)b用于探究
 的性质。
的性质。①b中为
 有漂白性。
有漂白性。②b中为
 和淀粉混合溶液时,溶液蓝色褪去,可证明
和淀粉混合溶液时,溶液蓝色褪去,可证明 有还原性,反应的化学方程式为
有还原性,反应的化学方程式为③b中为
 溶液时,反应后在溶液中可检验出
溶液时,反应后在溶液中可检验出 ,说明检验
,说明检验 的方法是
的方法是④b中为
 溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子
溶液时,出现淡黄色沉淀,迅速变为黄色溶液,经查阅资料黄色为多硫离子 的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为
的颜色,出现淡黄色沉淀时氧化产物和还原产物的物质的量之比为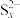 与过量
与过量 又继续反应了,写出反应的离子方程式
又继续反应了,写出反应的离子方程式(资料:
 能与S反应生成
能与S反应生成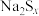 ,
,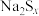 与酸反应生成S和
与酸反应生成S和 )。
)。(4)c用于吸收
 尾气,可选用的试剂是
尾气,可选用的试剂是A.NaOH溶液 B.澄清石灰水 C.
 溶液
溶液
您最近一年使用:0次
名校
8 . 研究 、
、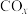 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
(1)采用 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: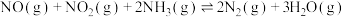 。以下说法正确的是______。
。以下说法正确的是______。
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:__________ 。(填“极性键”、“非极性键”或“极性键和非极性键”)。过程Ⅱ为__________ 过程(填“吸热”或“放热”)。
②已知过程Ⅰ的焓变为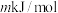 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为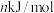 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:__________ 。
(3) 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为:__________ 。其中__________ 是催化剂(填化学符号)。______ (填选项)。(A.化学能转化为电能 B.电能转化为化学能),石墨Ⅰ是该电化学装置的______ (填选项)(A.正极 B.负极)石墨Ⅰ电极上发生的电极反应为__________ (提醒:介质为熔融 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为__________ 。
 、
、 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。(1)采用
 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: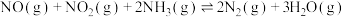 。以下说法正确的是______。
。以下说法正确的是______。A.使用催化剂更有利于提高 的平衡转化率 的平衡转化率 |
| B.及时吹脱水蒸气,可以提高脱氮率 |
| C.其他条件不变的条件下,改变压强对脱氮率没有影响 |
| D.烟气通过催化剂的流速越快,脱氮效果会越好 |
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:

②已知过程Ⅰ的焓变为
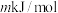 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为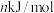 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:(3)
 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为: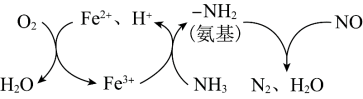
 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为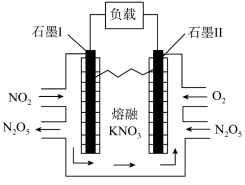
您最近一年使用:0次
名校
解题方法
9 . 亚硝酸钙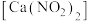 是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):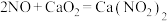 ;
; 。
。
请回答下列问题:
(1)请写出装置A中发生的化学反应方程式___________ 。
(2)装置D中盛装无水氯化钙的仪器名称是___________ ;装置B所加试剂是___________ 。
(3)加入稀硝酸之前,应向装置中通入一段时间的 ,原因是
,原因是___________ 。
(4)将 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为___________ mol。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、 )反应,既能净化尾气,又能获得应用广泛的
)反应,既能净化尾气,又能获得应用广泛的 ,反应原理为
,反应原理为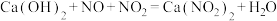 。其部分工艺流程如图所示:
。其部分工艺流程如图所示: 的物质的量之比接近1∶1。
的物质的量之比接近1∶1。
①若 ,则会导致
,则会导致___________ ;
②若 ,则会导致
,则会导致___________ 。
③已知 溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是
溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是___________ 。(结果保留两位小数)
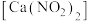 是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
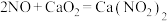 ;
; 。
。请回答下列问题:
(1)请写出装置A中发生的化学反应方程式
(2)装置D中盛装无水氯化钙的仪器名称是
(3)加入稀硝酸之前,应向装置中通入一段时间的
 ,原因是
,原因是(4)将
 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为(5)工业上可用石灰乳和硝酸工业的尾气(含NO、
 )反应,既能净化尾气,又能获得应用广泛的
)反应,既能净化尾气,又能获得应用广泛的 ,反应原理为
,反应原理为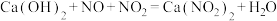 。其部分工艺流程如图所示:
。其部分工艺流程如图所示:
 的物质的量之比接近1∶1。
的物质的量之比接近1∶1。①若
 ,则会导致
,则会导致②若
 ,则会导致
,则会导致③已知
 溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是
溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是
您最近一年使用:0次
2024·河北张家口·三模
名校
解题方法
10 . 氮化钛( )是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用
)是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用 在高温条件制备
在高温条件制备 并测定产率的装置如图所示(夹持装置省略)。
并测定产率的装置如图所示(夹持装置省略)。
(1)仪器a的名称是___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中的试剂是___________ 。
(3)实验尾气为无色气体,写出制备 反应的化学方程式;
反应的化学方程式;___________ 。
(4)D中 的作用是
的作用是___________ 。
(5)反应前称取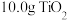 样品,反应后称得瓷舟中固体的质量为
样品,反应后称得瓷舟中固体的质量为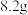 ,则
,则 的产率为
的产率为___________ 。
(6)已知 晶体的晶胞结构如图所示,氮原子位于钛原子围成的
晶体的晶胞结构如图所示,氮原子位于钛原子围成的___________ (填立体构型)的中心,假设钛原子与氮原子相切,则氮原子与钛原子半径的比值为_________ (列出计算式即可)。
 )是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用
)是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用 在高温条件制备
在高温条件制备 并测定产率的装置如图所示(夹持装置省略)。
并测定产率的装置如图所示(夹持装置省略)。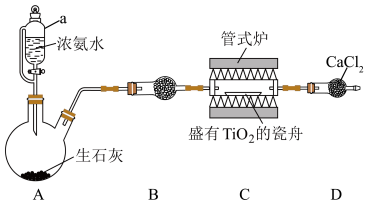
(1)仪器a的名称是
(2)装置B中的试剂是
(3)实验尾气为无色气体,写出制备
 反应的化学方程式;
反应的化学方程式;(4)D中
 的作用是
的作用是(5)反应前称取
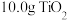 样品,反应后称得瓷舟中固体的质量为
样品,反应后称得瓷舟中固体的质量为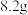 ,则
,则 的产率为
的产率为(6)已知
 晶体的晶胞结构如图所示,氮原子位于钛原子围成的
晶体的晶胞结构如图所示,氮原子位于钛原子围成的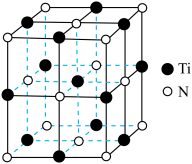
您最近一年使用:0次



