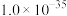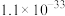名校
解题方法
1 . 铟(In)是制造半导体、电光源等的重要原料。从铜冶炼过程中产生的铟砷烟灰(主要含有 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: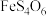 为强电解质;
为强电解质;
② 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为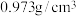 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;
③ 。
。
回答下列问题:
(1)滤渣的主要成分除 外还有
外还有___________ 、___________ (填化学式);“氧化酸浸”过程中, 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:___________ 。
(2)“还原铁”时反应的离子方程式为___________ 。
(3)“萃取除铁”时,用 的
的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是___________ (用平衡移动原理解释);反萃取时萃余液应从分液漏斗的___________ (填“下口放出”或“上口倒出”)。
(4)“萃取”过程中也可用酸(用 表示)作萃取剂,使
表示)作萃取剂,使 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率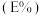 的关系符合公式:
的关系符合公式: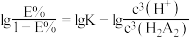 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
___________ (已知 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)整个工艺流程中,可循环利用的物质是___________ 。
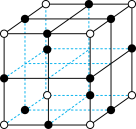
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫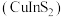 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的___________ (填“四面体空隙”、“六面体空隙”或“八面体空隙”)中。
 、
、 )中提取铟的工艺方法如下:
)中提取铟的工艺方法如下: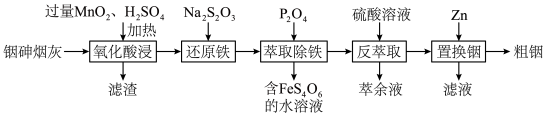
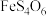 为强电解质;
为强电解质;②
 为磷酸二异辛酯,密度为
为磷酸二异辛酯,密度为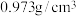 ,其在酸性溶液中可萃取三价金属离子;
,其在酸性溶液中可萃取三价金属离子;③
 。
。回答下列问题:
(1)滤渣的主要成分除
 外还有
外还有 中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:
中的砷元素被氧化为最高价的含氧酸,写出此反应的化学方程式:(2)“还原铁”时反应的离子方程式为
(3)“萃取除铁”时,用
 的
的 作萃取剂时,发现当溶液
作萃取剂时,发现当溶液 后,铟萃取率随
后,铟萃取率随 值的升高而下降,原因是
值的升高而下降,原因是(4)“萃取”过程中也可用酸(用
 表示)作萃取剂,使
表示)作萃取剂,使 进入有机相,发生反应:
进入有机相,发生反应: ,平衡常数为
,平衡常数为 。已知
。已知 与萃取率
与萃取率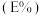 的关系符合公式:
的关系符合公式: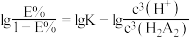 。当
。当 时,萃取率为
时,萃取率为 ,若将萃取率提升到
,若将萃取率提升到 ,应调节溶液的
,应调节溶液的
 ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)整个工艺流程中,可循环利用的物质是
(6)2023年诺贝尔化学奖授予对量子点的发现有突出贡献的科研工作者。铜铟硫
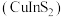 量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系
量子点被广泛应用于光电探测、发光二极管以及光电化学电池领域。立方晶系 的晶胞结构如图所示,晶胞中In和
的晶胞结构如图所示,晶胞中In和 未标明,用
未标明,用 或者
或者 代替。
代替。 位于由
位于由 构成的
构成的
您最近一年使用:0次
名校
解题方法
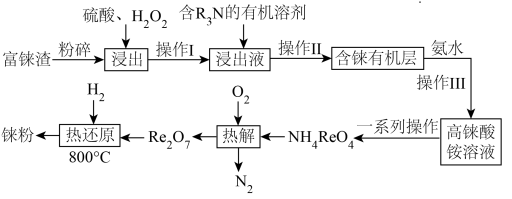
2 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙奥秘离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。元素铼( )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示:
回答下列问题:
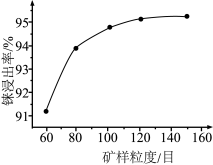
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
(2)已知“浸出”时反应中 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:__________________ 。
(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
(4)“一系列操作”包括①________ (填操作名称,下同)、冷却结晶、过滤、洗涤和②____________ ;从下列仪器中选出①②中需使用的仪器,依次为______ (填字母)。
A. B.
B. C.
C. D.
D.
(5)已知高铼酸铵是白色片状晶体,微溶于冷水,易溶于热水,欲得纯度更高的高铼酸铵晶体,可通过___________ 法提纯;“热还原”反应中氧化剂与还原剂的物质的量之比为___________ 。
(6)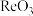 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为___________ ,铼原子填在了氧原子围成的___________ (填“四面体”“立方体”或“八面体”)空隙中。
 )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示:
回答下列问题:
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。

| A.60 | B.80 | C.100 | D.120 |
(2)已知“浸出”时反应中
 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
A.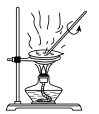 | B.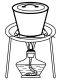 | C.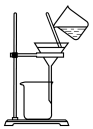 | D.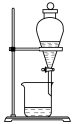 |
(4)“一系列操作”包括①
A.
 B.
B. C.
C. D.
D.
(5)已知高铼酸铵是白色片状晶体,微溶于冷水,易溶于热水,欲得纯度更高的高铼酸铵晶体,可通过
(6)
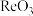 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为
您最近一年使用:0次
名校
解题方法
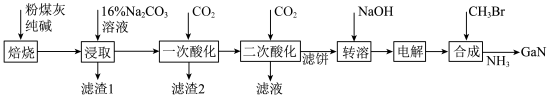
3 . 镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度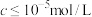 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: 可溶于氨水中,
可溶于氨水中,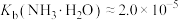 ,反应
,反应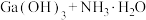
 的平衡常数
的平衡常数 ,计算反应
,计算反应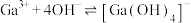 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
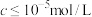 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
 可溶于氨水中,
可溶于氨水中,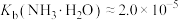 ,反应
,反应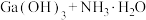
 的平衡常数
的平衡常数 ,计算反应
,计算反应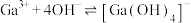 的平衡常数
的平衡常数
您最近一年使用:0次
名校
解题方法
4 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。
回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐,写出这两种酸式盐在水中发生反应的离子方程式___________
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
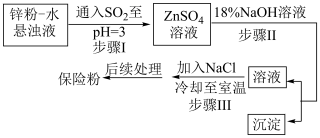
①工业上常将锌块进行预处理得到锌粉一水悬浊液,其目的是___________ 。
②在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是___________ ,“后续处理”最终要加入少量的Na2CO3固体,其原因是___________ 。
③步骤Ⅱ中发生反应的化学方程式为___________ 。
④步骤Ⅲ中加入NaCl固体的作用是___________ 。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___________ 。
回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐,写出这两种酸式盐在水中发生反应的离子方程式
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①工业上常将锌块进行预处理得到锌粉一水悬浊液,其目的是
②在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是
③步骤Ⅱ中发生反应的化学方程式为
④步骤Ⅲ中加入NaCl固体的作用是
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是
您最近一年使用:0次
名校
解题方法
5 . 氧化钴(Co2O3)常用作超耐热合金和磁性材料及化学工业的催化剂。一种以钴矿渣(含有Co、Fe、Ca、Mg、Mn、Ni等元素的化合物及 )制备
)制备 的工艺流程如下。
的工艺流程如下。

已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。
② 、
、 可溶于水。
可溶于水。
回答下列问题:
(1)“浸出”时,为了加快浸出速率,可采取的措施有___________ (任写两点);滤渣1的主要成分为___________ (填化学式)。
(2)“除铁”过程中, 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
(3)“萃取”“反萃取”步骤的目的是___________ ;“煅烧”时主要反应的化学方程式为___________ 。
(4)以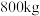 钴矿渣(Co的质量分数为12.5%)为原料提取出
钴矿渣(Co的质量分数为12.5%)为原料提取出 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为___________ (计算结果保留三位有效数字)。
 )制备
)制备 的工艺流程如下。
的工艺流程如下。
已知:①钴矿渣浸出后溶液中金属元素以+2价离子形式存在。
②
 、
、 可溶于水。
可溶于水。回答下列问题:
(1)“浸出”时,为了加快浸出速率,可采取的措施有
(2)“除铁”过程中,
 参与反应的离子方程式为
参与反应的离子方程式为(3)“萃取”“反萃取”步骤的目的是
(4)以
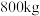 钴矿渣(Co的质量分数为12.5%)为原料提取出
钴矿渣(Co的质量分数为12.5%)为原料提取出 ,在提取过程中钴的损失率为
,在提取过程中钴的损失率为
您最近一年使用:0次
名校
解题方法
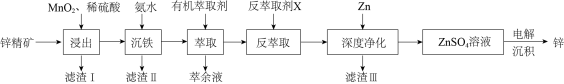
6 . 我国是最早制得和使用金属锌的国家。一种以锌精矿(主要成分是ZnS,还有Fe3O4、CuO、PbO2等杂质)为原料制备锌的工艺流程如下:
回答下列问题:
(1)滤渣I的主要成分除过量MnO2外,还有S和___________ (填化学式)。“浸出”时,MnO2氧化ZnS的离子方程式为___________ 。
(2)“沉铁”时,滴加氨水需要调节pH最低为___________ (残留在溶液中离子浓度≤10-5mol·L-1时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是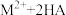 (有机萃取剂)
(有机萃取剂)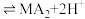 ,有机萃取剂可以分离ZnSO4和MnSO4.写出反萃取剂X的化学式
,有机萃取剂可以分离ZnSO4和MnSO4.写出反萃取剂X的化学式___________ 。
(4)“深度净化”中加Zn的目的是___________ 。
(5)用惰性电极电解ZnSO4溶液,“电解沉积”后的溶液中可循环利用的物质为___________ 。
(6)锌元素位于元素周期表___________ 区,Zn的价层电子排布式为___________ 。
(7)S与 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示: ,阿伏伽德罗常数为NA,则该晶胞的密度为
,阿伏伽德罗常数为NA,则该晶胞的密度为___________  。
。
| 物质 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
| Ksp | 5×10-18 | 5×10-17 | 1×10-38 | 2×10-13 | 2×10-20 |
(1)滤渣I的主要成分除过量MnO2外,还有S和
(2)“沉铁”时,滴加氨水需要调节pH最低为
(3)“萃取,反萃取”时发生的反应是
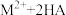 (有机萃取剂)
(有机萃取剂)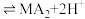 ,有机萃取剂可以分离ZnSO4和MnSO4.写出反萃取剂X的化学式
,有机萃取剂可以分离ZnSO4和MnSO4.写出反萃取剂X的化学式(4)“深度净化”中加Zn的目的是
(5)用惰性电极电解ZnSO4溶液,“电解沉积”后的溶液中可循环利用的物质为
(6)锌元素位于元素周期表
(7)S与
 形成的某化合物晶体的晶胞(实心点表示
形成的某化合物晶体的晶胞(实心点表示 ,空心点表示S)如图所示:
,空心点表示S)如图所示: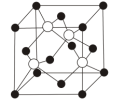
 ,阿伏伽德罗常数为NA,则该晶胞的密度为
,阿伏伽德罗常数为NA,则该晶胞的密度为 。
。
您最近一年使用:0次
名校
解题方法
7 . 汽车尾气中含有CO、 等有害气体。
等有害气体。
(1) 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:___________ 。
(2)汽车尾气中NO生成过程的能量变化示意图如图甲所示:

甲
该条件下, 和
和 完全反应生成2 mol NO时需要
完全反应生成2 mol NO时需要___________ (吸收或释放)___________ kJ的能量。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图乙所示:

①NiO电极上发生的是___________ 反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从___________ 电极流出(填NiO或Pt);Pt电极上的电极反应式为___________ 。
 等有害气体。
等有害气体。(1)
 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:(2)汽车尾气中NO生成过程的能量变化示意图如图甲所示:

甲
该条件下,
 和
和 完全反应生成2 mol NO时需要
完全反应生成2 mol NO时需要(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图乙所示:

①NiO电极上发生的是
②外电路中,电子的流动方向是从
您最近一年使用:0次
名校
解题方法
8 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
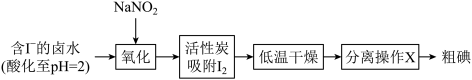
已知:pH=2时,Ⅰ.NaNO2溶液只能将I-氧化为I2,同时生成NO
Ⅱ.2 +I2+4H+=2
+I2+4H+=2 +2Mn2++2H2O
+2Mn2++2H2O
①氧化过程的离子方程式为___________ 。
②根据I2的特性,分离操作X为___________ ,冷凝得到粗碘。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是___________ 。
④活性炭上吸附的I2还能用浓Na2CO3溶液吸收,每吸收3molI2转移5mol电子,同时有气体放出,该反应的离子方程式是___________ 。
(2)以金红石(主要成分为 )为原料,制取Ti的工艺流程如图所示:
)为原料,制取Ti的工艺流程如图所示:

①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为___________ 。
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。

③Ⅱ中氩气的作用是___________ 。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:pH=2时,Ⅰ.NaNO2溶液只能将I-氧化为I2,同时生成NO
Ⅱ.2
 +I2+4H+=2
+I2+4H+=2 +2Mn2++2H2O
+2Mn2++2H2O①氧化过程的离子方程式为
②根据I2的特性,分离操作X为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
④活性炭上吸附的I2还能用浓Na2CO3溶液吸收,每吸收3molI2转移5mol电子,同时有气体放出,该反应的离子方程式是
(2)以金红石(主要成分为
 )为原料,制取Ti的工艺流程如图所示:
)为原料,制取Ti的工艺流程如图所示:
①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③Ⅱ中氩气的作用是
您最近一年使用:0次
9 . 取一定量的硫酸酸化的硫酸锰(MnSO4)溶液,向其中依次加入下列物质,对应现象如表所示:
已知:①金属铋(Bi)价态为+3时较稳定,Bi3+无色;
②铋酸钠(NaBiO3)无色,难溶于水;
③淀粉溶液遇到I2变成蓝色。
(1)NaBiO3中Bi的化合价为____ ,步骤1的氧化产物为____ ,参加反应的氧化剂和还原剂的个数比为____ 。
(2)请配平步骤2发生反应的化学方程式____ 。
 KMnO4+
KMnO4+ H2O2+
H2O2+ H2SO4→
H2SO4→ K2SO4+
K2SO4+ MnSO4+
MnSO4+ O2↑+
O2↑+ ____。
____。
(3)步骤2中过量的H2O2可以氧化KI,则步骤3对应的现象A为____ 。
(4)由上述现象可得NaBiO3、H2O2、MnO 、I2的氧化性由强到弱的顺序为
、I2的氧化性由强到弱的顺序为____ 。根据上述结论,请写出NaBiO3与KI溶液在酸性条件下反应的离子方程式_____ 。
| 步骤1 | 步骤2 | 步骤3 | |
| 试剂 | 适量NaBiO3 | 过量的H2O2溶液 | 适量KI-淀粉混合液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 现象A |
②铋酸钠(NaBiO3)无色,难溶于水;
③淀粉溶液遇到I2变成蓝色。
(1)NaBiO3中Bi的化合价为
(2)请配平步骤2发生反应的化学方程式
 KMnO4+
KMnO4+ H2O2+
H2O2+ H2SO4→
H2SO4→ K2SO4+
K2SO4+ MnSO4+
MnSO4+ O2↑+
O2↑+ ____。
____。(3)步骤2中过量的H2O2可以氧化KI,则步骤3对应的现象A为
(4)由上述现象可得NaBiO3、H2O2、MnO
 、I2的氧化性由强到弱的顺序为
、I2的氧化性由强到弱的顺序为
您最近一年使用:0次
2022-10-15更新
|
306次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2022-2023学年高一上学期10月月考化学试题
解题方法
10 . 化学科学可以帮助我们安全、合理、有效地开发自然资源和使用各种化学品,为建设美丽家园发挥重要价值。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:
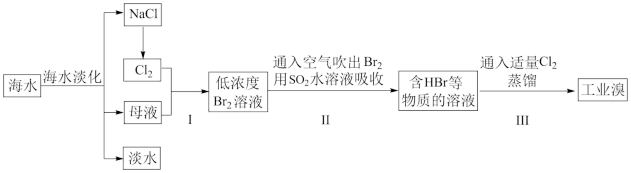
请回答下列问题:
(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是_______ 。法。
(2)从海水中可以得到食盐,为了除去粗盐中的Ca2+、Mg2+、SO ,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是_______。(填字母)。
,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是_______。(填字母)。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_______ 。
(4)步骤Ⅱ用SO2和水吸收Br2,反应的离子方程式为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。
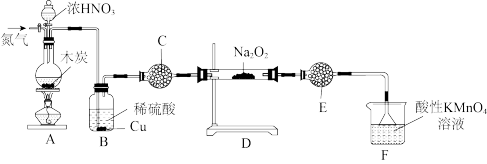
已知:①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性条件下,NO、NO2和NO 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+
请回答下列问题:
(5)装置A中发生反应的化学方程式为_______ 。
(6)装置C的作用为_______ ,装置E的作用为_______ 。
(7)装置F中发生反应的离子方程式为_______ 。
(8)为测定亚硝酸钠的含量,进行如下操作:称取3.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000mol·L-1酸性KMnO4溶液16.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为_______ (保留四位有效数字)。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:

请回答下列问题:
(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是
(2)从海水中可以得到食盐,为了除去粗盐中的Ca2+、Mg2+、SO
 ,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是_______。(填字母)。
,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是_______。(填字母)。| A.⑤④②③① | B.④①②⑤③ | C.②⑤④①③ | D.②④⑤①③ |
(4)步骤Ⅱ用SO2和水吸收Br2,反应的离子方程式为
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。

已知:①2NO+Na2O2=2NaNO2
②2NO2+Na2O2=2NaNO3
③酸性条件下,NO、NO2和NO
 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+请回答下列问题:
(5)装置A中发生反应的化学方程式为
(6)装置C的作用为
(7)装置F中发生反应的离子方程式为
(8)为测定亚硝酸钠的含量,进行如下操作:称取3.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000mol·L-1酸性KMnO4溶液16.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为
您最近一年使用:0次