解题方法
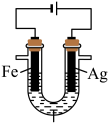
1 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制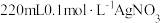 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: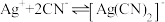 ,
,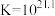 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是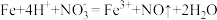 和
和___________ (用离子方程式表示,已知氧化性: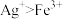 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中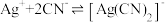 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为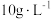 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由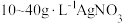 溶液和
溶液和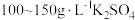 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: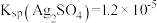 。
。
I.实验准备。
(1)用
 固体配制
固体配制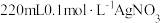 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B.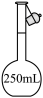 C.
C. D.
D.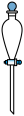 E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
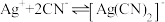 ,
,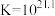 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的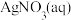 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
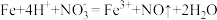 和
和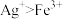 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
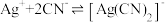 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(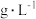 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为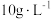 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
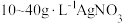 溶液和
溶液和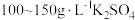 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
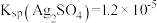 。
。
您最近一年使用:0次
2024-04-16更新
|
284次组卷
|
5卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
2 . 工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示: 其余为
其余为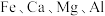 等元素。
等元素。
②部分阳离子沉淀时溶液的 :
:
③“焙烧”过程中主要反应为 。
。
(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、 分别为
分别为___________ 、___________ 、___________ 。 ,作用是
,作用是___________ ,再调节溶液 的范围为
的范围为___________ ,将 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将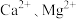 变为氟化物沉淀除去。
变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为___________ 。
(4)上述流程中可循环使用的物质是___________ (填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应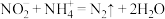 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用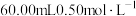 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为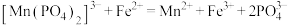 ;用
;用 酸性
酸性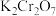 溶液恰好除去过量的
溶液恰好除去过量的 。
。
①酸性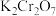 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②试样中锰的质量分数为___________ 。
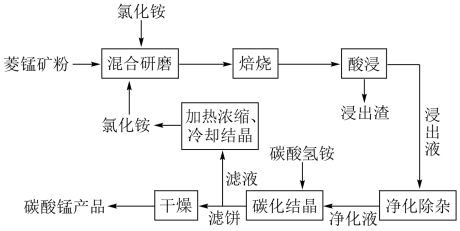
 其余为
其余为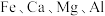 等元素。
等元素。②部分阳离子沉淀时溶液的
 :
:| 离子 |  |  |  |  |  |
开始沉淀的 | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
 。
。(1)结合图1、2、3,分析“焙烧”过程中最佳的焙烧温度、焙烧时间、
 分别为
分别为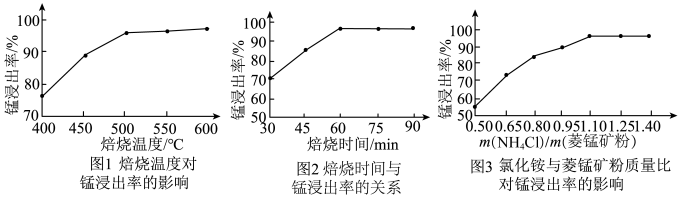
 ,作用是
,作用是 的范围为
的范围为 和
和 变为沉淀而除去,然后加入
变为沉淀而除去,然后加入 将
将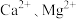 变为氟化物沉淀除去。
变为氟化物沉淀除去。(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为
(4)上述流程中可循环使用的物质是
(5)现用滴定法测定产品中锰的含量。实验步骤:称取
 试样,向其中加入稍过量的磷酸和硝酸,加热使产品中
试样,向其中加入稍过量的磷酸和硝酸,加热使产品中 完全转化为
完全转化为 (其中
(其中 转化为
转化为 );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应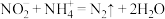 以除去
以除去 ;加入稀硫酸酸化,用
;加入稀硫酸酸化,用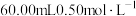 硫酸亚铁铵标准溶液进行滴定,发生的反应为
硫酸亚铁铵标准溶液进行滴定,发生的反应为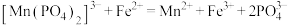 ;用
;用 酸性
酸性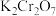 溶液恰好除去过量的
溶液恰好除去过量的 。
。①酸性
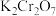 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②试样中锰的质量分数为
您最近一年使用:0次
2024-04-15更新
|
83次组卷
|
2卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
解题方法
3 . 在室温下,Ti不与O2、H2O、强碱、强酸反应,在高温下可与O2反应。Hunter法是最早研究用来制取金属钛的方法,其流程如下图所示。回答下列问题:
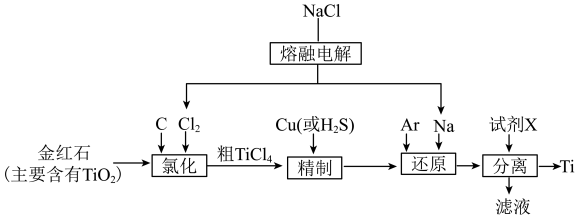
(1)“氯化”是在1000~1050℃下进行,碳被氧化为CO,该反应的化学方程式为___________ 。
(2)“精制”时,粗 中含有大量杂质,可用精馏的方法提纯,对于沸点相近的
中含有大量杂质,可用精馏的方法提纯,对于沸点相近的 杂质可用铜(或
杂质可用铜(或 )将其转化为
)将其转化为 沉淀,反应机理为
沉淀,反应机理为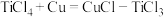 ,
,
 。从总反应看,
。从总反应看, 是该反应的
是该反应的___________ ; 可与
可与 直接反应生成
直接反应生成 ,写出
,写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
(3)“钠还原”是用液态钠还原气态 得到Ti,Ar的作用是
得到Ti,Ar的作用是___________ ;若发生 、
、 等副反应,其原因可能是
等副反应,其原因可能是___________ 。
(4)“分离”时,固体混合物需经取出、破碎、酸浸、过滤、洗涤及干燥等步骤,试剂X为___________ (填名称),滤液循环使用的方法是___________ 。

(1)“氯化”是在1000~1050℃下进行,碳被氧化为CO,该反应的化学方程式为
(2)“精制”时,粗
 中含有大量杂质,可用精馏的方法提纯,对于沸点相近的
中含有大量杂质,可用精馏的方法提纯,对于沸点相近的 杂质可用铜(或
杂质可用铜(或 )将其转化为
)将其转化为 沉淀,反应机理为
沉淀,反应机理为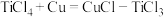 ,
,
 。从总反应看,
。从总反应看, 是该反应的
是该反应的 可与
可与 直接反应生成
直接反应生成 ,写出
,写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:(3)“钠还原”是用液态钠还原气态
 得到Ti,Ar的作用是
得到Ti,Ar的作用是 、
、 等副反应,其原因可能是
等副反应,其原因可能是(4)“分离”时,固体混合物需经取出、破碎、酸浸、过滤、洗涤及干燥等步骤,试剂X为
您最近一年使用:0次
名校
解题方法
4 . 从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程如下:

回答下列问题:
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生如下反应: 。赤泥的主要成分为
。赤泥的主要成分为_______ (填化学式,下同)。
(2)“酸化”时通入过量 与
与 反应生成
反应生成 ,滤液的主要成分为
,滤液的主要成分为_______ 。
(3)“灼烧”时发生反应的化学方程式为_______ 。
(4)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______ 。
(5)取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知: )
)
该样品中AlN的质量分数为_______ ,所用NaOH溶液的浓度为_______ 。

回答下列问题:
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生如下反应:
 。赤泥的主要成分为
。赤泥的主要成分为(2)“酸化”时通入过量
 与
与 反应生成
反应生成 ,滤液的主要成分为
,滤液的主要成分为(3)“灼烧”时发生反应的化学方程式为
(4)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为
(5)取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:
 )
)| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积(标准状况下)/L | 1.456 | 2.912 | 4.256 |
该样品中AlN的质量分数为
您最近一年使用:0次
2021-11-18更新
|
215次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2021-2022学年高三上学期期中考试化学试题
名校
解题方法
5 . 肼(N2H4)的熔点2.0℃、沸点113.5℃,极易溶于水,在碱性介质中具有还原性。在强碱性介质中,用次氯酸钠氧化尿素[CO(NH2)2]可得粗肼,再经蒸馏得到肼溶液。回答下列问题:
I.制备NaClO强碱性溶液
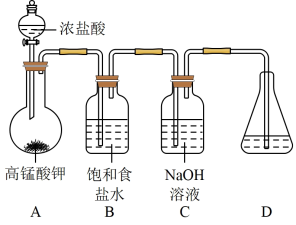
(1)在加入实验药品之前必须进行的操作是_______ 。
(2)A为氯气发生装置,A中反应的化学方程式是_______ 。
(3)次氯酸钠高于35℃容易分解。制备NaClO 强碱性溶液时需要注意的两个关键问题是_______ 。
II.制备N2H4

(4)仪器F的名称是_______ 。
(5)通入N2目的是_______ 。
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为_______ .。
(7)向三颈烧瓶中加入NaClO强碱性溶液应当_______ . (填“一次大量”或“分批少量”)加入,充分反应后制得粗肼。蒸馏提纯时应调节控温槽的温度略高于_______ ℃,得到肼溶液。
I.制备NaClO强碱性溶液

(1)在加入实验药品之前必须进行的操作是
(2)A为氯气发生装置,A中反应的化学方程式是
(3)次氯酸钠高于35℃容易分解。制备NaClO 强碱性溶液时需要注意的两个关键问题是
II.制备N2H4

(4)仪器F的名称是
(5)通入N2目的是
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为
(7)向三颈烧瓶中加入NaClO强碱性溶液应当
您最近一年使用:0次
2021-03-05更新
|
585次组卷
|
3卷引用:青海省西宁市2021届高三复习检测一(一模)理科综合化学试题
名校
6 . 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________ ;装置D中反应生成NaClO2的化学方程式为________________________ ;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________ ;检验该离子的方法是________________________ ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________ ;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________ ;
实验Ⅱ:样品杂质分析与纯度测定
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________ (填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________ 。
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。

(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
实验Ⅱ:样品杂质分析与纯度测定
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为
您最近一年使用:0次
7 . 治理氮氧化物(NOx)的污染是化学研究的重要课题之一。NO能被灼烧的铁粉还原为N2,同时生成同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→__________ (按气流方向,用小写字母表示)。
(2)装置D的作用是___________________ 。
(3)装置E中反应的化学方程式为___________________ 。
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有_____________________ 。
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
(6)最终得到的亚硝酸钠(NaNO2)外观与食盐非常相似,毒性较强。
已知①Ksp(AgNO2) =2.0×10-8,Ksp(AgCl) =1.8×10-10;
② Ka(HNO2) =5.1×10-4。
若鉴别NaNO2和NaCl两种固体,实验方法是__________________________ (试剂自选)。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→
(2)装置D的作用是
(3)装置E中反应的化学方程式为
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
实验步骤 | 实验操作 | 现象 | 实验结论 |
1 | NaNO2具有氧化性 | ||
2 | NaNO2具有还原性 |
已知①Ksp(AgNO2) =2.0×10-8,Ksp(AgCl) =1.8×10-10;
② Ka(HNO2) =5.1×10-4。
若鉴别NaNO2和NaCl两种固体,实验方法是
您最近一年使用:0次
名校
解题方法
8 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
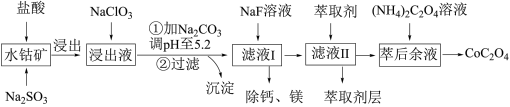
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
2016-12-09更新
|
199次组卷
|
5卷引用:青海省西宁市第四高级中学、第五中学、第十四中学三校2017届高三4月联考化学试题