亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________ ;装置D中反应生成NaClO2的化学方程式为________________________ ;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________ ;检验该离子的方法是________________________ ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________ ;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________ ;
实验Ⅱ:样品杂质分析与纯度测定
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________ (填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________ (选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________ 。
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。

(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
实验Ⅱ:样品杂质分析与纯度测定
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为
更新时间:2018-12-29 08:27:56
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
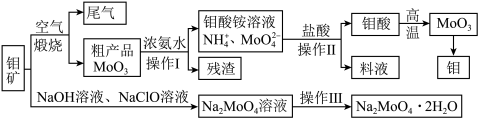
【推荐1】过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
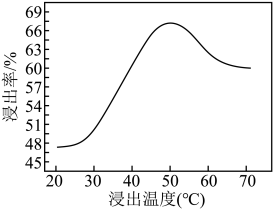
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式_______ 。
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。
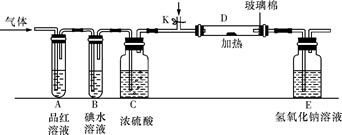
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)_______ ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为_______ ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为_______ ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为_______ 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_______ ,可以看到白色沉淀生成。
(4)若由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y∶X=4∶3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式 _______
(1)写出实验室制取W2反应的离子方程式
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
| A.氨水 | B.稀盐酸 |
| C.稀硝酸 | D.氯化钙 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:_________ 。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________ (写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为________ ,H2O2的电子式为________ 。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②______ ;③用38℃~60℃热水洗涤; ④低于60℃干燥,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_______ g·L−1(杂质不参与反应,NaClO2中的氯元素被还原为Cl−)。

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为
(3)ClO2吸收塔中发生反应的离子方程式为
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】碱式氯化铜[其化学组成可表示为 ]是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
]是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
I.模拟制备碱式氯化铜。向 溶液中通入
溶液中通入 和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,一段时间后生成碱式氯化铜,实验装置如图所示(部分夹持装置已省略)。
和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,一段时间后生成碱式氯化铜,实验装置如图所示(部分夹持装置已省略)。
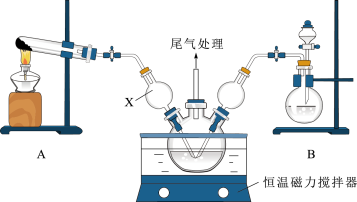
(1)仪器X的名称是___________ ,其主要作用有导气、___________ 。
(2)若B装置烧瓶中液体为浓硫酸,则分液漏斗中所装液体为___________ 。
II.无水碱式氯化铜组成的测定:称取产品10.725g,加硝酸溶解,并加水定容至500mL,得到待测液。
(3)铜的测定:取50.00mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,用分析天平称量得到的蓝色固体质量为0.98g,则称取的样品中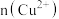 为
为___________ mol。
(4)采用沉淀滴定法测定氯:
准确量取20.00mL待测液于锥形瓶中,加入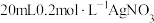 溶液,充分反应后,加入少量聚乙烯醇溶液,用
溶液,充分反应后,加入少量聚乙烯醇溶液,用 标准溶液滴定过量的
标准溶液滴定过量的 。(已知:AgSCN是一种难溶于水的白色固体),重复实验操作三次,消耗的
。(已知:AgSCN是一种难溶于水的白色固体),重复实验操作三次,消耗的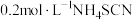 溶液的体积平均为10.00mL。
溶液的体积平均为10.00mL。
①滴定时,应选用的指示剂为___________ 。
②根据上述实验结果可推知无水碱式氯化铜的化学式为___________ 。
③滴定终点时如果仰视读数,则可造成碱式氯化铜组成中x/y的比值___________ (偏大、偏小、或不变)。
 ]是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
]是重要的无机杀菌剂,是一种绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。I.模拟制备碱式氯化铜。向
 溶液中通入
溶液中通入 和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,一段时间后生成碱式氯化铜,实验装置如图所示(部分夹持装置已省略)。
和HCl,调节pH至5.0~5.5,控制反应温度于70~80℃,一段时间后生成碱式氯化铜,实验装置如图所示(部分夹持装置已省略)。
(1)仪器X的名称是
(2)若B装置烧瓶中液体为浓硫酸,则分液漏斗中所装液体为
II.无水碱式氯化铜组成的测定:称取产品10.725g,加硝酸溶解,并加水定容至500mL,得到待测液。
(3)铜的测定:取50.00mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,用分析天平称量得到的蓝色固体质量为0.98g,则称取的样品中
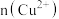 为
为(4)采用沉淀滴定法测定氯:
准确量取20.00mL待测液于锥形瓶中,加入
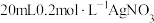 溶液,充分反应后,加入少量聚乙烯醇溶液,用
溶液,充分反应后,加入少量聚乙烯醇溶液,用 标准溶液滴定过量的
标准溶液滴定过量的 。(已知:AgSCN是一种难溶于水的白色固体),重复实验操作三次,消耗的
。(已知:AgSCN是一种难溶于水的白色固体),重复实验操作三次,消耗的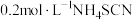 溶液的体积平均为10.00mL。
溶液的体积平均为10.00mL。①滴定时,应选用的指示剂为
②根据上述实验结果可推知无水碱式氯化铜的化学式为
③滴定终点时如果仰视读数,则可造成碱式氯化铜组成中x/y的比值
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】草酸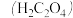 溶液与酸性
溶液与酸性 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】 溶液氧化
溶液氧化 的反应历程为:
的反应历程为:
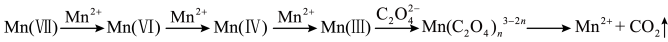
【提出假设】假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______ 。
【设计、完成实验】
 称取
称取______ g草酸晶体 ,配置500mL
,配置500mL
 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______ 。
②下列操作会使所配溶液浓度偏低的是______  填下列选项的字母序号
填下列选项的字母序号 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
 完成探究,记录数据
完成探究,记录数据
则
______ ,假设______ 成立。
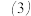 由于
由于 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取

 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL 稀硫酸,用
稀硫酸,用 中
中 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗 溶液
溶液 ,则草酸溶液与酸性
,则草酸溶液与酸性 溶液反应的离子方程式为:
溶液反应的离子方程式为:______ ,上述实验中 溶液的物质的量浓度为
溶液的物质的量浓度为______ 。
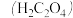 溶液与酸性
溶液与酸性 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:【查阅资料】
 溶液氧化
溶液氧化 的反应历程为:
的反应历程为: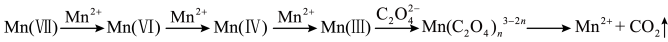
【提出假设】假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是
【设计、完成实验】
 称取
称取 ,配置500mL
,配置500mL
 溶液。
溶液。①在上述过程中必须用到的2种定量仪器是托盘天平和
②下列操作会使所配溶液浓度偏低的是
 填下列选项的字母序号
填下列选项的字母序号 。
。A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
 完成探究,记录数据
完成探究,记录数据| 实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间  | |||
  溶液 溶液 | 等浓度 溶液 溶液 |  |  稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量 固体 固体 |  |
| 4 | 30 | 20 | x | 20 | 加入5mL  溶液 溶液 | 18 |

 由于
由于 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取

 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL 稀硫酸,用
稀硫酸,用 中
中 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗 溶液
溶液 ,则草酸溶液与酸性
,则草酸溶液与酸性 溶液反应的离子方程式为:
溶液反应的离子方程式为: 溶液的物质的量浓度为
溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】三氯氧钒( )是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、
)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、 和碳粉为原料制备三氯氧钒。
和碳粉为原料制备三氯氧钒。 ;熔点为-77℃,沸点为126℃;
;熔点为-77℃,沸点为126℃;
②三氯氧钒遇水会迅速水解生成HCl和一种氧化物。
回答下列问题:
(1)仪器X的名称为___________ ,仪器Y为球形冷凝管,冷却水应从___________ 口(填“M”或“N”)进入。仪器X可以换为如图装置,其优点是___________ 。 ,正确的连接顺序为
,正确的连接顺序为___________ →d→e→h(按气流方向,用小写字母表示,装置可重复使用)。
(3)装置C的作用是为了防止___________ 反应发生(写化学方程式)。
(4)管式炉中发生反应生成CO的化学方程式为___________ 。
(5)已知: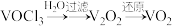 ,
, 的立方晶胞结构如图所示,晶胞参数为a pm。
的立方晶胞结构如图所示,晶胞参数为a pm。___________ 。
②晶体的密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(6)取装置B烧瓶中的液体少许,先溶于水再过滤,在滤渣中加入稀硫酸溶解后,向其中加入0.2000
 溶液25mL,再用0.1000
溶液25mL,再用0.1000
 溶液滴定过量的草酸溶液至终点,消耗
溶液滴定过量的草酸溶液至终点,消耗 溶液的体积为4mL,则所取液体中
溶液的体积为4mL,则所取液体中 的质量为
的质量为___________ g(保留1位小数)。已知: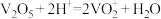 ,
,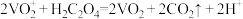 。
。
 )是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、
)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。某兴趣小组利用如图所示装置以氯气、 和碳粉为原料制备三氯氧钒。
和碳粉为原料制备三氯氧钒。
 ;熔点为-77℃,沸点为126℃;
;熔点为-77℃,沸点为126℃;②三氯氧钒遇水会迅速水解生成HCl和一种氧化物。
回答下列问题:
(1)仪器X的名称为

 ,正确的连接顺序为
,正确的连接顺序为(3)装置C的作用是为了防止
(4)管式炉中发生反应生成CO的化学方程式为
(5)已知:
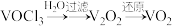 ,
, 的立方晶胞结构如图所示,晶胞参数为a pm。
的立方晶胞结构如图所示,晶胞参数为a pm。
②晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。(6)取装置B烧瓶中的液体少许,先溶于水再过滤,在滤渣中加入稀硫酸溶解后,向其中加入0.2000

 溶液25mL,再用0.1000
溶液25mL,再用0.1000
 溶液滴定过量的草酸溶液至终点,消耗
溶液滴定过量的草酸溶液至终点,消耗 溶液的体积为4mL,则所取液体中
溶液的体积为4mL,则所取液体中 的质量为
的质量为 ,
,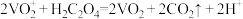 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
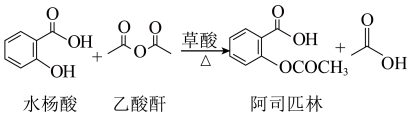
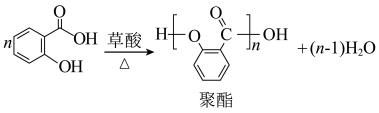
【推荐1】乙酰水杨酸(俗称阿司匹林),是常用的解热镇痛药。实验室选择草酸绿色催化剂制备阿司匹林。
【实验原理】
主反应:
【实验流程】
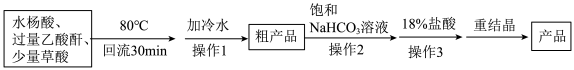
(1)制备过程中采用的合适加热方式是______ 。
(2)“加冷水”后,发生反应的化学方程式为______ 。
(3)“操作2”中加入饱和 溶液的目的是
溶液的目的是______ 。
(4)“操作3”中缓慢加入过量18%的盐酸,充分搅拌直至______ (填现象变化),再冷却结晶。
(5)为检验所获得的产品中是否含有水杨酸,可选用的试剂为______ 。
(6)为提高产品的产率,下列装置可能会用到的有______ 。 ,则该产品的纯度是
,则该产品的纯度是_____________ (以质量分数表示)。
【实验原理】
主反应:
| 名词 | 熔点/℃ | 溶解性 |
| 水杨酸 | 157~159 | 溶于水和乙醇 |
| 乙酸酐 | -73.1 | 易水解 |
| 乙酰水杨酸 | 135 | 微溶冷水,可溶热水,易溶于乙醇 |
(1)制备过程中采用的合适加热方式是
(2)“加冷水”后,发生反应的化学方程式为
(3)“操作2”中加入饱和
 溶液的目的是
溶液的目的是(4)“操作3”中缓慢加入过量18%的盐酸,充分搅拌直至
(5)为检验所获得的产品中是否含有水杨酸,可选用的试剂为
(6)为提高产品的产率,下列装置可能会用到的有
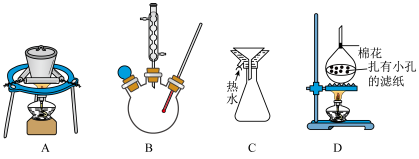
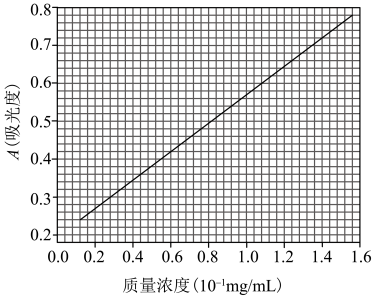
 ,则该产品的纯度是
,则该产品的纯度是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】利用废镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnSO4晶体的实验流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)用NaOH溶液处理废镀锌铁皮除溶解锌外,另一个作用是_______________ 。为缩短用NaOH溶液处理废镀锌铁皮的时间,可采取的措施是_____________ (答两条)。
(2)加入适量H2O2溶液的主要作用是______________ 。溶液B中n(Fe2+):n(Fe3+)=______ 。
(3)在由溶液B制得Fe3O4胶体粒子的过程中,须缓慢滴加稀NaOH溶液并持续通入N2,持续通入N2的原因是_____________________ 。
(4)请补充完整下列由溶液A获得副产品ZnSO4晶体的实验步骤:
①向溶液A中通入CO2气体,得到Zn (OH)2沉淀;
②______________ 、洗涤得到沉淀;
③______________ ;
④将溶液加热浓缩、冷却结晶、过滤、洗涤、干燥即可得到产品。

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)用NaOH溶液处理废镀锌铁皮除溶解锌外,另一个作用是
(2)加入适量H2O2溶液的主要作用是
(3)在由溶液B制得Fe3O4胶体粒子的过程中,须缓慢滴加稀NaOH溶液并持续通入N2,持续通入N2的原因是
(4)请补充完整下列由溶液A获得副产品ZnSO4晶体的实验步骤:
①向溶液A中通入CO2气体,得到Zn (OH)2沉淀;
②
③
④将溶液加热浓缩、冷却结晶、过滤、洗涤、干燥即可得到产品。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】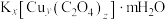 是一种重要的化工原料,其制备及各微粒的测定原理如下:
是一种重要的化工原料,其制备及各微粒的测定原理如下:
 .实验方法:称取
.实验方法:称取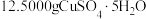 和
和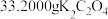 分别溶于水中,在85~90℃下混合浓缩,然后冷却到10℃,并将所得的沉淀减压过滤,迅速加以洗涤,烘干,晶体产率为60%。
分别溶于水中,在85~90℃下混合浓缩,然后冷却到10℃,并将所得的沉淀减压过滤,迅速加以洗涤,烘干,晶体产率为60%。
 .重量法测定配合物中结晶水含量
.重量法测定配合物中结晶水含量
将 配合物称重18.9000g于150℃下恒温2h,取出称量,反复几次,恒温称重,直到重量不再变化,称得重量为16.7400g。
配合物称重18.9000g于150℃下恒温2h,取出称量,反复几次,恒温称重,直到重量不再变化,称得重量为16.7400g。
 .配合物中
.配合物中 及
及 含量
含量
将 中的剩余固体先用1mol/L的
中的剩余固体先用1mol/L的 将其溶解配成250ml溶液,取25ml用酸性
将其溶解配成250ml溶液,取25ml用酸性 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,消耗
,消耗 0.0048mol;滴定后的溶液中铜以
0.0048mol;滴定后的溶液中铜以 形式存在,通过控制溶液酸度,用间接碘法测定配合物中铜的含量
形式存在,通过控制溶液酸度,用间接碘法测定配合物中铜的含量
回答下列问题:
(1)该配合物的配体及配位原子分别是___________ 、___________ 。
(2)本实验减压过滤所需的主要仪器有抽气泵、吸滤瓶及___________ 、___________ 。
(3)根据题干信息分析步骤 使用的洗涤剂为
使用的洗涤剂为___________ 。
(4)酸性滴定的离子反应方程式为___________ 。
(5)已知: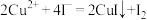 向滴定后的溶液加入足量的KI溶液,用0.6
向滴定后的溶液加入足量的KI溶液,用0.6
 溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为___________ ;若消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。 ,步骤
,步骤 中配合物铜的物质的量
中配合物铜的物质的量___________ mol。
(6)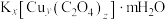 的化学式为:
的化学式为:___________ 。
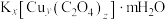 是一种重要的化工原料,其制备及各微粒的测定原理如下:
是一种重要的化工原料,其制备及各微粒的测定原理如下: .实验方法:称取
.实验方法:称取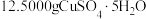 和
和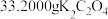 分别溶于水中,在85~90℃下混合浓缩,然后冷却到10℃,并将所得的沉淀减压过滤,迅速加以洗涤,烘干,晶体产率为60%。
分别溶于水中,在85~90℃下混合浓缩,然后冷却到10℃,并将所得的沉淀减压过滤,迅速加以洗涤,烘干,晶体产率为60%。 .重量法测定配合物中结晶水含量
.重量法测定配合物中结晶水含量将
 配合物称重18.9000g于150℃下恒温2h,取出称量,反复几次,恒温称重,直到重量不再变化,称得重量为16.7400g。
配合物称重18.9000g于150℃下恒温2h,取出称量,反复几次,恒温称重,直到重量不再变化,称得重量为16.7400g。 .配合物中
.配合物中 及
及 含量
含量将
 中的剩余固体先用1mol/L的
中的剩余固体先用1mol/L的 将其溶解配成250ml溶液,取25ml用酸性
将其溶解配成250ml溶液,取25ml用酸性 标准溶液滴定溶液中的
标准溶液滴定溶液中的 ,消耗
,消耗 0.0048mol;滴定后的溶液中铜以
0.0048mol;滴定后的溶液中铜以 形式存在,通过控制溶液酸度,用间接碘法测定配合物中铜的含量
形式存在,通过控制溶液酸度,用间接碘法测定配合物中铜的含量回答下列问题:
(1)该配合物的配体及配位原子分别是
(2)本实验减压过滤所需的主要仪器有抽气泵、吸滤瓶及
(3)根据题干信息分析步骤
 使用的洗涤剂为
使用的洗涤剂为(4)酸性滴定的离子反应方程式为
(5)已知:
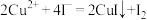 向滴定后的溶液加入足量的KI溶液,用0.6
向滴定后的溶液加入足量的KI溶液,用0.6
 溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为
溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为 溶液的体积为10.00mL。
溶液的体积为10.00mL。 ,步骤
,步骤 中配合物铜的物质的量
中配合物铜的物质的量(6)
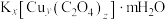 的化学式为:
的化学式为:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】铜是人类最早使用的金属,在生产、生活中应用极其广泛。工业上以黄铜矿(主要成分FeCuS2)为原料制取金属铜,其主要工艺流程如图所示。

已知:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S。
回答下列问题:
(1)FeCuS2中S的化合价为________ 。
(2)反应Ⅰ在隔绝空气、高温煅烧条件下进行,写出反应的化学方程式:____________ 。
(3)为了使反应Ⅰ充分进行,工业上可采取的措施是___________________________ 。
(4)反应Ⅲ的离子方程式为_______________________________________ 。
(5)向反应Ⅲ后的溶液中加入稀硫酸的目的是_______________________________ 。
(6)该流程中,可循环利用的物质除CuCl2外,还有________________ (填化学式)。
(7)反应Ⅳ中,处理尾气SO2方法,合理的是________ 。
A.高空排放
B.用BaCl2溶液吸收制备BaSO3
C.用氨水吸收后,再经氧化,制备(NH4)2SO4

已知:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S。
回答下列问题:
(1)FeCuS2中S的化合价为
(2)反应Ⅰ在隔绝空气、高温煅烧条件下进行,写出反应的化学方程式:
(3)为了使反应Ⅰ充分进行,工业上可采取的措施是
(4)反应Ⅲ的离子方程式为
(5)向反应Ⅲ后的溶液中加入稀硫酸的目的是
(6)该流程中,可循环利用的物质除CuCl2外,还有
(7)反应Ⅳ中,处理尾气SO2方法,合理的是
A.高空排放
B.用BaCl2溶液吸收制备BaSO3
C.用氨水吸收后,再经氧化,制备(NH4)2SO4
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】实验室制备无水二氯化锡的主要步骤如下:
步骤1:在圆底烧瓶中加入1.20 g碎锡箔和5 mL浓盐酸、1滴硝酸,实验装置如图所示。组装好后在95 ℃ 时回流0.5 h,待圆底烧瓶中只剩余少量锡箔为止;

步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体;
步骤3:在二氯化锡晶体中加入10 mL醋酸酐,即可得无水二氯化锡,过滤;
步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡。
回答下列问题:
(1)步骤1中,圆底烧瓶中发生反应的化学方程式为___________________________________ ;
冷却水从接口________ (填“a”或“b”)进入。实验采取的加热方式是______________ ;球形冷凝管上连接装有碱石灰的干燥管的目的是____________________________________ 。
(2)步骤2中,仪器X的名称为__________ ;二氧化碳气氛的作用是__________________ 。
(3)步骤3中,醋酸酐的作用是____________________ ;二氯化锡晶体在进行步骤3操作前应采取的加工措施是________ ,该加工措施需要仪器的名称是________ 。
步骤1:在圆底烧瓶中加入1.20 g碎锡箔和5 mL浓盐酸、1滴硝酸,实验装置如图所示。组装好后在95 ℃ 时回流0.5 h,待圆底烧瓶中只剩余少量锡箔为止;

步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体;
步骤3:在二氯化锡晶体中加入10 mL醋酸酐,即可得无水二氯化锡,过滤;
步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡。
回答下列问题:
(1)步骤1中,圆底烧瓶中发生反应的化学方程式为
冷却水从接口
(2)步骤2中,仪器X的名称为
(3)步骤3中,醋酸酐的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】FeCl2具有独有的脱色能力,适用于印染、造纸行业的污水处理。FeCl3在加热条件下遇水剧烈水解。FeCl3和FeCl2均不溶于C6H5Cl、C6H4Cl2、苯。回答下列问题:
(1)由FeCl3.6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3.6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后再加热,生成FeCl2。
①FeCl3.6H2O中加入SOCl2获得无水FeCl3的化学方程式为__________________ 。(已知该反应为非氧化还原反应)
②使用NH4SCN可以检验 ii中FeCl3是否含完全转化,请写出离子反应方程式_____________ 。
(2)利用反应2FeCl3 + C6H5Cl 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
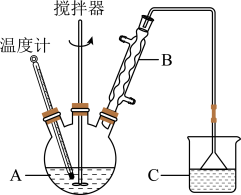
①仪器B的名称是_________ ;C的试剂名称是________ 。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经______ 、_______ 、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是__________________________ 。
(3)粗产品中FeCl2的纯度测定。
①取a g粗产品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水至体积为200mL;③用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。若已知消耗酸性高锰酸钾溶液为VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的单位为g·L-1,则k=___________ g·L-1·mL-1。
(1)由FeCl3.6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3.6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后再加热,生成FeCl2。
①FeCl3.6H2O中加入SOCl2获得无水FeCl3的化学方程式为
②使用NH4SCN可以检验 ii中FeCl3是否含完全转化,请写出离子反应方程式
(2)利用反应2FeCl3 + C6H5Cl
 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
①仪器B的名称是
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经
③该装置存在的不足之处是
(3)粗产品中FeCl2的纯度测定。
①取a g粗产品配制成100 mL溶液;②用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水至体积为200mL;③用0.100 mol·L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。若已知消耗酸性高锰酸钾溶液为VmL,所配溶液的密度ρ(FeCl2)=kV ,密度的单位为g·L-1,则k=
您最近一年使用:0次



