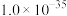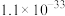镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
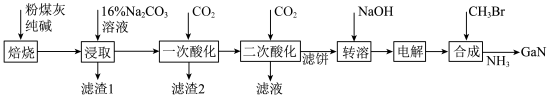
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度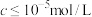 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: 可溶于氨水中,
可溶于氨水中,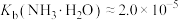 ,反应
,反应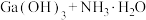
 的平衡常数
的平衡常数 ,计算反应
,计算反应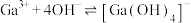 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
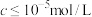 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
 可溶于氨水中,
可溶于氨水中,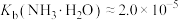 ,反应
,反应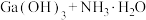
 的平衡常数
的平衡常数 ,计算反应
,计算反应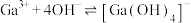 的平衡常数
的平衡常数
更新时间:2024-02-29 20:40:56
|
相似题推荐
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐1】高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: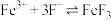
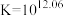

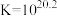
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的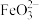 。此过程的反应为
。此过程的反应为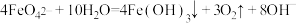 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中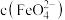 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
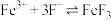
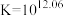

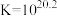
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的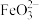 。此过程的反应为
。此过程的反应为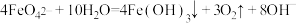 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
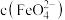 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。
(1)“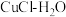 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
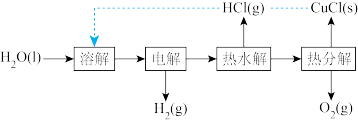
①电解在质子交换膜电解池中进行。阳极区为酸性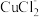 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为_______ (用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有_______ (填元素符号)。
(2)“ 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。
①实验中发现,在 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
②随着反应进行, 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为_______ 。
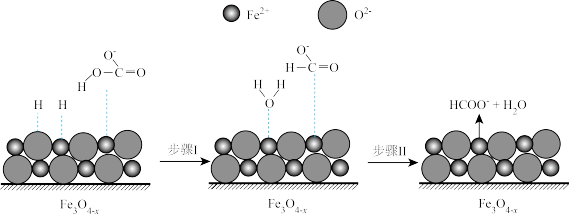
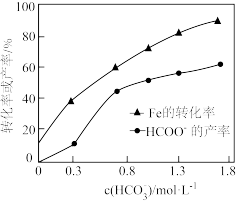
③在其他条件相同时,测得Fe的转化率、 的产率随
的产率随 变化如题图所示。
变化如题图所示。 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是_______ 。
(3)从物质转化与资源综合利用角度分析,“ 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是_______ 。
(1)“
 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
①电解在质子交换膜电解池中进行。阳极区为酸性
 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有
(2)“
 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。①实验中发现,在
 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为②随着反应进行,
 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
③在其他条件相同时,测得Fe的转化率、
 的产率随
的产率随 变化如题图所示。
变化如题图所示。 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是
(3)从物质转化与资源综合利用角度分析,“
 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
【资料1】亚硫酸(H2SO3)易分解生成SO2和H2O。
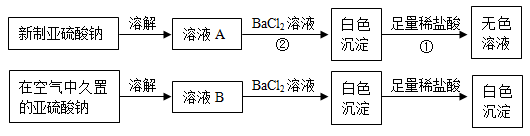
(1)写出上述实验中①、②的离子方程式_________________ ,_________________ 。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________ (填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________ 性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
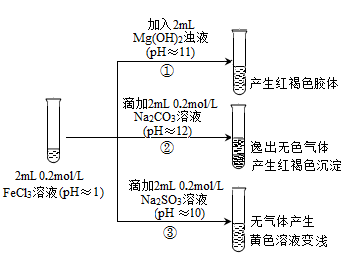
【资料2】含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________ 。
(2)②中逸出的无色气体是_______________________________ 。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________ 。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________ 。
(4)由上述实验可知,下列说法正确的是________ (填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
【资料1】亚硫酸(H2SO3)易分解生成SO2和H2O。

(1)写出上述实验中①、②的离子方程式
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

【资料2】含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是
(2)②中逸出的无色气体是
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
(4)由上述实验可知,下列说法正确的是
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐1】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、A12O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
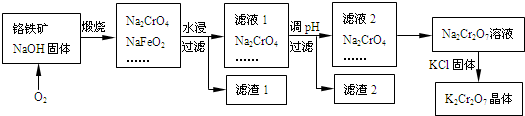
已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O 2CrO42-+2H+。
2CrO42-+2H+。
请回答:
(1)K2Cr2O7中K元素的原子结构示意图为____________ ,化合价是_______________ 。
(2)往铬铁矿里通入氧气的主要目的是__________________ 。滤液1的成分除Na2CrO4外,还含有_____ (填化学式)。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是________________________ 。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是____________________ 。
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、__________ 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是_______________________ 。

已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O
 2CrO42-+2H+。
2CrO42-+2H+。请回答:
(1)K2Cr2O7中K元素的原子结构示意图为
(2)往铬铁矿里通入氧气的主要目的是
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐2】用磷铁渣(含Fe、FeP、Fe2P及少量杂质)制备FePO4·2H2O(磷酸铁)的工艺流程如下:
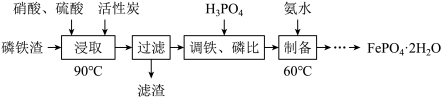
(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为__________ 。
②加入硫酸的目的是__________ ;加入活性炭能降低有害气体的产生,这是因为__________ 。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是__________
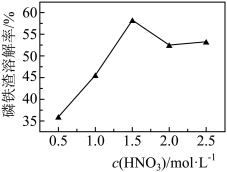 图-1
图-1
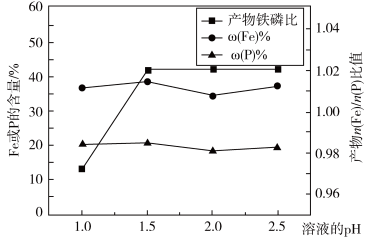 图-2
图-2
(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是___________ ;写出生成FePO4·2H2O的离子方程式:__________________________ 。

(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为
②加入硫酸的目的是
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是
 图-1
图-1 图-2
图-2(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐3】金属钌在电子制造、化学工业及催化剂生产等行业中有关键作用,六氯钌酸铵[ ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
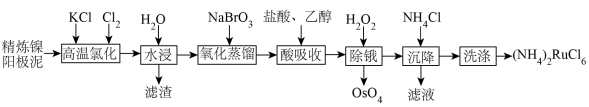
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到 、
、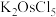 ,
,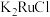 。
。 中Ru元素的化合价为
中Ru元素的化合价为___________ ,生成 的化学方程式为
的化学方程式为___________ 。
(2)“氧化蒸馏”过程中蒸出 、
、 ,生成
,生成 的离子方程式为
的离子方程式为___________ 。
(3)“酸吸收”过程中加入乙醇的作用是___________ 。
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为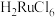 ,溶液中存在
,溶液中存在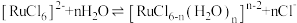
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有___________ 。
(5)检验滤液中主要阴离子的实验方法是___________ ,“洗涤”时最合适的试剂为___________ 。
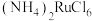 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到
 、
、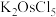 ,
,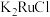 。
。 中Ru元素的化合价为
中Ru元素的化合价为 的化学方程式为
的化学方程式为(2)“氧化蒸馏”过程中蒸出
 、
、 ,生成
,生成 的离子方程式为
的离子方程式为(3)“酸吸收”过程中加入乙醇的作用是
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为
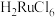 ,溶液中存在
,溶液中存在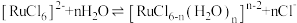
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有(5)检验滤液中主要阴离子的实验方法是
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐1】一种利用炼锌渣(主要含 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示: 。
。
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,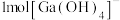 中含有
中含有 键的数目为
键的数目为___________ 。
(2)黄钠铁矾的化学式为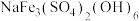 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。
①“沉铁”时生成黄钠铁矾的离子方程式为___________ 。
②不采用调节 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成 而损失;
而损失;___________ (答2点)。
(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量 粉,加入铜粉的目的是
粉,加入铜粉的目的是___________ 。
(4) 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是___________ 。 。已知:室温时,
。已知:室温时,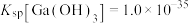 ,
,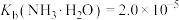 ,
,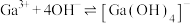
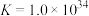 。反应
。反应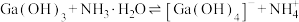 的平衡常数为
的平衡常数为___________ 。
(6)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含___________ 个 ,
,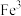 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
 。
。(1)基态
 的价层电子排布式为
的价层电子排布式为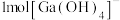 中含有
中含有 键的数目为
键的数目为(2)黄钠铁矾的化学式为
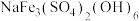 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。①“沉铁”时生成黄钠铁矾的离子方程式为
②不采用调节
 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成 而损失;
而损失;(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量
 粉,加入铜粉的目的是
粉,加入铜粉的目的是(4)
 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是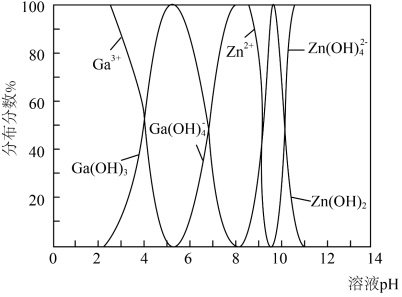
 。已知:室温时,
。已知:室温时,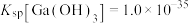 ,
,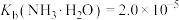 ,
,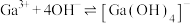
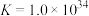 。反应
。反应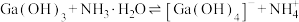 的平衡常数为
的平衡常数为(6)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含 ,
,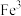 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。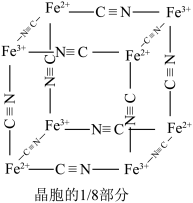
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐2】锆是一种重要的战略金属,在国民经济中的地位举足轻重。中国科学院工程研究所研发了以锆英矿(主要成分为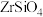 ,含少量
,含少量 、
、 杂质)制氧氯化锆的工艺如下:
杂质)制氧氯化锆的工艺如下: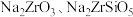 均不溶于水
均不溶于水
(1)在 下碱熔,
下碱熔,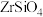 全部转化为
全部转化为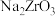 ,该反应的化学方程式为
,该反应的化学方程式为______ 。
(2)“滤液1”中的溶质除含有 外,还含有
外,还含有______ (化学式)。
(3)当碱熔的温度高于 时,
时,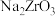 中含有少量的
中含有少量的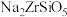 杂质,“转型”的主要目的是将
杂质,“转型”的主要目的是将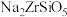 转化
转化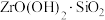 ,则“滤液2”中主要溶质为
,则“滤液2”中主要溶质为______ 。
(4)“酸分解”目的是将锆的化合物转化为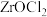 ,温度或盐酸浓度对“酸分解”的影响如下图所示:
,温度或盐酸浓度对“酸分解”的影响如下图所示:______  ,采用盐酸浓度为
,采用盐酸浓度为______  。
。
加入“絮凝剂”的目的是______ 。
(5)“操作1”的主要步骤为______ 、______ 。
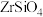 ,含少量
,含少量 、
、 杂质)制氧氯化锆的工艺如下:
杂质)制氧氯化锆的工艺如下:
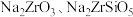 均不溶于水
均不溶于水(1)在
 下碱熔,
下碱熔,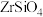 全部转化为
全部转化为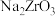 ,该反应的化学方程式为
,该反应的化学方程式为(2)“滤液1”中的溶质除含有
 外,还含有
外,还含有(3)当碱熔的温度高于
 时,
时,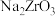 中含有少量的
中含有少量的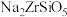 杂质,“转型”的主要目的是将
杂质,“转型”的主要目的是将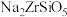 转化
转化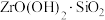 ,则“滤液2”中主要溶质为
,则“滤液2”中主要溶质为(4)“酸分解”目的是将锆的化合物转化为
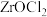 ,温度或盐酸浓度对“酸分解”的影响如下图所示:
,温度或盐酸浓度对“酸分解”的影响如下图所示: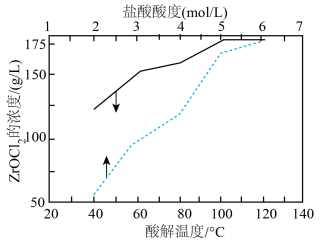
 ,采用盐酸浓度为
,采用盐酸浓度为 。
。加入“絮凝剂”的目的是
(5)“操作1”的主要步骤为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐3】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
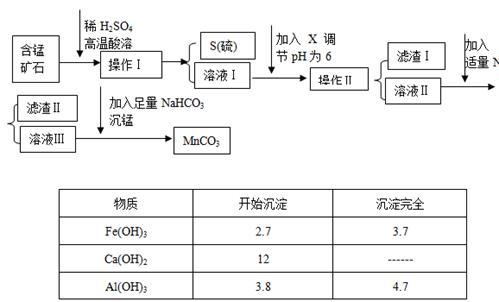
回答下列问题:
(1)操作Ⅰ为:___________ 。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为( )
(4)滤渣Ⅰ为___________ ,滤渣Ⅱ为___________ 。
(5)沉锰的化学方程式为:______________________ 。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________ 。

回答下列问题:
(1)操作Ⅰ为:
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为
| A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为
(5)沉锰的化学方程式为:
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐1】纳米氧化锌可作为一些催化剂的载体,二氧化锰也常作催化剂、氧化剂与去极化剂,用途非常广泛。工业上由软锰矿(主要成分为MnO2)与锌精矿(主要成分为ZnS)酸性共溶法制备MnO2,及纳米ZnO,工艺流程如图:

已知:P5O7(酸性磷酸酯)可作萃取剂分离锌、锰离子,它是一种不溶于水的淡黄色透明油状液体,属于酸性萃取剂。
请回答下列问题:
(1)为了提高酸浸效果,可采取的措施有____ 。(答出一条即可)
(2)写出步骤①酸浸时ZnS与MnO2发生的主要反应的离子方程式:____ 。(无单质硫生成),若软锰矿的比例较低,可能产生的后果是____ 。
(3)实验室完成步骤③所用到的主要玻璃仪器是____ (填写名称)。
(4)完成步骤④中发生反应的离子方程式:____ 。
(5)经⑤所得水相再经过____ 过滤等操作得到ZnSO4•7H2O。
已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:
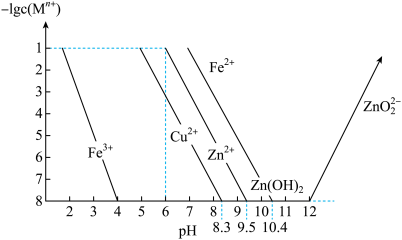
②相关常数:Ksp(ZnS)=2.1×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15,Ka(CH3COOH)=1.8×10-5。
制得ZnSO4•7H2O后最终残留的酸性废液中含有ZnSO4,除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
测:处理后的溶液中c(Zn2+)=____ mol•L-1。
(6)ZnSO4•7H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是____ 。

已知:P5O7(酸性磷酸酯)可作萃取剂分离锌、锰离子,它是一种不溶于水的淡黄色透明油状液体,属于酸性萃取剂。
请回答下列问题:
(1)为了提高酸浸效果,可采取的措施有
(2)写出步骤①酸浸时ZnS与MnO2发生的主要反应的离子方程式:
(3)实验室完成步骤③所用到的主要玻璃仪器是
(4)完成步骤④中发生反应的离子方程式:
(5)经⑤所得水相再经过
已知:①工业条件下,部分金属阳离子Mn+开始沉淀和完全沉淀时的pH值如图:

②相关常数:Ksp(ZnS)=2.1×10-22,Ka1(H2S)=1.0×10-7,Ka2(H2S)=7.0×10-15,Ka(CH3COOH)=1.8×10-5。
制得ZnSO4•7H2O后最终残留的酸性废液中含有ZnSO4,除去酸性废液中Zn2+的方法是:在酸性废液中加入一定量CH3COONa后,再通入H2S生成ZnS沉淀。处理后的溶液中部分微粒浓度为:
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度(mol•L-1) | 0.10 | 0.10 | 0.18 |
(6)ZnSO4•7H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是
| A.滴定前,锥形瓶和滴定管均须用标准溶液润洗 |
| B.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移 |
| C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转 |
| D.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小 |
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐2】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
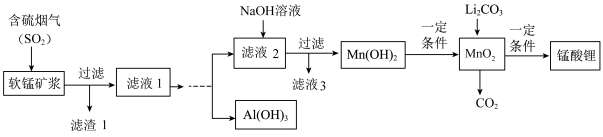
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________ (举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________ (填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________ ;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________ ;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________ 。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________ 。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(2)滤液1中所含金属阳离子有Mn2+、
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
【推荐3】二氧化铈( )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“氧化焙烧”后,Ce元素转化为 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式_______ 。
(2)“酸浸”时,铈的浸出率与温度、 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为_______ (填标号)。不能用盐酸代替硫酸进行酸浸,理由是_______ 。 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程: 不能溶于有机物TBP,
不能溶于有机物TBP,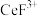 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。
“系列操作”在_______ (填仪器名称)中完成,“有机层B”中发生反应的离子方程式为_______ 。
(4)“调pH”中,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于_______ (已知:25℃时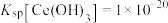 )。
)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为_______ 。
(6) 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为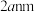 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有_______ 个。
②在尾气消除过程中 与
与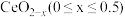 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和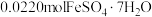 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为_______ ,则此时氧空位率为_______ 。
 )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。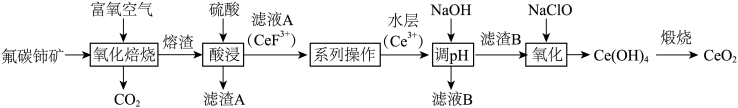
(1)“氧化焙烧”后,Ce元素转化为
 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式(2)“酸浸”时,铈的浸出率与温度、
 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为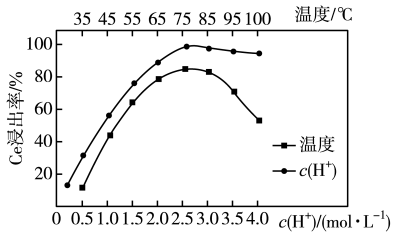
 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程:
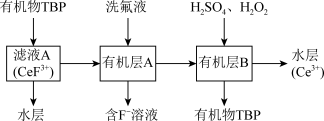
 不能溶于有机物TBP,
不能溶于有机物TBP,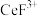 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。“系列操作”在
(4)“调pH”中,要使
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于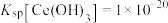 )。
)。(5)“氧化”中,氧化剂与还原剂的物质的量之比为
(6)
 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。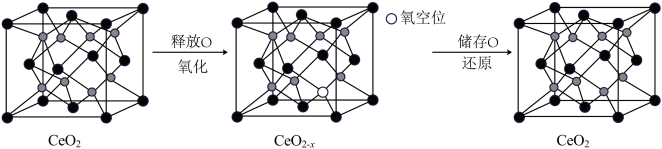
 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为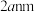 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有②在尾气消除过程中
 与
与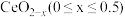 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和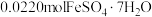 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为
您最近一年使用:0次