名校
解题方法
1 . CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铁矿,飞机上天全靠它。铼(Re)是一种稀散金属,广泛应用于航空航天领域。工业上从高铼废料(含 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示: 。
。
回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为___________ 。该工序中,ReS2发生反应的化学方程式为___________ 。
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。___________ 。
②其他条件相同,混合溶液的pH>1.5时, 的提取率降低的主要原因为
的提取率降低的主要原因为___________ 。
(3)“反萃取”时,选用的试剂X为盐酸的理由为___________ 。
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以 形式存在):
形式存在):___________ 方法提纯高铼酸铵晶体。
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为___________ ;晶体密度为___________ g∙cm-3 (列出含a、b、NA的计算表达式,NA表示阿伏加德罗常数的值)。
 等)中提取铼的一种工艺流程如图所示:
等)中提取铼的一种工艺流程如图所示:
 。
。回答下列问题:
(1)“焙烧”时,高铼废料粉末与富氧空气逆流混合的目的为
(2)其他条件相同时,“离子交换”过程中料液和D296体积比与铼交换率、铼交换量的变化关系如图1所示;混合溶液的pH与
 提取率的变化关系如图2所示。
提取率的变化关系如图2所示。
②其他条件相同,混合溶液的pH>1.5时,
 的提取率降低的主要原因为
的提取率降低的主要原因为(3)“反萃取”时,选用的试剂X为盐酸的理由为
(4)另一种途径从炼铜废液中来提取铼,其简易工艺流程如图,(部分副产物省略,铼在废液中以
 形式存在):
形式存在):
(5)废料中的Ni元素经一系列操作可得到金属镍,金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图所示。该晶体的化学式为

您最近一年使用:0次
名校
解题方法
2 . 含SO2废气的治理可以变废为宝,使硫资源得以利用。
(1)“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:______ ;SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,写出该反应的离子方程式:____________ 。
②Na2SO3粗品中可能因氧气作用含有少量Na2SO4,该过程的化学方程式为____________ ;请设计实验证明粗品中含有少量N2SO4:____________ 。
③已知有标准状况下VL含SO2的烟气,通入足量H2O2溶液吸收,再加足量BaCl2溶液充分反应((废气中其他成分不参与反应),最终得到ag沉淀。该过程的总化学方程式为____________ ;烟气中SO2的体积分数的计算式是_____ ((用含a、V的算式表示,无需化简)。
(2)CO与SO2在催化剂、773K条件下反应生成CO2和硫蒸气,反应体系中各组分的物质的量与反应时间的关系如下图所示,写出该反应的化学方程式____________ 。
(1)“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

②Na2SO3粗品中可能因氧气作用含有少量Na2SO4,该过程的化学方程式为
③已知有标准状况下VL含SO2的烟气,通入足量H2O2溶液吸收,再加足量BaCl2溶液充分反应((废气中其他成分不参与反应),最终得到ag沉淀。该过程的总化学方程式为
(2)CO与SO2在催化剂、773K条件下反应生成CO2和硫蒸气,反应体系中各组分的物质的量与反应时间的关系如下图所示,写出该反应的化学方程式

您最近一年使用:0次
解题方法
3 . 红矾钠(重铬酸钠: )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: 转化为
转化为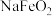 和
和 。
。
②“浸取”时铁元素以 形式存在。
形式存在。
(1)写出“焙烧”时 被氧化的化学方程式:
被氧化的化学方程式:_______ 。
(2)为了加快浸取速率可采取的措施有_______ (请写出两种方法)。
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度 时认为已除尽。
时认为已除尽。_______ ,滤渣的主要成分有_______ 。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)_______ 。
(5)“冷却结晶”所得母液中,除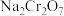 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有_______ (用化学式表示)。
(6)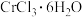 的三种结构:①
的三种结构:①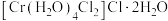 、②
、②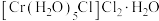 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。
 )是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿(
)是重要的基本化工原料,常在印染、电镀等工业中做辅助剂。工业上以铬铁矿( ,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题:
,含Al、Si氧化物等杂质)为主要原料制备红矾钠的工艺流程如下。回答下列问题: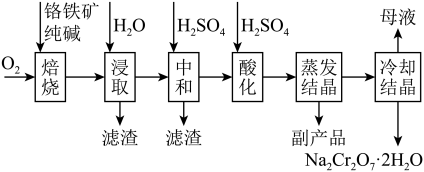
 转化为
转化为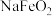 和
和 。
。②“浸取”时铁元素以
 形式存在。
形式存在。(1)写出“焙烧”时
 被氧化的化学方程式:
被氧化的化学方程式:(2)为了加快浸取速率可采取的措施有
(3)矿物中相关元素可溶性组分的物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分的浓度
 时认为已除尽。
时认为已除尽。
(4)“酸化”时,不可以将硫酸改为盐酸(HCl),原因是(用离子方程式表示)
(5)“冷却结晶”所得母液中,除
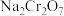 外,可在上述流程中循环利用的物质还有
外,可在上述流程中循环利用的物质还有(6)
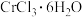 的三种结构:①
的三种结构:①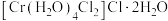 、②
、②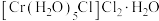 、③
、③ ,下列说法错误的是_______。
,下列说法错误的是_______。A.①中配合离子空间结构为 或 或 (已略去位于正八面体中心的 (已略去位于正八面体中心的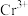 ) ) |
B.②③中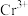 的配位数都是6 的配位数都是6 |
| C.②中存在的作用力有离子键、共价键、配位键和氢键等 |
D.等物质的量浓度、等体积的①②③溶液中, 的物质的量相等 的物质的量相等 |
您最近一年使用:0次
名校
解题方法
4 . 红磷可用于制备半导体化合物,还可以用于制造火柴、烟火,以及三氯化磷等。
Ⅰ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。
实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。 的作用是
的作用是___________ 。
(2)先小火加热控温100℃一段时间,打开活塞___________ ,达到除水的目的。再升温至120℃左右,打开活塞___________ ,达到分离收集甲苯的目的。
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。___________ 。用氩气赶走空气的目的是___________ 。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是___________ 。
Ⅱ.该实验所需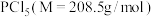 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:
步骤Ⅰ:取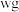 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;
步骤Ⅱ:取 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入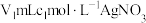 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀(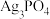 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 溶液滴定过量的
溶液滴定过量的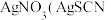 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去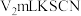 溶液。
溶液。
(5)产品中 的质量分数为
的质量分数为___________  ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
Ⅰ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。
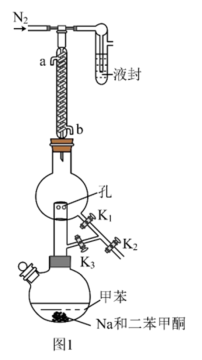
 的作用是
的作用是(2)先小火加热控温100℃一段时间,打开活塞
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。
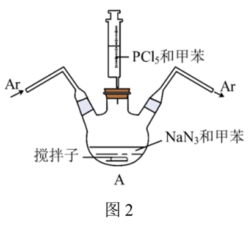
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
Ⅱ.该实验所需
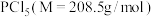 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:步骤Ⅰ:取
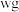 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;步骤Ⅱ:取
 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入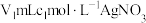 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀(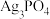 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
 溶液滴定过量的
溶液滴定过量的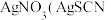 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去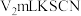 溶液。
溶液。(5)产品中
 的质量分数为
的质量分数为 ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会
您最近一年使用:0次
名校
解题方法
5 . 三氯三(四氢呋喃)合铬(Ⅲ)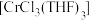 可催化烯烃加聚,制备的方法如下。
可催化烯烃加聚,制备的方法如下。
已知:①CrCl3易潮解,易升华,高温下易被氧气氧化。
②COCl2气体有毒,遇水发生水解产生两种酸性气体。
Ⅰ.制备无水CrCl3:
某化学小组用CCl4(沸点76.8℃)和1.52g Cr2O3在高温下制备无水CrCl3,同时生成COCl2气体,实验装置如图所示:___________ 。
(2)实验装置合理的连接顺序为A___________ B(填装置字母标号,装置不能重复使用)。
(3)g的作用是___________ 。
(4)尾气处理时发生反应的离子方程式___________ 。
Ⅱ.合成CrCl3(THF)3: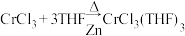
实验操作:按如图组装仪器,将步骤Ⅰ所得无水CrCl3和0.15g锌粉放入滤纸套筒内,双颈烧瓶中加入100mL无水四氢呋喃(THF),通N2 5min后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流2.5h后再通入N2冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品5.39g。___________ 。
(6)索氏提取器的提取管两侧分别是虹吸管和连接管,虹吸管是___________ (填2或3)。
(7)用电加热而不用明火加热的原因___________ 。
(8)产品产率为___________ %(结果保留小数点后一位)。
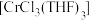 可催化烯烃加聚,制备的方法如下。
可催化烯烃加聚,制备的方法如下。已知:①CrCl3易潮解,易升华,高温下易被氧气氧化。
②COCl2气体有毒,遇水发生水解产生两种酸性气体。
Ⅰ.制备无水CrCl3:
某化学小组用CCl4(沸点76.8℃)和1.52g Cr2O3在高温下制备无水CrCl3,同时生成COCl2气体,实验装置如图所示:

(2)实验装置合理的连接顺序为A
(3)g的作用是
(4)尾气处理时发生反应的离子方程式
Ⅱ.合成CrCl3(THF)3:
①四氢呋喃( ,简写THF)为常见的有机溶剂,沸点66℃,易燃。
,简写THF)为常见的有机溶剂,沸点66℃,易燃。
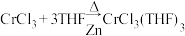
实验操作:按如图组装仪器,将步骤Ⅰ所得无水CrCl3和0.15g锌粉放入滤纸套筒内,双颈烧瓶中加入100mL无水四氢呋喃(THF),通N2 5min后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流2.5h后再通入N2冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品5.39g。
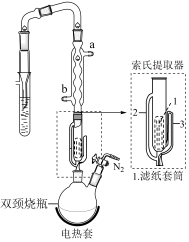
(6)索氏提取器的提取管两侧分别是虹吸管和连接管,虹吸管是
(7)用电加热而不用明火加热的原因
(8)产品产率为
您最近一年使用:0次
名校
6 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料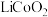 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: 是粉红色固体,难溶于水。
是粉红色固体,难溶于水。
(1)Si在元素周期表的位置是___________ 。 的电子式为
的电子式为___________ 。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”的化学方程式为
的混合物,“500℃焙烧”的化学方程式为___________ 。
(3)鉴别洗净的“滤饼3”和 中阳离子的常用方法是
中阳离子的常用方法是___________ 。
(4)实验室过滤操作时使用的玻璃仪器除玻璃棒还有___________ 。
(5)实验室检验 是否沉淀完全的操作是
是否沉淀完全的操作是___________ 。
(6)“850℃煅烧”时的化学方程式为___________ 。
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料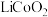 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: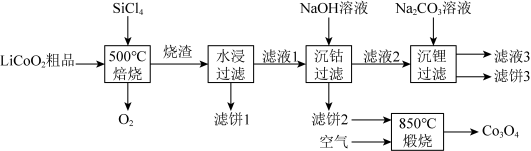
 是粉红色固体,难溶于水。
是粉红色固体,难溶于水。(1)Si在元素周期表的位置是
 的电子式为
的电子式为(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”的化学方程式为
的混合物,“500℃焙烧”的化学方程式为(3)鉴别洗净的“滤饼3”和
 中阳离子的常用方法是
中阳离子的常用方法是(4)实验室过滤操作时使用的玻璃仪器除玻璃棒还有
(5)实验室检验
 是否沉淀完全的操作是
是否沉淀完全的操作是(6)“850℃煅烧”时的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。
(1)写出下列物质化学式:A___________ ;C___________ ;
(2)写出F的电子式:___________ ;
(3)写出溶液E与 共热反应的离子方程式:
共热反应的离子方程式:___________ ;
(4)写出A和新制氯水反应的离子方程式:___________ 。
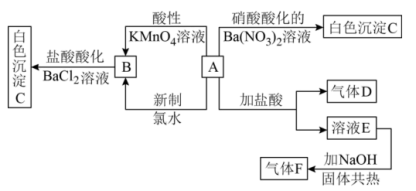
(1)写出下列物质化学式:A
(2)写出F的电子式:
(3)写出溶液E与
 共热反应的离子方程式:
共热反应的离子方程式:(4)写出A和新制氯水反应的离子方程式:
您最近一年使用:0次
名校
8 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
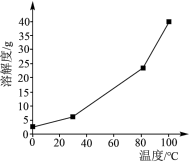
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
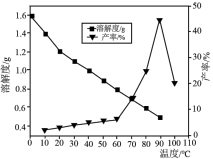
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近一年使用:0次
名校
解题方法
9 . 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al,Al2O3和Fe2O3)制备磁性Fe3O4胶体粒子、绿矾和净水剂Na2FeO4的实验流程如图:
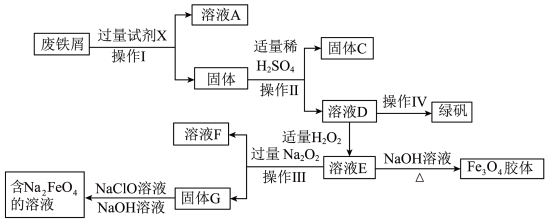
请回答下列问题:
(1)试剂X化学式为______ 。
(2)铁元素在元素周期表的位置为______ 。
(3)固体C化学名称为______ 。溶液D中加入 溶液,无红色产生,原因是
溶液,无红色产生,原因是______ (用离子方程式表示)。
(4)为得到绿矾晶体需要将溶液D倒入______ (填仪器名称)中进行浓缩,结晶。
(5)D中加入适量H2O2生成E的离子方程式______ 。若D中含3amolFe2+,则理论上加入______  H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
(6)由固体G生成Na2FeO4的离子方程式为______ 。

请回答下列问题:
(1)试剂X化学式为
(2)铁元素在元素周期表的位置为
(3)固体C化学名称为
 溶液,无红色产生,原因是
溶液,无红色产生,原因是(4)为得到绿矾晶体需要将溶液D倒入
(5)D中加入适量H2O2生成E的离子方程式
 H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。(6)由固体G生成Na2FeO4的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙奥秘离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。元素铼( )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示:
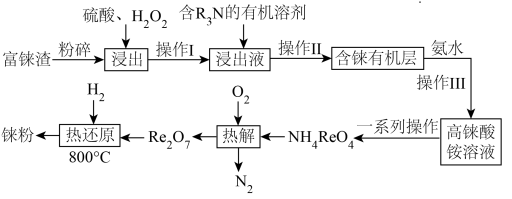
回答下列问题:
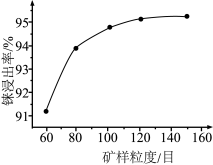
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
(2)已知“浸出”时反应中 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:__________________ 。
(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
(4)“一系列操作”包括①________ (填操作名称,下同)、冷却结晶、过滤、洗涤和②____________ ;从下列仪器中选出①②中需使用的仪器,依次为______ (填字母)。
A. B.
B. C.
C. D.
D.
(5)已知高铼酸铵是白色片状晶体,微溶于冷水,易溶于热水,欲得纯度更高的高铼酸铵晶体,可通过___________ 法提纯;“热还原”反应中氧化剂与还原剂的物质的量之比为___________ 。
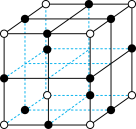
(6)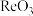 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为___________ ,铼原子填在了氧原子围成的___________ (填“四面体”“立方体”或“八面体”)空隙中。
 )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示:
回答下列问题:
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。

| A.60 | B.80 | C.100 | D.120 |
(2)已知“浸出”时反应中
 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
A.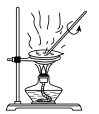 | B.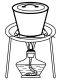 | C.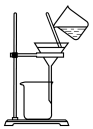 | D.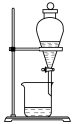 |
(4)“一系列操作”包括①
A.
 B.
B. C.
C. D.
D.
(5)已知高铼酸铵是白色片状晶体,微溶于冷水,易溶于热水,欲得纯度更高的高铼酸铵晶体,可通过
(6)
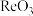 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为
您最近一年使用:0次



