名校
1 . 某学习小组将氯气和空气按体积比1∶3混合,通入含水 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。
ⅰ. 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。
ⅱ. 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
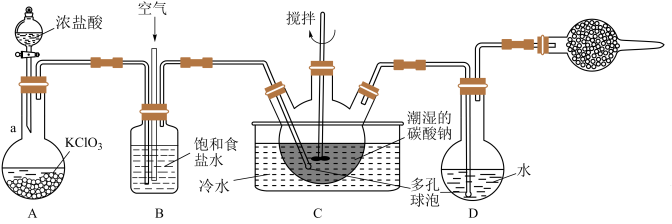
(1)仪器 的名称是
的名称是_________ ,A中发生反应的离子方程式为_________ 。
(2)实验中须控制 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用__________________ (答出2条即可)
(3)装置 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为__________________ 。
(4)将制得的 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②____________ 。设计实验探究溶液红色褪去的原因___________________________ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为______  (
( 可被
可被 还原成
还原成 )。
)。
 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。ⅰ.
 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。ⅱ.
 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
(1)仪器
 的名称是
的名称是(2)实验中须控制
 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用(3)装置
 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为(4)将制得的
 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
2023-08-22更新
|
738次组卷
|
5卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题
黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题(已下线)专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)海南省白沙学校2023-2024学年高一上学期期末考试化学试题四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题
名校
2 . 依据图中氮元素及其化合物的转化关系,回答问题:

(1)图1中,X的化学式为___________ ,从化合价上看,X具有___________ 性(填“氧化”或“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为___________ 。
②下列试剂不能用于干燥NH3的是___________ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将图2装置补充完整___________ (在图2虚框内画出连接图)。

④烧杯中倒扣漏斗的作用___________ ,体现了NH3的性质为___________
(3)回答下列关于硝酸的问题:
①配平硝酸型酸雨形成的反应方程式:___________ 。
___________NO2+___________H2O=___________HNO3+___________NO
②铜和稀硝酸反应的离子方程式___________ 。
③铜和浓硝酸反应的化学方程式___________ 。

(1)图1中,X的化学式为
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为
②下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
③若要收集一瓶氨气,请将图2装置补充完整

④烧杯中倒扣漏斗的作用
(3)回答下列关于硝酸的问题:
①配平硝酸型酸雨形成的反应方程式:
___________NO2+___________H2O=___________HNO3+___________NO
②铜和稀硝酸反应的离子方程式
③铜和浓硝酸反应的化学方程式
您最近一年使用:0次
2023-04-11更新
|
294次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2022-2023学年高一下学期4月月考(普通班)化学试题
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
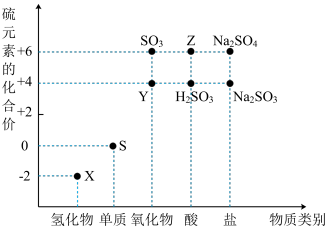
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
418次组卷
|
14卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题
【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题
解题方法
4 . 已知氨气极易溶解于水;在加热条件下氨气可与灼热的氧化铜反应,产物为氮气、水和金属铜。用下图的装置可以实现该反应(加持装置已略去)。
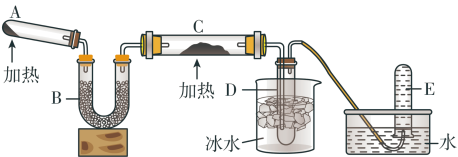
回答下列问题:
(1)A中发生反应的化学方程式是______
(2)B中加入的物质的名称是______ ,其作用是______
(3)实验时在C中观察到的现象是______ ,发生反应的化学方程式是______ 该反应中还原剂的化学式为______ 。
(4)实验结束后在D中观察到的现象是______ ,D中收集到的物质为______ (填“酸性”、“中性”,“碱性”),E中收集到气体的摩尔质量为______ 。

回答下列问题:
(1)A中发生反应的化学方程式是
(2)B中加入的物质的名称是
(3)实验时在C中观察到的现象是
(4)实验结束后在D中观察到的现象是
您最近一年使用:0次
名校
5 . 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:①2Cu(s)+ O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+ O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________ 。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
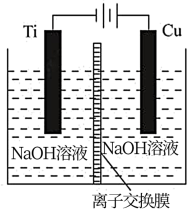
该离子交换膜为__________ 离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________ ,钛极附近的pH值______ (填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________ 。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
| 方法c | 电解法,反应为 |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+
 O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1②C(s)+
 O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1③Cu(s)+
 O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1则方法a发生反应的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为
您最近一年使用:0次
2019-10-09更新
|
159次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2020届高三10月月考化学试题
6 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH− 2
2 +H2O
+H2O
2NO2+2OH−
 +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为
,其离子方程式为________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________ 。

(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH−
 2
2 +H2O
+H2O2NO2+2OH−

 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl−和
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是

您最近一年使用:0次
2019-06-10更新
|
7404次组卷
|
32卷引用:黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题
黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题2019年江苏省高考化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升第2章 化学键化学反应规律 模拟高考——C挑战区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 模拟高考——C挑战区 夯实基础(鲁科版必修2)专题4 化学科学与人类文明——C挑战区 模拟高考(苏教版必修2)江苏省苏州新草桥中学2020届高三上学期10月月考化学试题(已下线)2020年高考化学押题预测卷01(新课标Ⅰ卷)--《2020年高考押题预测卷》(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题江苏省启东中学2021届高三上学期期初考试化学试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019人教版2019必修第二册 第五章 第二~三节综合拔高练江苏省苏州市工业园区星海实验中学高一下学期3月月考化学试题(已下线)【苏州新东方】04 吴县中学重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试题(已下线)第12讲 氮及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)广东省潮州市饶平县第二中学2021-2022学年高一下学期月考(一)化学试题海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题(已下线)专题17 原理综合题(已下线)常见无机物的性质江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题湖北省黄石市第二中学2023-2024学年高二上学期第三次统测化学试题江苏省常州市联盟校2023-2024学年高一下学期3月阶段调研化学试题江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
7 . A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大. A 与 D 同主族,可形成 DA 型离子化合物,B与C同周期且相邻,C与E同主族,E2-与 Ar 原子具有相同的电子层结构,W 的合金用量最大、用途最广.请回答下列问题:
(1)D 在元素周期表中的位置___________ .
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是________ (填化学式),原因是____________ .
(3)A、C、D三种元素形成的物质中含有的化学键类型______ ,灼热的碳能与 B 的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为_____________ .
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为____________ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_______ ;生成沉淀的原因是____________ (用平衡移动原理解释).
(1)D 在元素周期表中的位置
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是
(3)A、C、D三种元素形成的物质中含有的化学键类型
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2017-02-17更新
|
459次组卷
|
6卷引用:2017届黑龙江省大庆市高三上学期第一次模拟考试化学试卷



