A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大. A 与 D 同主族,可形成 DA 型离子化合物,B与C同周期且相邻,C与E同主族,E2-与 Ar 原子具有相同的电子层结构,W 的合金用量最大、用途最广.请回答下列问题:
(1)D 在元素周期表中的位置___________ .
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是________ (填化学式),原因是____________ .
(3)A、C、D三种元素形成的物质中含有的化学键类型______ ,灼热的碳能与 B 的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为_____________ .
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为____________ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_______ ;生成沉淀的原因是____________ (用平衡移动原理解释).
(1)D 在元素周期表中的位置
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是
(3)A、C、D三种元素形成的物质中含有的化学键类型
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为
更新时间:2017-02-17 14:59:22
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】碲是发展高科技产业、国防与尖端技术不可或缺的原料。H2TeO3是一种比草酸酸性弱的二元酸,工业上常用铜阳极泥[主要成分是碲化亚铜(Cu2Te),含少量的Ag、Au]回收碲,其工艺流程如下:
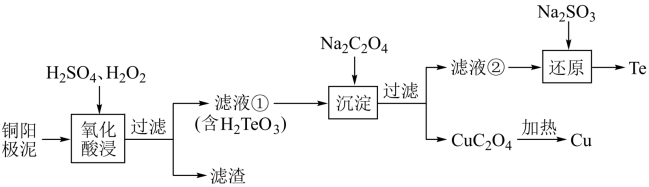
已知:CuC2O4的Ksp为2.2×10-8;离子浓度小于1×10-5mol/L时,即离子完全沉淀。
(1)Cu2Te中Te的化合价是___ 。
(2)滤渣的成分是___ ,滤液①中含有的氧化酸浸时氧化产物为____ 。氧化酸浸时温度过高会使碲的浸出率降低,原因是_______ 。
(3)若要使Cu2+完全沉淀,应控制C2O42-的浓度不低于_____ 。
(4)还原反应的离子方程式为______________ 。

已知:CuC2O4的Ksp为2.2×10-8;离子浓度小于1×10-5mol/L时,即离子完全沉淀。
(1)Cu2Te中Te的化合价是
(2)滤渣的成分是
(3)若要使Cu2+完全沉淀,应控制C2O42-的浓度不低于
(4)还原反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、 。
。
①若要除尽 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________  。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中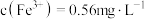 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: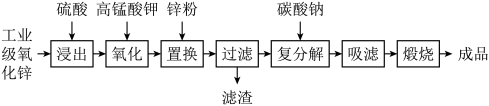
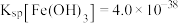 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、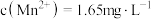 。
。①若要除尽
 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入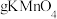 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中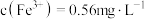 ,若溶液
,若溶液 ,则此时
,则此时
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】用方铅矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程:

已知:(1)PbS+MnO2 +4H+=Mn2++Pb2++S+2H2O
(2)PbCl2(s)+2Cl-(aq)=PbCl42-(aq) △H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________ (任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是________________________________ ;加入物质X可用于调节酸浸液的pH值,物质X可以是_______________
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有金属杂质形成的化合物,其成分为________________ (写化学式)。
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式:___________________

已知:(1)PbS+MnO2 +4H+=Mn2++Pb2++S+2H2O
(2)PbCl2(s)+2Cl-(aq)=PbCl42-(aq) △H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是
(2)向酸浸液中加入饱和食盐水的目的是
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有金属杂质形成的化合物,其成分为
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)写出A元素原子的核外电子排布式:_______ ;写出B元素原子核外电子排布的价电子构型:_______ ;用电子排布图表示C原子的核外电子排布情况:_______ 。
(2)四种元素电负性由小到大顺序(填元素符号):_______
(1)写出A元素原子的核外电子排布式:
(2)四种元素电负性由小到大顺序(填元素符号):
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】X、Y、Z、Q是原子序数依次增大的短周期主族元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的最外层电子数与最内层电子数相等,Z原子的最外层电子数为3,X、Z、Q原子的最外层电子数之和为14,M元素在地壳中的含量居第四位。回答下列问题:
(1)Y的元素符号为___________ 。用电子式表示Q与金属钠形成化合物的过程:___________ 。
(2)Z与Q的单质在加热条件下可以发生反应,请写出反应的化学方程式:___________ 。
(3)金属性:Y___________ Z(填“<”“>”或“=”),从原子结构角度上分析原因:___________ 。
(4)Z和X按照原子个数比4:3构成的固体化合物( )易与水反应生成可燃性气体(
)易与水反应生成可燃性气体( )和一种两性氢氧化物。该化合物与水反应的化学方程式为
)和一种两性氢氧化物。该化合物与水反应的化学方程式为___________ 。
(5)M的单质可用于处理酸性废水中的 ,使其转换为
,使其转换为 ,同时生成具有磁性的M的氧化物W。
,同时生成具有磁性的M的氧化物W。
①上述反应中M做___________ (填“氧化剂”或“还原剂”)。
②Z的单质与W在高温条件下反应的化学方程式为___________ 。
(1)Y的元素符号为
(2)Z与Q的单质在加热条件下可以发生反应,请写出反应的化学方程式:
(3)金属性:Y
(4)Z和X按照原子个数比4:3构成的固体化合物(
 )易与水反应生成可燃性气体(
)易与水反应生成可燃性气体( )和一种两性氢氧化物。该化合物与水反应的化学方程式为
)和一种两性氢氧化物。该化合物与水反应的化学方程式为(5)M的单质可用于处理酸性废水中的
 ,使其转换为
,使其转换为 ,同时生成具有磁性的M的氧化物W。
,同时生成具有磁性的M的氧化物W。①上述反应中M做
②Z的单质与W在高温条件下反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
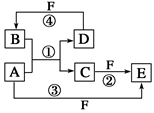
(1)若A为短周期金属单质,D为短周期非金属固体单质,且所含元素的原子序数A是D的2倍,元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的离子结构示意图为________ ,反应④的化学方程式为_______________________________ 。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是______________________ ,用电子式表示化合物B的形成过程:_______________________________ 。
(3)若A、D、F都是短周期非金属元素单质,D的M层电子是L层电子的一半,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_______________________________ 。

(1)若A为短周期金属单质,D为短周期非金属固体单质,且所含元素的原子序数A是D的2倍,元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的离子结构示意图为
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是
(3)若A、D、F都是短周期非金属元素单质,D的M层电子是L层电子的一半,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下表是元素周期表的一部分,表中所列的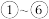 分别代表一种元素.
分别代表一种元素.
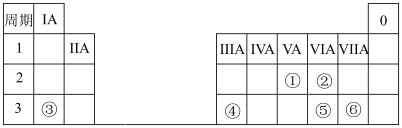
回答下列问题:
(1)①的原子结构示意图为____________ 。
(2)②和⑤中原子半径较大的是____________ (填元素符号);③和④的最高价氧化物对应的水化物中碱性较强的是____________ (填化学式)。
(3)④的单质在强碱溶液中反应的离子方程式为____________ 。
(4)用电子式表示③和⑥形成化合物的过程____________ ;实验室用该化合物配制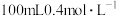 的溶液,下列实验仪器需要用到的是
的溶液,下列实验仪器需要用到的是____________ (填标号),若在配制时仰视容量瓶上的刻度线,则所配溶液物质的量浓度会____________ (填“偏大”、“偏小”或“不变”)。
A. B.
B.  C.
C.  D.
D.
 分别代表一种元素.
分别代表一种元素.
回答下列问题:
(1)①的原子结构示意图为
(2)②和⑤中原子半径较大的是
(3)④的单质在强碱溶液中反应的离子方程式为
(4)用电子式表示③和⑥形成化合物的过程
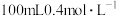 的溶液,下列实验仪器需要用到的是
的溶液,下列实验仪器需要用到的是A.
 B.
B.  C.
C.  D.
D.
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D的单质颜色相同的淡黄色固态化合物。
试根据以上叙述回答:
(1)写出AB2的电子式:___________ ;
(2)用电子式表示C2B的形成过程:____________ 。
(3)写出C单质点燃时与B单质充分反应的化学方程式:___________ 。
(4)写出淡黄色固态化合物与水反应的化学方程式:___________ 。
(5)请设计简单实验,比较元素B、D的金属性(或非金属性)强弱:___________ 。
试根据以上叙述回答:
(1)写出AB2的电子式:
(2)用电子式表示C2B的形成过程:
(3)写出C单质点燃时与B单质充分反应的化学方程式:
(4)写出淡黄色固态化合物与水反应的化学方程式:
(5)请设计简单实验,比较元素B、D的金属性(或非金属性)强弱:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】短周期主族元素W、X、Y、Z、M、Q的原子序数依次增大,在元素周期表中W的原子半径最小(稀有气体元素除外),X与Y相邻且Y的最外层电子数是次外层的3倍,Y,Z的最外层电子数之和与Q的最外层电子数相等,M是地壳中含量最多的金属元素。回答下列问题:
(1)X在元素周期表中的位置是___________ ,X的简单氢化物的沸点比同族相邻元素的简单氢化物沸点高的原因是___________ 。
(2)由W,Y,Z三种元素组成的既含离子键又含共价键的化合物的电子式是___________ 。
(3)写出Q元素最高价氧化物对应水化物的化学式为___________ 。
(4)M单质与Z的最高价氧化物对应的水化物反应的化学方程式是___________ 。
(5)W和Y组成的化合物中,写出既有极性键又有非极性键的物质的结构式___________ ,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
(1)X在元素周期表中的位置是
(2)由W,Y,Z三种元素组成的既含离子键又含共价键的化合物的电子式是
(3)写出Q元素最高价氧化物对应水化物的化学式为
(4)M单质与Z的最高价氧化物对应的水化物反应的化学方程式是
(5)W和Y组成的化合物中,写出既有极性键又有非极性键的物质的结构式
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________ ,有________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是__________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________________ 。
(4)光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米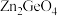 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(5) 分子的空间构形为
分子的空间构形为________ ,其中Ge原子的杂化方式为________ 。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
 | 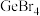 | 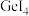 | |
| 熔点/℃ | 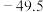 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
 制备
制备 反应中,带状纳米
反应中,带状纳米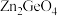 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是(5)
 分子的空间构形为
分子的空间构形为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】已知A、B、D、E、G、H、J都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的最外层电子数是次外层电子数的2倍,B元素的最高正价与最低负价代数和为2,D是非金属性最强的元素,D、H同主族,E是同周期元素中离子半径最小的元素,G元素的最高价含氧酸为二元强酸,J是第Ⅷ族元素,是生活中最常用的金属元素。请回答:
(1)阴离子GAB-与CO2结构相似,GAB-的电子式为_______ 。
(2)用电子式表示B2的形成过程__________________________________ 。
(3)D的氢化物水溶液中存在的氢键有_______ 种,画出其中一种_______ 。(用“ ”表示氢键,用短线表示共价键)
”表示氢键,用短线表示共价键)
(4)检验J3+的离子方程式为______________________________________ 。
(5)H与E能形成化合物乙。在1.01105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得乙的气态密度为5.00g/L,则此时乙的分子式为_______ 。
(1)阴离子GAB-与CO2结构相似,GAB-的电子式为
(2)用电子式表示B2的形成过程
(3)D的氢化物水溶液中存在的氢键有
 ”表示氢键,用短线表示共价键)
”表示氢键,用短线表示共价键)(4)检验J3+的离子方程式为
(5)H与E能形成化合物乙。在1.01105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得乙的气态密度为5.00g/L,则此时乙的分子式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】依据物质结构与性质回答下列问题:
(1)在① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 六种分子中,碳原子采取
六种分子中,碳原子采取 杂化的分子有
杂化的分子有_______ (填序号), 分子的空间结构是
分子的空间结构是_______ 。 与
与 相比,
相比,_______ 的熔点较高。
(2)碘的相关化合物在化工、医药、材料等领域有着广泛的应用。X射线衍射测定等发现,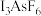 中存在
中存在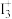 ,
,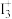 的空间结构为
的空间结构为_______ ,中心原子的杂化轨道类型为_______ 。
(3) 有机合成中常用的还原剂,
有机合成中常用的还原剂, 中的阴离子空间结构是
中的阴离子空间结构是_______ ,中心原子的杂化轨道类型为_______ 。
(1)在①
 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ 、⑥
、⑥ 六种分子中,碳原子采取
六种分子中,碳原子采取 杂化的分子有
杂化的分子有 分子的空间结构是
分子的空间结构是 与
与 相比,
相比,(2)碘的相关化合物在化工、医药、材料等领域有着广泛的应用。X射线衍射测定等发现,
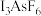 中存在
中存在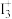 ,
,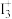 的空间结构为
的空间结构为(3)
 有机合成中常用的还原剂,
有机合成中常用的还原剂, 中的阴离子空间结构是
中的阴离子空间结构是
您最近一年使用:0次



