解题方法
1 . 以软锰矿(含 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:
(1)浸取。实验室浸取软锰矿的装置如图所示:
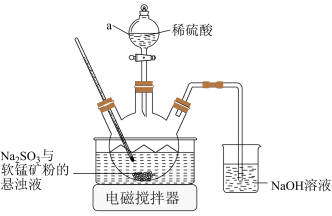
①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有_____ 。(答出一点即可)
②仪器a为_____ ;NaOH溶液的作用是_____ 。
③反应通常在70℃下反应,写出 转化为
转化为 的离子方程式
的离子方程式_____ 。
(2)除杂。向已经除去铁、铝、硅元素的 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为_____ (用必要的离子方程式结合勒夏特列原理解释)。
(3)沉锰。向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有_____ 。
a、 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡
(4)热解。将 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为_____ 。
 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:(1)浸取。实验室浸取软锰矿的装置如图所示:

①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有
②仪器a为
③反应通常在70℃下反应,写出
 转化为
转化为 的离子方程式
的离子方程式(2)除杂。向已经除去铁、铝、硅元素的
 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为(3)沉锰。向
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有a、
 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡(4)热解。将
 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为
您最近一年使用:0次
2 . 利用某钒废渣(主要成分为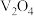 、
、 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下:
的工艺流程如下: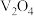 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;
Ⅱ. 。
。
回答下列问题:
(1)为加快“氧化1”速率,可以采取的措施有____________________ (写出一条即可),该过程发生反应的离子方程式为______________________________ 。
(2)滤渣2的主要成分为____________________ 。
(3)实验室进行萃取、分液操作时,需要的玻璃仪器有____________________ 。
(4)“氧化2”中发生反应的离子方程式为______________________________ 。
(5)“沉钒”前若滤液中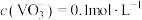 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中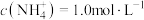 ,则钒元素的沉降率=
,则钒元素的沉降率=__________ %[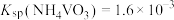 ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。
(6)在Ar气氛中“煅烧” 生成
生成 ,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式______________________________ 。
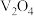 、
、 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下:
的工艺流程如下: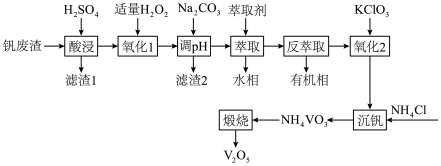
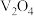 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;Ⅱ.
 。
。回答下列问题:
(1)为加快“氧化1”速率,可以采取的措施有
(2)滤渣2的主要成分为
(3)实验室进行萃取、分液操作时,需要的玻璃仪器有
(4)“氧化2”中发生反应的离子方程式为
(5)“沉钒”前若滤液中
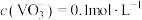 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中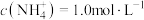 ,则钒元素的沉降率=
,则钒元素的沉降率=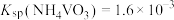 ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。(6)在Ar气氛中“煅烧”
 生成
生成 ,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
您最近一年使用:0次
2024-02-01更新
|
116次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
3 . 铁粉具有平肝镇心解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组设计利用 制备还原铁粉的流程如下。
制备还原铁粉的流程如下。

实验室中可用 (用废铁屑和稀硫酸反应制得)和
(用废铁屑和稀硫酸反应制得)和 在如图装置模拟上述流程中的“转化”环节。
在如图装置模拟上述流程中的“转化”环节。

(1)植物油的作用是___________ 。
(2)实验过程中,欲将得到的 溶液和
溶液和 溶液混合,操作方法是
溶液混合,操作方法是___________ 。混合后反应生成 的离子方程式为
的离子方程式为___________ 。
(3) 溶液要现用现配的原因是
溶液要现用现配的原因是___________ 。
(4)“干燥”的主要目的是脱去游离水,该过程中会有少量 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;取干燥后的 样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质
样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质 的质量为
的质量为___________ g。在高温条件下,过量的木炭与 反应,写出此反应的化学方程式:
反应,写出此反应的化学方程式:___________ 。
 制备还原铁粉的流程如下。
制备还原铁粉的流程如下。
实验室中可用
 (用废铁屑和稀硫酸反应制得)和
(用废铁屑和稀硫酸反应制得)和 在如图装置模拟上述流程中的“转化”环节。
在如图装置模拟上述流程中的“转化”环节。
(1)植物油的作用是
(2)实验过程中,欲将得到的
 溶液和
溶液和 溶液混合,操作方法是
溶液混合,操作方法是 的离子方程式为
的离子方程式为(3)
 溶液要现用现配的原因是
溶液要现用现配的原因是(4)“干燥”的主要目的是脱去游离水,该过程中会有少量
 在空气中被氧化为
在空气中被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为 样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质
样品11.33g,与木炭混合后焙烧,所有铁都被还原为还原铁粉,最终得到还原铁粉5.6g,样品中杂质 的质量为
的质量为 反应,写出此反应的化学方程式:
反应,写出此反应的化学方程式:
您最近一年使用:0次
2024-01-23更新
|
325次组卷
|
3卷引用:山东省肥城市第一高级中学等学校2023-2024学年高一上学期12月大联考化学试题
名校
4 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
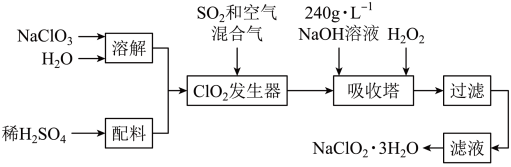
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)ClO2发生器中反应的离子方程式为___________ 。
(2)通入空气的作用可能是___________ 。
(3)吸收塔内发生反应的离子方程式为___________ 。吸收塔内的温度不能超过20℃,其目的是___________ 。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是___________ (填序号)。
A.蒸发浓缩B.蒸馏C.过滤D.灼烧E.冷却结晶

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
(1)ClO2发生器中反应的离子方程式为
(2)通入空气的作用可能是
(3)吸收塔内发生反应的离子方程式为
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是
A.蒸发浓缩B.蒸馏C.过滤D.灼烧E.冷却结晶
您最近一年使用:0次
2024-01-01更新
|
86次组卷
|
2卷引用:山东省威海市乳山市银滩高级中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
5 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
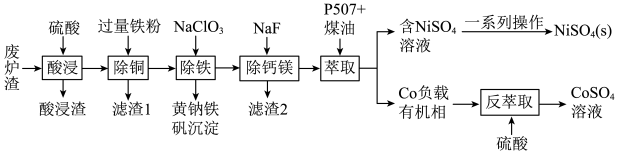
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是___________ 。(写化学式)
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F-)最小为___________ mol·L-1。[已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,Ksp(CaF2)=1.0×10-10(mol/L)3,Ksp(MgF2)=7.5×10-11(mol/L)3]
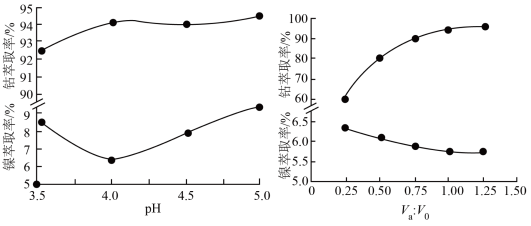
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为___________ 、___________ 。
(5)获得NiSO4(s)的“一系列操作”是___________ 。
(6)该工艺流程中,可循环利用的物质是___________ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为

(5)获得NiSO4(s)的“一系列操作”是
(6)该工艺流程中,可循环利用的物质是
您最近一年使用:0次
2023-12-27更新
|
596次组卷
|
4卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
山东省实验中学2023-2024学年高三上学期11月二诊化学试题山东省淄博市部分学校2023-2024学年高三上学期联考化学试卷(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题
名校
6 . 在如图所示的物质转化关系中。C、G、I、M为常见单质,G和M化合可生成最常见液体A,E为黑色粉末,F中含有钠元素,K为一种含有铁元素的白色沉淀,N为红褐色絮状沉淀,I为黄绿色气体,化合物B的摩尔质量为24 。(部分生成物和反应条件未列出)
。(部分生成物和反应条件未列出)

(1)M的化学式为___________ 。
(2)B的化学式为___________ 。
(3)反应②的化学方程式为___________ 。
(4)反应③的化学方程式为___________ 。
(5)C和A的蒸气在高温下反应的化学方程式为___________ ,点燃该反应产生的气体前,则必须对该气体进行___________ 。
 。(部分生成物和反应条件未列出)
。(部分生成物和反应条件未列出)
(1)M的化学式为
(2)B的化学式为
(3)反应②的化学方程式为
(4)反应③的化学方程式为
(5)C和A的蒸气在高温下反应的化学方程式为
您最近一年使用:0次
2023-12-24更新
|
156次组卷
|
2卷引用:山东省肥城市第一高级中学等学校2023-2024学年高一上学期12月大联考化学试题
7 . 某兴趣小组用含镍废催化剂(主要含有 ,还含有
,还含有 及其他不溶于酸、碱的杂质)制备
及其他不溶于酸、碱的杂质)制备 ,其流程如下:
,其流程如下: 近似值如表所示;已知:
近似值如表所示;已知: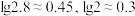 。
。
回答下列问题:
(1)加 溶液进行浸出时搅拌可提高浸出速率,原因为
溶液进行浸出时搅拌可提高浸出速率,原因为___________ ,“滤液1”中含有的主要阴离子为___________ (填化学式)。
(2)加入 “氧化”时发生反应的离子方程式为
“氧化”时发生反应的离子方程式为___________ 。
(3)“除杂”时加 调节溶液的
调节溶液的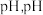 需大于
需大于_______ ,(保留1位小数,离子浓度 时认为该离子沉淀完全),简述加
时认为该离子沉淀完全),简述加 调节溶液的
调节溶液的 除杂的原理:
除杂的原理:_______ 。
(4)“一系列操作”主要包括___________ 、___________ 、过滤、洗涤、干燥等。
 ,还含有
,还含有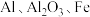 及其他不溶于酸、碱的杂质)制备
及其他不溶于酸、碱的杂质)制备 ,其流程如下:
,其流程如下: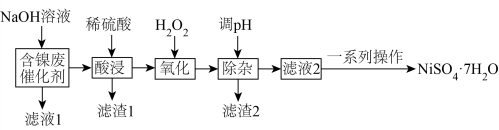
 近似值如表所示;已知:
近似值如表所示;已知: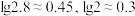 。
。| 化学式 |  |  |  |
 近似值 近似值 | 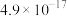 | 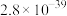 | 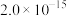 |
(1)加
 溶液进行浸出时搅拌可提高浸出速率,原因为
溶液进行浸出时搅拌可提高浸出速率,原因为(2)加入
 “氧化”时发生反应的离子方程式为
“氧化”时发生反应的离子方程式为(3)“除杂”时加
 调节溶液的
调节溶液的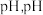 需大于
需大于 时认为该离子沉淀完全),简述加
时认为该离子沉淀完全),简述加 调节溶液的
调节溶液的 除杂的原理:
除杂的原理:(4)“一系列操作”主要包括
您最近一年使用:0次
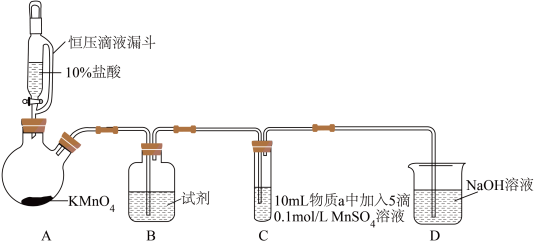
8 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
724次组卷
|
29卷引用:山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题
名校
9 . 某学习小组将氯气和空气按体积比1∶3混合,通入含水 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。
ⅰ. 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。
ⅱ. 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
,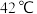 以上分解为
以上分解为 和
和 。
。
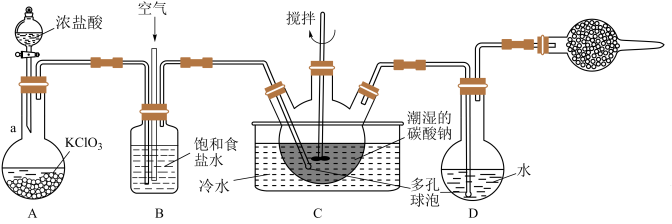
(1)仪器 的名称是
的名称是_________ ,A中发生反应的离子方程式为_________ 。
(2)实验中须控制 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用__________________ (答出2条即可)
(3)装置 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为__________________ 。
(4)将制得的 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②____________ 。设计实验探究溶液红色褪去的原因___________________________ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为______  (
( 可被
可被 还原成
还原成 )。
)。
 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。ⅰ.
 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。ⅱ.
 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
,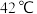 以上分解为
以上分解为 和
和 。
。
(1)仪器
 的名称是
的名称是(2)实验中须控制
 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用(3)装置
 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为(4)将制得的
 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
2023-08-22更新
|
737次组卷
|
5卷引用: 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题
山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题(已下线)专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题海南省白沙学校2023-2024学年高一上学期期末考试化学试题四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题
名校
解题方法
10 . 制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究。
已知:i.纳米Fe具有很高的活性,易被氧化使表面形成氧化层
ii.纳米Fe将 还原为
还原为 的转化关系如下:
的转化关系如下:

(1)纳米Fe的制备原理: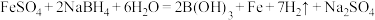 ,其中电负性H>B,反应中氧化剂是
,其中电负性H>B,反应中氧化剂是___________ ,标出上述反应电子转移的方向和数目___________ 。
(2)酸性条件下,纳米Fe和 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是___________ 。
(3)检验溶液中 的操作和现象是
的操作和现象是___________ 。
(4)水体中含有的 与
与 反应,会降低
反应,会降低 的去除率。
的去除率。 与
与 反应的离子方程式是
反应的离子方程式是___________ 。
(5)溶液初始pH较低有利于 的去除,可能的原因是
的去除,可能的原因是___________ (答1条)。
(6)反应结束时,溶液的pH升高至10左右。一段时间内,纳米Fe还原 的产物分析如图。
的产物分析如图。
注:i.氨氮包括 、
、 和
和
ii.总氮包括硝态氮、亚硝态氮和氨氮
iii.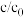 为溶液中粒子的物质的量浓度与初始
为溶液中粒子的物质的量浓度与初始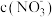 的比值
的比值
①溶液中只检出少量 ,从化学反应速率的角度解释原因:
,从化学反应速率的角度解释原因:___________ 。
②反应结束时,溶液中的总氮量小于初始时的总氮量,可能的原因是___________ 。
已知:i.纳米Fe具有很高的活性,易被氧化使表面形成氧化层
ii.纳米Fe将
 还原为
还原为 的转化关系如下:
的转化关系如下:
(1)纳米Fe的制备原理:
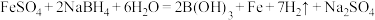 ,其中电负性H>B,反应中氧化剂是
,其中电负性H>B,反应中氧化剂是(2)酸性条件下,纳米Fe和
 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是(3)检验溶液中
 的操作和现象是
的操作和现象是(4)水体中含有的
 与
与 反应,会降低
反应,会降低 的去除率。
的去除率。 与
与 反应的离子方程式是
反应的离子方程式是(5)溶液初始pH较低有利于
 的去除,可能的原因是
的去除,可能的原因是
(6)反应结束时,溶液的pH升高至10左右。一段时间内,纳米Fe还原
 的产物分析如图。
的产物分析如图。注:i.氨氮包括
 、
、 和
和
ii.总氮包括硝态氮、亚硝态氮和氨氮
iii.
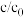 为溶液中粒子的物质的量浓度与初始
为溶液中粒子的物质的量浓度与初始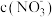 的比值
的比值①溶液中只检出少量
 ,从化学反应速率的角度解释原因:
,从化学反应速率的角度解释原因:②反应结束时,溶液中的总氮量小于初始时的总氮量,可能的原因是
您最近一年使用:0次
2023-07-21更新
|
81次组卷
|
2卷引用:山东省青岛市第二中学2022-2023学年高二5月月考化学试题



