名校
解题方法
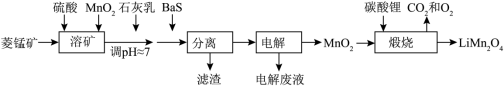
1 . 由菱锰矿(主要成分为 ,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料
,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料 的工艺流程如下:
的工艺流程如下:
已知:①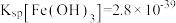 ,
, ,
, ,
,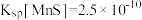 ,
, 。
。
②当溶液中离子浓度小于 时,可视为沉淀完全。
时,可视为沉淀完全。
③ 可溶于水。
可溶于水。
(1)基态锰原子的核外电子排布式为_______ 。
(2)加入少量 的目的是氧化
的目的是氧化 ,实际生产中不用
,实际生产中不用 替代
替代 的原因是
的原因是_______ 。
(3)溶矿反应完成后,先向反应后溶液中加入石灰乳至溶液 ,再加
,再加 进一步除去
进一步除去 。加石灰乳调节溶液pH时,不直接将
。加石灰乳调节溶液pH时,不直接将 沉淀完全为
沉淀完全为 的原因是
的原因是_______ 。
(4)若分离后的溶液中 ,要使
,要使 完全除尽,则需控制
完全除尽,则需控制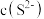 的范围为
的范围为_______ ;生产中也可用_______ (填化学式)代替 除去
除去 ,同时增加
,同时增加 产量。
产量。
(5)煅烧时,生成 的化学方程式为
的化学方程式为_______ 。
 ,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料
,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池正极材料 的工艺流程如下:
的工艺流程如下:
已知:①
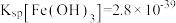 ,
, ,
, ,
,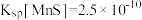 ,
, 。
。②当溶液中离子浓度小于
 时,可视为沉淀完全。
时,可视为沉淀完全。③
 可溶于水。
可溶于水。(1)基态锰原子的核外电子排布式为
(2)加入少量
 的目的是氧化
的目的是氧化 ,实际生产中不用
,实际生产中不用 替代
替代 的原因是
的原因是(3)溶矿反应完成后,先向反应后溶液中加入石灰乳至溶液
 ,再加
,再加 进一步除去
进一步除去 。加石灰乳调节溶液pH时,不直接将
。加石灰乳调节溶液pH时,不直接将 沉淀完全为
沉淀完全为 的原因是
的原因是(4)若分离后的溶液中
 ,要使
,要使 完全除尽,则需控制
完全除尽,则需控制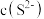 的范围为
的范围为 除去
除去 ,同时增加
,同时增加 产量。
产量。(5)煅烧时,生成
 的化学方程式为
的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。
回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐,写出这两种酸式盐在水中发生反应的离子方程式___________
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
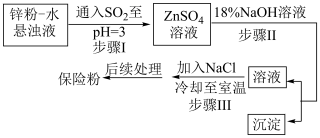
①工业上常将锌块进行预处理得到锌粉一水悬浊液,其目的是___________ 。
②在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是___________ ,“后续处理”最终要加入少量的Na2CO3固体,其原因是___________ 。
③步骤Ⅱ中发生反应的化学方程式为___________ 。
④步骤Ⅲ中加入NaCl固体的作用是___________ 。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___________ 。
回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐,写出这两种酸式盐在水中发生反应的离子方程式
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①工业上常将锌块进行预处理得到锌粉一水悬浊液,其目的是
②在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是
③步骤Ⅱ中发生反应的化学方程式为
④步骤Ⅲ中加入NaCl固体的作用是
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是
您最近一年使用:0次
名校
解题方法
3 . 三氯化氮(NCl3)为黄色油状液体,在弱酸性溶液中稳定,易溶于有机溶剂,在热水中易水解,95°C以上易爆炸,常用作漂白剂和杀菌剂。实验室常用Cl2与铵盐溶液反应制备,反应装置如图所示(夹持装置略)。

(1)装置A中盛放浓盐酸的仪器名称___________ ,该仪器与普通分液漏斗相比优点是___________ 。
(2)若用装置A制取氯气,则A中反应的离子方程式可以是(任写一条即可)___________ 。
(3)B中冰水浴的目的是___________ ,B中Cl2与NH4Cl充分反应后,采用___________ (填操作名称)得到NCl3的四氯化碳溶液,经系列操作后,将制取得到的NCl3保存在 溶液中。装置C的作用为
溶液中。装置C的作用为___________ 。
(4)反应生成的NCl3遇热水易水解,反应液有漂白性,产生的气体能让湿润的红色石蕊试纸变蓝。写出NCl3水解的化学方程式:___________ 。

(1)装置A中盛放浓盐酸的仪器名称
(2)若用装置A制取氯气,则A中反应的离子方程式可以是(任写一条即可)
(3)B中冰水浴的目的是
 溶液中。装置C的作用为
溶液中。装置C的作用为(4)反应生成的NCl3遇热水易水解,反应液有漂白性,产生的气体能让湿润的红色石蕊试纸变蓝。写出NCl3水解的化学方程式:
您最近一年使用:0次
名校
4 . 我国锑产量位居世界之首,金属锑被广泛用于生产各种阻燃剂、半导体元件等。一种辉锑矿湿法清洁冶金新工艺如下所示:

已知:辉锑矿的主要成分是 ,还含有
,还含有 、PbS、CuO和
、PbS、CuO和 等;滤液1中除含有X和
等;滤液1中除含有X和 外,还含有
外,还含有 、
、 、
、 、
、 等。回答下列问题:
等。回答下列问题:


(1)①物质X宜选用______ (填字母)。
A.NaCl溶液 B.硫酸溶液 C.盐酸
②已知滤渣1的主要成分是 和S,写出“酸浸”时
和S,写出“酸浸”时 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:______ 。
(2)加入适量Sb的主要目的是______ ,滤渣2的主要成分是______ 。
(3)我国科学家提出一种辉锑矿氧化溶解方案,其转化原理如图1所示,用离子方程式表示该原理:①______ 、②______ 。
(4)①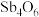 分子结构如图2所示,其中Sb原子的杂化方式为
分子结构如图2所示,其中Sb原子的杂化方式为______ 。已知沸点: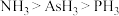 ,其原因是
,其原因是______ 。
②PbS(方铅矿)晶胞结构如图3所示,已知该晶体的密度为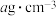 ,则晶胞参数为
,则晶胞参数为______ nm(列出计算式,用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。

已知:辉锑矿的主要成分是
 ,还含有
,还含有 、PbS、CuO和
、PbS、CuO和 等;滤液1中除含有X和
等;滤液1中除含有X和 外,还含有
外,还含有 、
、 、
、 、
、 等。回答下列问题:
等。回答下列问题:

(1)①物质X宜选用
A.NaCl溶液 B.硫酸溶液 C.盐酸
②已知滤渣1的主要成分是
 和S,写出“酸浸”时
和S,写出“酸浸”时 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:(2)加入适量Sb的主要目的是
(3)我国科学家提出一种辉锑矿氧化溶解方案,其转化原理如图1所示,用离子方程式表示该原理:①
(4)①
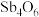 分子结构如图2所示,其中Sb原子的杂化方式为
分子结构如图2所示,其中Sb原子的杂化方式为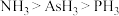 ,其原因是
,其原因是②PbS(方铅矿)晶胞结构如图3所示,已知该晶体的密度为
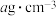 ,则晶胞参数为
,则晶胞参数为 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
您最近一年使用:0次
5 . 电解粗铜工业得到的粗硫酸镍晶体中含有 、
、 、
、 、
、 等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:

已知:①氢氧化物沉淀的范围如下表所示:
②离子沉淀完全时,该离子的浓度小于 。
。
③室温下,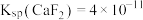 。
。
(1)粗硫酸镍晶体水浸后通入 的主要目的是
的主要目的是___________ 。
(2)滤渣1的主要成分是___________ ,将滤渣1充分焙烧后,再用硫酸酸化即可得到一种工业原料,该原料可用于气体水份的检验,焙烧滤渣1发生的反应的化学方程式为___________ 。
(3)反应II加入 反应的离子方程式为
反应的离子方程式为___________ 。
(4)加入的试剂X可以是___________ ,调整溶液 的范围为
的范围为___________ 。
(5)若反应III中 的浓度为
的浓度为 ,取等体积的
,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 完全沉淀,所加
完全沉淀,所加 溶液的浓度至少为
溶液的浓度至少为___________  。
。
 、
、 、
、 、
、 等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
已知:①氢氧化物沉淀的范围如下表所示:
| 金属阳离子 |  |  |  |
开始沉淀的 | 6.3 | 1.5 | 6.9 |
沉淀完全的 | 8.3 | 2.8 | 8.9 |
 。
。③室温下,
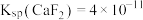 。
。(1)粗硫酸镍晶体水浸后通入
 的主要目的是
的主要目的是(2)滤渣1的主要成分是
(3)反应II加入
 反应的离子方程式为
反应的离子方程式为(4)加入的试剂X可以是
 的范围为
的范围为(5)若反应III中
 的浓度为
的浓度为 ,取等体积的
,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 完全沉淀,所加
完全沉淀,所加 溶液的浓度至少为
溶液的浓度至少为 。
。
您最近一年使用:0次
名校
6 . 亚硝酸钠(NaNO2)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究NaNO2的性质。
(1)NaNO2_______ (填“是”或“不是”)电解质,根据NaNO2的化合价,推测NaNO2具有_______ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(2)实验操作如表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
④写出实验3中发生反应的化学方程式:_______ 。
⑤通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为_______ 。
(1)NaNO2
(2)实验操作如表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
| 实验 | 实验操作及现象或结果 | 结论 |
| 1 | 取5 mL NaNO2溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 | NaNO2具有① |
| 2 | 取2 mL KMnO4溶液(先酸化好)于试管中,滴加足量的NaNO2溶液,可观察到的实验现象为② | NaNO2具有还原性 |
| 3 | NaNO2固体与70%硫酸反应生成了NO和NO2两种气体 | NaNO2具有③ |
⑤通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为
您最近一年使用:0次
7 . 硼化钛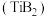 常用于制备导电陶瓷材料和
常用于制备导电陶瓷材料和 材料。工业上以高钛渣(主要成分为
材料。工业上以高钛渣(主要成分为 、
、 、
、 和
和 ,另有少量
,另有少量 、
、 )为原料制取
)为原料制取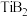 的流程如下:
的流程如下:
② 高温下蒸气压大、易挥发;
高温下蒸气压大、易挥发;
③ 可溶于热的浓硫酸形成
可溶于热的浓硫酸形成 。
。
回答下列问题:
(1)为提高“酸浸”的浸出率,可采取的措施为_______ (写一条即可)。
(2)“酸解”后滤渣的主要成分为_______ (写化学式)。
(3)“水解”需在沸水中进行,离子反应方程式为_______ ;该工艺中,经处理可循环利用的物质为_______ (写化学式)。
(4)“热还原”中发生反应的化学方程式为_______ , 的实际用量超过了理论化学计量用量,原因是
的实际用量超过了理论化学计量用量,原因是_______ 。
(5)原料中的 可由硼酸脱水制得。以
可由硼酸脱水制得。以 为原料,用电渗析法制备硼酸
为原料,用电渗析法制备硼酸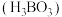 的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭
的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭 溶液进出口阀门后电解一段时间,
溶液进出口阀门后电解一段时间, 溶液的质量变化11g,则产品室中制得
溶液的质量变化11g,则产品室中制得 的质量为
的质量为_______ g。
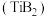 常用于制备导电陶瓷材料和
常用于制备导电陶瓷材料和 材料。工业上以高钛渣(主要成分为
材料。工业上以高钛渣(主要成分为 、
、 、
、 和
和 ,另有少量
,另有少量 、
、 )为原料制取
)为原料制取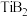 的流程如下:
的流程如下:
②
 高温下蒸气压大、易挥发;
高温下蒸气压大、易挥发;③
 可溶于热的浓硫酸形成
可溶于热的浓硫酸形成 。
。回答下列问题:
(1)为提高“酸浸”的浸出率,可采取的措施为
(2)“酸解”后滤渣的主要成分为
(3)“水解”需在沸水中进行,离子反应方程式为
(4)“热还原”中发生反应的化学方程式为
 的实际用量超过了理论化学计量用量,原因是
的实际用量超过了理论化学计量用量,原因是(5)原料中的
 可由硼酸脱水制得。以
可由硼酸脱水制得。以 为原料,用电渗析法制备硼酸
为原料,用电渗析法制备硼酸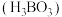 的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭
的装置如图所示。已知装置中阳离子交换膜只允许阳离子通过,关闭 溶液进出口阀门后电解一段时间,
溶液进出口阀门后电解一段时间, 溶液的质量变化11g,则产品室中制得
溶液的质量变化11g,则产品室中制得 的质量为
的质量为
您最近一年使用:0次
2023-12-05更新
|
790次组卷
|
3卷引用:黑龙江省肇东市第四中学2023-2024学年高三上学期期末考试化学试题
黑龙江省肇东市第四中学2023-2024学年高三上学期期末考试化学试题吉林省长春市2024届高三上学期质量监测(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
8 . 钴是生产多种合金和钴盐的重要原料,水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:
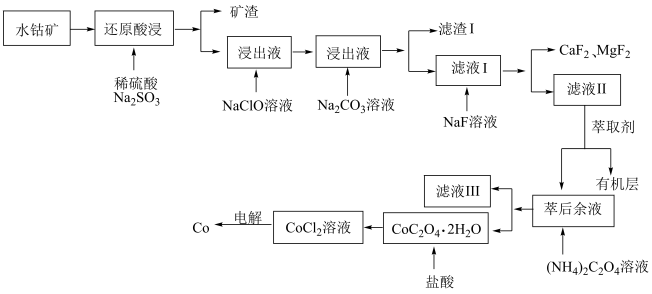
已知:①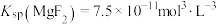 ;
;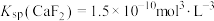
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
请回答下列问题:
(1)CoOOH中Co的化合价为_____ , 溶液的作用是
溶液的作用是______ ,请写出“还原酸浸”中发生的主要氧化还原反应的化学方程式:______ 。
(2)浸出过程中加入 溶液调pH的范围是
溶液调pH的范围是______ ≤pH<______
(3)当加入过量NaF后,所得滤液Ⅱ中 与
与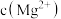 之比为
之比为______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是______ ,其使用的最佳pH范围是______ (填字母代号)。
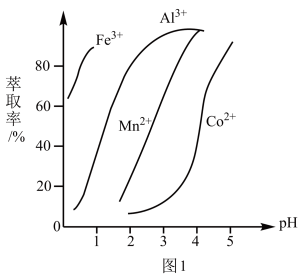
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
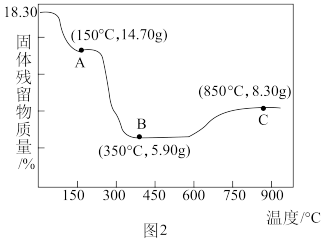
(5)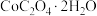 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是______ 。

已知:①
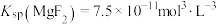 ;
;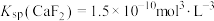
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)CoOOH中Co的化合价为
 溶液的作用是
溶液的作用是(2)浸出过程中加入
 溶液调pH的范围是
溶液调pH的范围是(3)当加入过量NaF后,所得滤液Ⅱ中
 与
与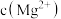 之比为
之比为(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是

a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)
 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
您最近一年使用:0次
2023-12-05更新
|
107次组卷
|
2卷引用:黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题
9 . 氯化亚铜( )广泛应用于化工行业,以海绵铜(主要成分是
)广泛应用于化工行业,以海绵铜(主要成分是 和少量
和少量 、
、 )为原料,生产
)为原料,生产 的工艺流程如下:
的工艺流程如下:

已知: 难溶于醇和水,在氯离子浓度较大的体系中生成
难溶于醇和水,在氯离子浓度较大的体系中生成 ,在潮湿空气中易水解氧化。
,在潮湿空气中易水解氧化。
回答下列问题:
(1)海绵铜“酸溶”时,为了提高溶出率,可采取的措施是___________ (任写一种)。
(2)“酸溶”过程发生氧化还原反应的离子方程式是___________ ;滤渣1的主要成分为___________ 。
(3)已知“还原”步骤中 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示:
的量关系如图所示:

①写出“还原”步骤中主要反应的离子方程式:___________ 。
②“还原”步骤中亚硫酸铵适当过量的可能原因是___________ (答出2条)。
③随着 用量增加,
用量增加, 沉降率先增大后减小,减小的原因可能是
沉降率先增大后减小,减小的原因可能是___________ (用化学方程式表示)。
(4)“一系列操作”中包含用 的酸洗、水洗、醇洗、烘干,选用醇洗的原因是
的酸洗、水洗、醇洗、烘干,选用醇洗的原因是___________ 。烘干时需要隔绝空气,原因是___________ 。
(5)“浓缩分离”得到副产品a的主要成分是___________ (填化学式)。
 )广泛应用于化工行业,以海绵铜(主要成分是
)广泛应用于化工行业,以海绵铜(主要成分是 和少量
和少量 、
、 )为原料,生产
)为原料,生产 的工艺流程如下:
的工艺流程如下:
已知:
 难溶于醇和水,在氯离子浓度较大的体系中生成
难溶于醇和水,在氯离子浓度较大的体系中生成 ,在潮湿空气中易水解氧化。
,在潮湿空气中易水解氧化。回答下列问题:
(1)海绵铜“酸溶”时,为了提高溶出率,可采取的措施是
(2)“酸溶”过程发生氧化还原反应的离子方程式是
(3)已知“还原”步骤中
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示:
的量关系如图所示:
①写出“还原”步骤中主要反应的离子方程式:
②“还原”步骤中亚硫酸铵适当过量的可能原因是
③随着
 用量增加,
用量增加, 沉降率先增大后减小,减小的原因可能是
沉降率先增大后减小,减小的原因可能是(4)“一系列操作”中包含用
 的酸洗、水洗、醇洗、烘干,选用醇洗的原因是
的酸洗、水洗、醇洗、烘干,选用醇洗的原因是(5)“浓缩分离”得到副产品a的主要成分是
您最近一年使用:0次
名校
10 . 亚硝酰氯(NOCl)熔点为-64.5℃,沸点为-5.5℃,常温下是黄色有毒气体,易水解。实验室中可用Cl2与NO在常温常压下制备NOCl。回答下列问题:
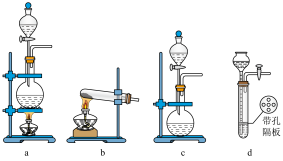
(1)若用MnO2和浓盐酸制取氯气,可以选用下列装置___________ (填字母)。
(2)若用铜和稀硝酸制取NO,则反应的离子方程式为___________ 。
(3)下列各装置按气流方向,连接的顺序为a接___________ 接d.
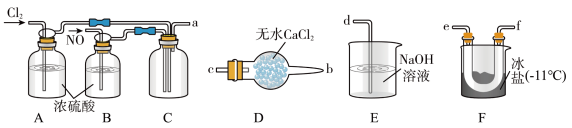
(4)①装置A和B的作用是___________ 、___________ 。
②反应开始时应先通入___________ 气体。
(5)装置F的作用是___________ 。
(1)若用MnO2和浓盐酸制取氯气,可以选用下列装置

(2)若用铜和稀硝酸制取NO,则反应的离子方程式为
(3)下列各装置按气流方向,连接的顺序为a接

(4)①装置A和B的作用是
②反应开始时应先通入
(5)装置F的作用是
您最近一年使用:0次
2023-11-30更新
|
185次组卷
|
2卷引用:黑龙江省哈尔滨市南岗中学2023-2024学年高三上学期期中考试化学试题








