1 . 某小组同学在实验室设计实验验证物质的性质及其相互转化。
Ⅰ.设计了如图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。
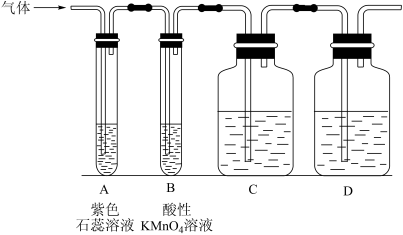
(1)从物质分类的角度,SO2属于____ (填“酸性”或“碱性”)氧化物。
(2)利用Cu与浓H2SO4反应也可以制得SO2气体,请写出该反应的化学方程式____ 。
(3)从元素化合价的角度分析,SO2既有氧化性又有还原性。
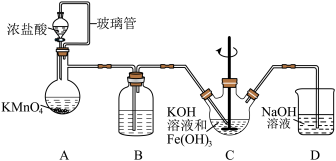
①当通入SO2一段时间后,可观察B中溶液褪色,说明SO2具有____ 性,补充完整反应的离子方程式:________SO2+________MnO +________=________SO
+________=________SO +________Mn2++________。
+________Mn2++________。____
②如验证SO2还具有另一方面的性质,可选择的药品是____ (填字母)。
A.氯化铁溶液 B.浓硫酸 C.氯水 D.硫化钠溶液
Ⅱ.实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如图方案进行提纯:
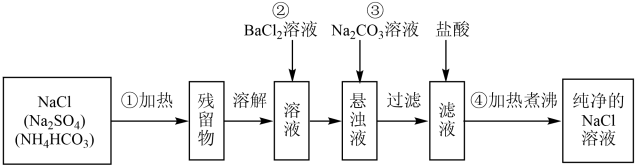
(4)请写出①加热除去NH4HCO3的化学方程式____ 。
(5)进行操作②后,如何判断SO 已除尽,方法是
已除尽,方法是____ 。
(6)操作④的目的是____ 。
Ⅰ.设计了如图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。

(1)从物质分类的角度,SO2属于
(2)利用Cu与浓H2SO4反应也可以制得SO2气体,请写出该反应的化学方程式
(3)从元素化合价的角度分析,SO2既有氧化性又有还原性。
①当通入SO2一段时间后,可观察B中溶液褪色,说明SO2具有
 +________=________SO
+________=________SO +________Mn2++________。
+________Mn2++________。②如验证SO2还具有另一方面的性质,可选择的药品是
A.氯化铁溶液 B.浓硫酸 C.氯水 D.硫化钠溶液
Ⅱ.实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如图方案进行提纯:

(4)请写出①加热除去NH4HCO3的化学方程式
(5)进行操作②后,如何判断SO
 已除尽,方法是
已除尽,方法是(6)操作④的目的是
您最近一年使用:0次
名校
2 . 下图是实验室制备K2FeO4的实验装置图,其中甲为制氯气的装置(资料:K2FeO4为紫色固体,微溶于KOH,具有强氧化性)。回答下列问题:
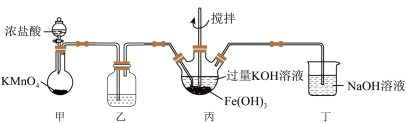
(1)甲装置中盛装浓盐酸的玻璃仪器的名称为_______ ;乙中所用试剂为______ 。
(2)写出甲中发生反应的化学方程式:___________ 。
(3)丁装置的作用___________ ,写出发生反应的离子方程式:___________ 。
(4)写出丙中发生反应的化学方程式:___________ 。丙中产生紫色固体,说明碱性条件下,___________ 氧化性强于___________ 。若取反应后丙中紫色溶液,加入稀硫酸产生Cl2,是否可以证明K2FeO4具有氧化性:说明原因:___________ 。

(1)甲装置中盛装浓盐酸的玻璃仪器的名称为
(2)写出甲中发生反应的化学方程式:
(3)丁装置的作用
(4)写出丙中发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向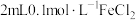 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加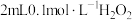 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是_____ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。
还原。
取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。
Ⅱ.乙同学认为是 被氧化。
被氧化。
取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为_____ 。
为了探究溶液褪色的原因究竞是上述的哪一种,该兴趣小组进行了如下实验。
向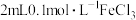 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液_____ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。
和两种可直接排放到空气中的气体。
设计实验方案验证褪色后的溶液中存在 :
:_____ 。
(4)写出上述实验中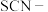 被氧化的离子方程式:
被氧化的离子方程式:_____ 。
(5)根据题目所给信息及实验现象推断物质还原性强弱:
_____ 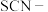 (填“>”或“<”),理由:
(填“>”或“<”),理由:_____ 。
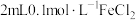 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加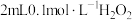 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。
还原。取褪色后溶液,滴加
 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。Ⅱ.乙同学认为是
 被氧化。
被氧化。取褪色后溶液,滴加
 溶液,出现红色。
溶液,出现红色。根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竞是上述的哪一种,该兴趣小组进行了如下实验。
向
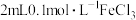 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。
和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在
 :
:(4)写出上述实验中
 被氧化的离子方程式:
被氧化的离子方程式:(5)根据题目所给信息及实验现象推断物质还原性强弱:

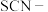 (填“>”或“<”),理由:
(填“>”或“<”),理由:
您最近一年使用:0次
名校
4 . 亚硝酸钠(NaNO2)是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。某化学兴趣小组设计实验探究NaNO2的性质。
(1)NaNO2_______ (填“是”或“不是”)电解质,根据NaNO2的化合价,推测NaNO2具有_______ (填“氧化性”、“还原性”或“氧化性和还原性”)。
(2)实验操作如表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
④写出实验3中发生反应的化学方程式:_______ 。
⑤通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为_______ 。
(1)NaNO2
(2)实验操作如表所示,请完善表格中的实验现象和结论(已知I2遇淀粉变蓝)。
| 实验 | 实验操作及现象或结果 | 结论 |
| 1 | 取5 mL NaNO2溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 | NaNO2具有① |
| 2 | 取2 mL KMnO4溶液(先酸化好)于试管中,滴加足量的NaNO2溶液,可观察到的实验现象为② | NaNO2具有还原性 |
| 3 | NaNO2固体与70%硫酸反应生成了NO和NO2两种气体 | NaNO2具有③ |
⑤通过上述实验可知,NaNO2、KMnO4、I2的氧化性由强到弱的顺序为
您最近一年使用:0次
名校
5 . 锰的化合物在工业、医疗等领域有重要应用。某兴趣小组设计实验模拟制备KMnO4及探究Mn2+能否氧化为 。
。
Ⅰ. 的制备:
的制备:
步骤一:
步骤二: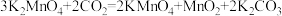
实验操作:
步骤一:将一定比例的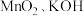 和
和 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性
固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性 溶液放入烧杯C中。
溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取 晶体。
晶体。
装置图如下:

(1)B中试剂的作用_______ 。
(2)反应结束后,未及时分离 晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是
晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是_______ 。
Ⅱ.该小组继续探究 能否氧化为
能否氧化为 ,进行了下列实验:
,进行了下列实验:
已知:ⅰ. 为棕黑色固体,难溶于水;
为棕黑色固体,难溶于水;
ⅱ. 在酸性环境下缓慢分解产生
在酸性环境下缓慢分解产生 。
。
(3)实验①中生成棕黑色沉淀可能的原因_______ 。
(4)实验②中迅速生成棕黑色沉淀的离子方程式_______ 。
(5)实验③说明_______ 。
(6)甲同学猜测实验④中紫红色消失的原因:酸性条件下 不稳定,分解产生了
不稳定,分解产生了 ,乙同学认为不成立,理由是
,乙同学认为不成立,理由是_______ ;乙同学认为是溶液中剩余的 将
将 还原,并设计了实验方案证明此推测成立,其方案为
还原,并设计了实验方案证明此推测成立,其方案为_______ 。
探究结果:在酸性条件下,某些强氧化剂可以将 氧化为
氧化为 。
。
 。
。Ⅰ.
 的制备:
的制备:步骤一:

步骤二:
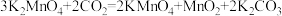
实验操作:
步骤一:将一定比例的
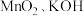 和
和 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性
固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性 溶液放入烧杯C中。
溶液放入烧杯C中。步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取
 晶体。
晶体。装置图如下:

(1)B中试剂的作用
(2)反应结束后,未及时分离
 晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是
晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是Ⅱ.该小组继续探究
 能否氧化为
能否氧化为 ,进行了下列实验:
,进行了下列实验:| 装置图 | 试剂X | 实验现象 |
 | ① 溶液 溶液 | 生成浅棕色沉淀,一段时间后变为棕黑色 |
② 和 和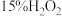 混合液 混合液 | 立即生成棕黑色沉淀 | |
③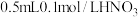 溶液 溶液 | 无明显现象 | |
④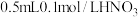 溶液和少量 溶液和少量 | 滴加 无明显现象,加入 无明显现象,加入 立即变为紫红色,稍后紫红色很快消失,生成棕黑色沉淀 立即变为紫红色,稍后紫红色很快消失,生成棕黑色沉淀 |
 为棕黑色固体,难溶于水;
为棕黑色固体,难溶于水;ⅱ.
 在酸性环境下缓慢分解产生
在酸性环境下缓慢分解产生 。
。(3)实验①中生成棕黑色沉淀可能的原因
(4)实验②中迅速生成棕黑色沉淀的离子方程式
(5)实验③说明
(6)甲同学猜测实验④中紫红色消失的原因:酸性条件下
 不稳定,分解产生了
不稳定,分解产生了 ,乙同学认为不成立,理由是
,乙同学认为不成立,理由是 将
将 还原,并设计了实验方案证明此推测成立,其方案为
还原,并设计了实验方案证明此推测成立,其方案为探究结果:在酸性条件下,某些强氧化剂可以将
 氧化为
氧化为 。
。
您最近一年使用:0次
名校
解题方法
6 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料:① 为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
② 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③ 与水反应还能产生具有强吸附性的
与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。
胶体,可除去水中细微的悬浮物,有净水作用。
④已知高铁酸钾 是强电解质,在水中的电离方程式为:
是强电解质,在水中的电离方程式为:

(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)A为氯气发生装置。发生反应的方程式为: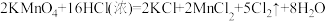 ;每生成a个氯气,转移电子数为
;每生成a个氯气,转移电子数为___ 个,用双线桥法表示此反应电子转移的方向和数目_______ 。
(3)C中得到紫色固体 和溶液,请判断氧化性
和溶液,请判断氧化性
_______  (填“>”“=”或“<”),C中通
(填“>”“=”或“<”),C中通 制得
制得 的离子反应方程式为
的离子反应方程式为_______ 。
(4)下列关于 的说法中,正确的是
的说法中,正确的是_______ 。
A.是强氧化性的盐 B.固体保存需要防潮 C.其净水优点有:作用快、安全性好、无异味
(5)将 与水反应的化学方程式补充完整:
与水反应的化学方程式补充完整:___ 
 并探究其性质。
并探究其性质。资料:①
 为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。②
 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。③
 与水反应还能产生具有强吸附性的
与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。
胶体,可除去水中细微的悬浮物,有净水作用。④已知高铁酸钾
 是强电解质,在水中的电离方程式为:
是强电解质,在水中的电离方程式为:

(1)
 中铁元素的化合价为
中铁元素的化合价为(2)A为氯气发生装置。发生反应的方程式为:
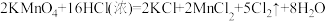 ;每生成a个氯气,转移电子数为
;每生成a个氯气,转移电子数为(3)C中得到紫色固体
 和溶液,请判断氧化性
和溶液,请判断氧化性
 (填“>”“=”或“<”),C中通
(填“>”“=”或“<”),C中通 制得
制得 的离子反应方程式为
的离子反应方程式为(4)下列关于
 的说法中,正确的是
的说法中,正确的是A.是强氧化性的盐 B.固体保存需要防潮 C.其净水优点有:作用快、安全性好、无异味
(5)将
 与水反应的化学方程式补充完整:
与水反应的化学方程式补充完整:
您最近一年使用:0次
名校
7 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
581次组卷
|
3卷引用:黑龙江省大庆市2023届高三下学期第二次教学质量检测理科综合化学试题
名校
8 . 碳酸锰( )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程: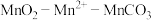
已知: 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。
请回答下列问题:
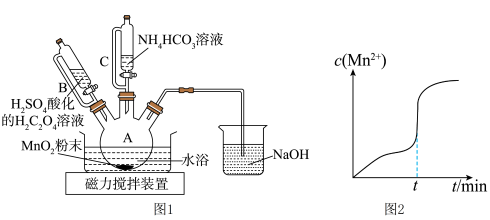
(1)仪器A的名称为________ 。
(2)在烧瓶中加入一定量的 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式________ ,反应过程中 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时, 迅速增大的原因是
迅速增大的原因是________ 。
(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为________ 。
(4)实验结束后,将装置A中的混合物过滤,用________ 洗涤滤渣,再低温烘干,即得到干燥的 固体。
固体。
(5)已知 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:________ 。
(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量________ (写出表达式)
 )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程: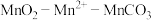
已知:
 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。请回答下列问题:

(1)仪器A的名称为
(2)在烧瓶中加入一定量的
 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时, 迅速增大的原因是
迅速增大的原因是(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的
 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为(4)实验结束后,将装置A中的混合物过滤,用
 固体。
固体。(5)已知
 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量
您最近一年使用:0次
名校
9 . 浩瀚的海洋中蕴藏着丰富的资源。
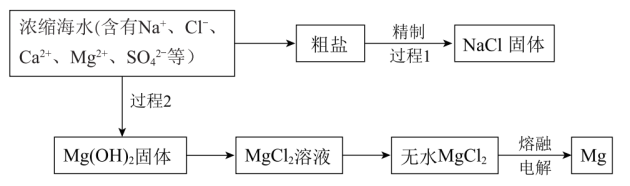
(1)粗盐精制:过程1除去粗盐中的 、
、 、
、 杂质时,粗盐溶解后加入下列沉淀剂,过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入下列沉淀剂,过滤除去沉淀,再加入适量的盐酸。
a.过量的 溶液 b.过量的
溶液 b.过量的 溶液 c.过量的
溶液 c.过量的 溶液
溶液
①加入沉淀剂的顺序正确的是_______ (填序号)。
A.abc B. bac C. cba
②加入适量盐酸,反应的离子方程式有_______ 和_______ 。
(2)海水提镁:
①过程2中加入廉价易得的试剂是_______ 。(填化学式)
②由Mg2+获得 的离子方程式是
的离子方程式是_______ 。
(3)海水提溴:主要工业生产流程如下图所示。
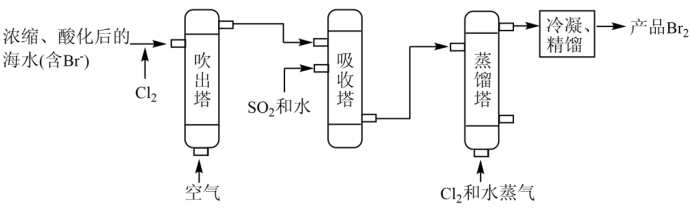
①上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_______ 。
②吸收塔中 将
将 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
③步骤Ⅱ通入热空气吹出Br2,利用了溴的_______ (填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
④工业上也可用 溶液吸收吹出的
溶液吸收吹出的 。补全以下化学方程式:
。补全以下化学方程式:_______ 。
_______ +_______
+_______ +
+ =_______
=_______ +_______
+_______ +_______
+_______

(1)粗盐精制:过程1除去粗盐中的
 、
、 、
、 杂质时,粗盐溶解后加入下列沉淀剂,过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入下列沉淀剂,过滤除去沉淀,再加入适量的盐酸。a.过量的
 溶液 b.过量的
溶液 b.过量的 溶液 c.过量的
溶液 c.过量的 溶液
溶液①加入沉淀剂的顺序正确的是
A.abc B. bac C. cba
②加入适量盐酸,反应的离子方程式有
(2)海水提镁:
①过程2中加入廉价易得的试剂是
②由Mg2+获得
 的离子方程式是
的离子方程式是(3)海水提溴:主要工业生产流程如下图所示。

①上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是
②吸收塔中
 将
将 转化为
转化为 的化学方程式是
的化学方程式是③步骤Ⅱ通入热空气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
④工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 。补全以下化学方程式:
。补全以下化学方程式:_______
 +_______
+_______ +
+ =_______
=_______ +_______
+_______ +_______
+_______
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.下表是某儿童在哈尔滨市医疗机构临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童_______ 元素含量偏低(填元素名称)。
(2)报告单中“mol·L-1”是_______ (填“质量”、“体积”或“浓度”)的单位。
(3)检测儿童的血液中钙的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,钙的正常含量参考范围是1.55~2.10 mmol/L。如果以“mg/dL”表示,钙的正常含量参考范围是_______ ?(计算结果保留两位小数)
Ⅱ.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(4)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_______ (填离子符号)。
(5)步骤②加入过量H2O2的目的是_______ 。步骤②反应的离子方程式为_______ 。
(6)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______ g。服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的_______ 。(填“氧化性”或“还原性”)。
(7)由FeSO4·7H2O固体配制500mL0.10 mol/L FeSO4溶液,需要的仪器有药匙、玻璃棒、_______ (从下列图中选择,写出名称)。

(8)以下操作会导致所配溶液浓度偏低的是_______ 。(填序号)
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(9)若向FeSO4溶液中加入足量Na2O2,观察到的现象是_______ 。
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | mol·L-l | 66-120 |
| 2 | 铁(Fe) | 6.95 | mmol·L-1 | 7.52-11.82 |
| 3 | 钙(Ca) | 1.78 | mmol·L-1 | 1.55-2.10 |
根据上表的数据,回答下列问题。
(1)该儿童
(2)报告单中“mol·L-1”是
(3)检测儿童的血液中钙的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,钙的正常含量参考范围是1.55~2.10 mmol/L。如果以“mg/dL”表示,钙的正常含量参考范围是
Ⅱ.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(4)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有
(5)步骤②加入过量H2O2的目的是
(6)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
(7)由FeSO4·7H2O固体配制500mL0.10 mol/L FeSO4溶液,需要的仪器有药匙、玻璃棒、

(8)以下操作会导致所配溶液浓度偏低的是
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(9)若向FeSO4溶液中加入足量Na2O2,观察到的现象是
您最近一年使用:0次



