名校
解题方法
1 . 浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:
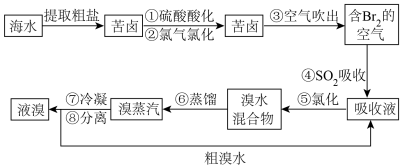
(1)用热空气能将溴单质吹出的原因是___________ 。
(2)写出④发生反应的化学方程式___________ 。
(3)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的___________ 。
Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
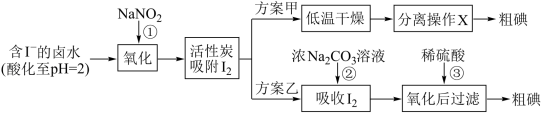
资料显示:
ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NO
ⅱ.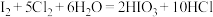 ;氧化性:
;氧化性: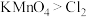
ⅲ.
(4)请列举除蒸馏法外海水淡化的一种方法:___________ 。
(5)写出反应①的离子方程式___________ 。
(6)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 、冷凝结晶。
(7) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
a.将滤液用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,___________ 。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:

(1)用热空气能将溴单质吹出的原因是
(2)写出④发生反应的化学方程式
(3)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NOⅱ.
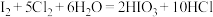 ;氧化性:
;氧化性: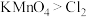
ⅲ.

(4)请列举除蒸馏法外海水淡化的一种方法:
(5)写出反应①的离子方程式
(6)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(7)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。实验中可供选择的试剂:稀
 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。a.将滤液用
 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,b.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-05-25更新
|
374次组卷
|
2卷引用:天津市第一中学2022—2023学年高一下学期第二次月考化学试题
2 . 实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)

①A为氯气发生装置,其中盛装浓盐酸仪器的名称是_______ 。A中反应的离子方程式为_______ 。
②请在B方框内将除杂装置补充完整,并标明所用试剂_______ 。
③C中得到紫色固体和溶液。C中主要反应的化学方程式为_______ 。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是
。为证明是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
由方案Ⅰ中溶液变红可知a中含有的离子为_______ ,但该离子的产生不能判断一定是 将
将 氧化,该离子还可能由
氧化,该离子还可能由_______ 产生(用离子方程式表示)。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
③资料表明,酸性溶液中的氧化性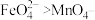 ,验证实验如下:将溶液b滴入
,验证实验如下:将溶液b滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:_______ 。
 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
①A为氯气发生装置,其中盛装浓盐酸仪器的名称是
②请在B方框内将除杂装置补充完整,并标明所用试剂
③C中得到紫色固体和溶液。C中主要反应的化学方程式为
(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是
。为证明是 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 溶出,得到紫色溶液b。取少量b,滴加盐酸,有 产生。 产生。 |
 将
将 氧化,该离子还可能由
氧化,该离子还可能由②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
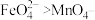 ,验证实验如下:将溶液b滴入
,验证实验如下:将溶液b滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
3 . (Ⅰ)已知A为常见的金属单质。B俗称磁性氯化铁。根据如图所示的关系:
B:_______ D:_______ 。
(2)写出③的离子方程式:_______ 。
(3)写出④的化学方程式:_______ 。
(4)写出⑤的化学方程式:_______ 。
(5)写出E→F的现象_______ 。
写出E→F的化学方程式_______ 。
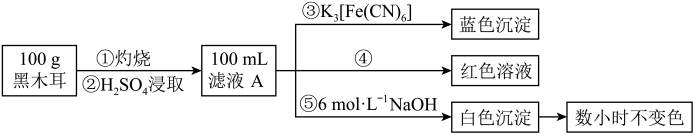
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。
ⅲ. 与铁氰化钾(
与铁氰化钾(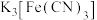 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。
为确定黑木耳中含有铁元素,甲同学设计实验方案如图。_______ 。
(7)步骤④检验 所用试剂是
所用试剂是_______ 溶液。
(8)下列有关上述实验得出的结论正确的是_______ (填字母符号)。
a.黑木耳中一定含 和
和
b.滤液A中一定含 和
和
c.白色沉淀中一定含
为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(10)步骤⑦中观察到的实验现象是_______ ,反应的离子方程式是_______ 。

B:
(2)写出③的离子方程式:
(3)写出④的化学方程式:
(4)写出⑤的化学方程式:
(5)写出E→F的现象
写出E→F的化学方程式
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的
 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。ⅲ.
 与铁氰化钾(
与铁氰化钾(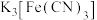 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。为确定黑木耳中含有铁元素,甲同学设计实验方案如图。
(7)步骤④检验
 所用试剂是
所用试剂是(8)下列有关上述实验得出的结论正确的是
a.黑木耳中一定含
 和
和
b.滤液A中一定含
 和
和
c.白色沉淀中一定含

为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
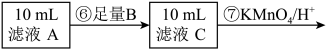
| A.Na | B.Zn | C.Fe | D.Cu |
(10)步骤⑦中观察到的实验现象是
您最近一年使用:0次
4 . Ⅰ.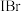 、
、 、
、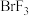 等称之为卤素互化物,
等称之为卤素互化物, 、
、 、
、 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈 、
、 两种价态,则这种化合物的化学式是
两种价态,则这种化合物的化学式是__________ 。
(2)溴化碘(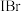 )具有强氧化性,能与
)具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为________ ;
(3)①已知某些离子的还原性强弱顺序为 。现将几滴
。现将几滴 溶液滴入到含少量
溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象_______ ;
②下列物质中,也可以使该溶液红色褪去的是_______ ;
A 新制氯水 B 碘水 C D 盐酸
D 盐酸
(4) 为剧毒物质,处理含有
为剧毒物质,处理含有 的废水常用的方法是:在碱性条件下用
的废水常用的方法是:在碱性条件下用 溶液将
溶液将 氧化为
氧化为 和一种单质气体,该反应的离子方程式为
和一种单质气体,该反应的离子方程式为_________ ;
(5)已知 的电离平衡常数
的电离平衡常数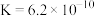 ,
, 的电离平衡常数
的电离平衡常数 ,
, ,则下列离子方程式能发生的是
,则下列离子方程式能发生的是____________ 。
A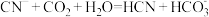 B
B 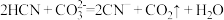
C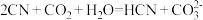 D
D 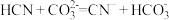
Ⅱ.如下图转化关系: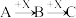
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为_______ 。
(7)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为______ 。
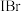 、
、 、
、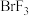 等称之为卤素互化物,
等称之为卤素互化物, 、
、 、
、 等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。(1)有一种碘的氧化物可以称为碘酸碘,其中碘元素呈
 、
、 两种价态,则这种化合物的化学式是
两种价态,则这种化合物的化学式是(2)溴化碘(
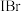 )具有强氧化性,能与
)具有强氧化性,能与 溶液发生反应,发生反应的离子方程式为
溶液发生反应,发生反应的离子方程式为(3)①已知某些离子的还原性强弱顺序为
 。现将几滴
。现将几滴 溶液滴入到含少量
溶液滴入到含少量 的溶液中,溶液立即变红,向其中逐滴滴入酸性
的溶液中,溶液立即变红,向其中逐滴滴入酸性 溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象
溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象②下列物质中,也可以使该溶液红色褪去的是
A 新制氯水 B 碘水 C
 D 盐酸
D 盐酸(4)
 为剧毒物质,处理含有
为剧毒物质,处理含有 的废水常用的方法是:在碱性条件下用
的废水常用的方法是:在碱性条件下用 溶液将
溶液将 氧化为
氧化为 和一种单质气体,该反应的离子方程式为
和一种单质气体,该反应的离子方程式为(5)已知
 的电离平衡常数
的电离平衡常数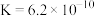 ,
, 的电离平衡常数
的电离平衡常数 ,
, ,则下列离子方程式能发生的是
,则下列离子方程式能发生的是A
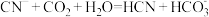 B
B 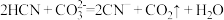
C
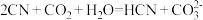 D
D 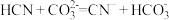
Ⅱ.如下图转化关系:
(6)若B为白色胶状不溶物,则A与C反应的离子方程式为
(7)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室用舍勒的方法制取 时选用图中装置
时选用图中装置_____ (填“A”或“ ”),反应的离子方程式为
”),反应的离子方程式为_____ 。装置 中管
中管 的作用是
的作用是_____ 。

(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_____ (填字母)。
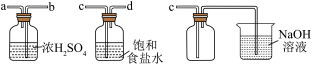
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_____ (填化学式)氧化性减弱。
猜想2:_____ 减弱。
猜想3: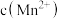 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。
。
请配平该反应的方程式:_____
_____ (浓)
(浓) _
_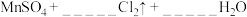 ,
,
(4)“地康法”制取氯气总反应的化学方程式为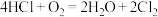 ,其反应原理如图所示:
,其反应原理如图所示:
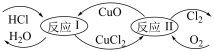
反应Ⅰ: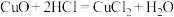
反应Ⅱ:……
反应Ⅱ的化学方程式为_____ 。
(1)实验室用舍勒的方法制取
 时选用图中装置
时选用图中装置 ”),反应的离子方程式为
”),反应的离子方程式为 中管
中管 的作用是
的作用是
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
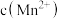 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,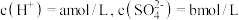 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。
。请配平该反应的方程式:
_____
 (浓)
(浓) _
_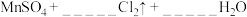 ,
,(4)“地康法”制取氯气总反应的化学方程式为
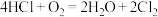 ,其反应原理如图所示:
,其反应原理如图所示:
反应Ⅰ:
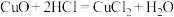
反应Ⅱ:……
反应Ⅱ的化学方程式为
您最近一年使用:0次
解题方法
6 . 某小组探究酸化条件对0.1mol/LKI溶液氧化反应的影响。
(1)溶液变蓝,说明溶液中含有____________ 。结合实验1和实验2,该小组同学认为酸化能够加快I-氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1mol/LKI溶液成分与新制0.1mol/LKI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1mol/LKI溶液在空气中放置,测得pH如下:
资料:
ⅰ.pH<11.7时,I-能被O2氧化为I。
ⅱ.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用化学用语,解释0.1mol/LKI溶液放置初期pH升高的原因:_________________________________________________________ 。
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是_____________________________________________________________________________________ 。
(3)同学甲进一步设计实验验证分析的合理性。
(4)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL 4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
从实验5可以看出pH越大,歧化反应速率越_______________ (填“快”或“慢”)。
解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因:_________________________ 。
| 序号 | 操作及现象 |
| 实验1 | 取放置一段时间后依然无色的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液立即变蓝 |
| 实验2 | 取新制的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液10s后微弱变蓝 |
(1)溶液变蓝,说明溶液中含有
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1mol/LKI溶液成分与新制0.1mol/LKI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1mol/LKI溶液在空气中放置,测得pH如下:
| 时间 | 5分钟 | 1天 | 3天 | 10天 |
| pH | 7.2 | 7.4 | 7.8 | 8.7 |
资料:
ⅰ.pH<11.7时,I-能被O2氧化为I。
ⅱ.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用化学用语,解释0.1mol/LKI溶液放置初期pH升高的原因:
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是
(3)同学甲进一步设计实验验证分析的合理性。
| 序号 | 操作 | 现象 |
| 实验4 | 重复实验2操作后,继续向溶液中加入 | 溶液立即变蓝 |
(4)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL 4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
| 实验组 | A | B | C | D |
| pH | 11.4 | 10.6 | 9.5 | 8.4 |
| 现象 | 无颜色变化 | 产生蓝色后瞬间消失 | 产生蓝色,30s后蓝色消失 | |
从实验5可以看出pH越大,歧化反应速率越
解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因:
您最近一年使用:0次
2020-05-11更新
|
317次组卷
|
4卷引用:天津市河北区2021-2022学年高三上学期期末考试化学试题
天津市河北区2021-2022学年高三上学期期末考试化学试题北京市丰台区2020届高三第一次模拟考试化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京市北京交通大学附属中学2020-2021学年高二上学期期末练习化学试题
解题方法
7 . 某化学小组对铁及其化合物的性质、制备进行如下探究。请按要求回答下列问题。
(一) 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液
(1)同学甲探究铁具有还原性,可选择试剂: 粉、
粉、 溶液、
溶液、_______ 。
(2)同学乙为探究 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是_______ ;欲获得更充分证据,此实验操作应该完善为_______ 。
(3)同学丙欲探究 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为_______ 。
(二) 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
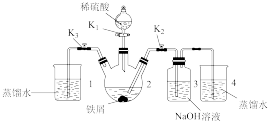
(4)为达到实验目的,需进行的操作:先打开 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再_______ ,_______ ,发现溶液从装置2进入装置3中,关闭 。
。
(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:_______ 。
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ. 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。
①从原子结构解释步骤I很容易发生的原因:_______ 。
②上述过程属于氧化还原反应的步骤为_______ (填序号)。
(7)化学修复过程探究:研究发现, 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。
①加热目的是_______ 。
②检测 洗涤干净与否的操作:
洗涤干净与否的操作:_______ 。
③铁器表面的 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
④修复中 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:_______ 。
(一)
 与
与 性质探究。供选试剂:
性质探究。供选试剂: 溶液、
溶液、 溶液、
溶液、 片、
片、 粉、
粉、 溶液
溶液(1)同学甲探究铁具有还原性,可选择试剂:
 粉、
粉、 溶液、
溶液、(2)同学乙为探究
 的还原性,取2 mL
的还原性,取2 mL  溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是
溶液,向其中滴加少量氯水,观察现象不太明显,其原因可能是(3)同学丙欲探究
 具有氧化性,其方案涉及反应的离子方程式为
具有氧化性,其方案涉及反应的离子方程式为(二)
 的制备同学丁设计如图所示装置,气密性已查完好。
的制备同学丁设计如图所示装置,气密性已查完好。
(4)为达到实验目的,需进行的操作:先打开
 ,关闭
,关闭 ,打开
,打开 ,反应片刻后,再
,反应片刻后,再 。
。(5)从实验操作过程分析装置3中有灰绿色沉淀产生而没有产生白色沉淀的原因:
(三)出土铁器修复部分过程的分析与探究
(6)腐蚀原理分析:一般认为,铁经过了如下腐蚀循环:Ⅰ.
 转化为
转化为 ;Ⅱ.
;Ⅱ. 在自然环境中形成
在自然环境中形成 ;Ⅲ.
;Ⅲ. 和
和 反应形成致密的
反应形成致密的 保护层;Ⅳ.
保护层;Ⅳ. 保护层再转化为
保护层再转化为 。如此往复腐蚀。
。如此往复腐蚀。①从原子结构解释步骤I很容易发生的原因:
②上述过程属于氧化还原反应的步骤为
(7)化学修复过程探究:研究发现,
 对铁的腐蚀会造成严重影响,铁器表面会产生
对铁的腐蚀会造成严重影响,铁器表面会产生 。将铁器浸没在盛有
。将铁器浸没在盛有
 、
、
 的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用
的溶液的容器中,缓慢加热至60~90℃。一段时间后,取出器物,用 溶液洗涤,至无
溶液洗涤,至无 。
。①加热目的是
②检测
 洗涤干净与否的操作:
洗涤干净与否的操作:③铁器表面的
 脱氯生成
脱氯生成 。写出该反应的离子方程式:
。写出该反应的离子方程式:④修复中
 变成
变成 。写出该反应的化学方程式:
。写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
8 . 某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:______ 。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______ 。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______ 。
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是______ ,实验现象是______ 。
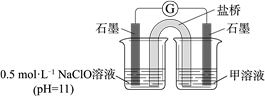
(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是______ 。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是______ 。欲证明实验Ⅱ所得溶液中存在IO3−,改进的实验方案是______ 。
③ 实验Ⅱ中反应的离子方程式是______ 。
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ |  | ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ |  | ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I−和IO3−的形式存在。酸性条件下IO3−不能氧化Cl−,可以氧化I−。ClO−在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L−1 NaClO溶液的pH=11,用离子方程式表示其原因:
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是
② 进一步提出假设b:NaClO可将I2氧化为IO3−。进行实验证实了假设b成立,装置如下图,其中甲溶液是

(4)检验实验Ⅱ所得溶液中的IO3−:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3−。
① 产生的黄绿色气体是
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3−,理由是
③ 实验Ⅱ中反应的离子方程式是
您最近一年使用:0次
2018-05-17更新
|
581次组卷
|
4卷引用:天津市实验中学2020届高三下学期4月第二次测试化学试题
天津市实验中学2020届高三下学期4月第二次测试化学试题【全国区级联考】北京市西城区2018届高三二模化学试题(已下线)【全国区级联考】北京市西城区2018届高三二模理综化学试题(已下线)北京市西城高三化学二模试题
解题方法
9 . 研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程,请回答下列问题。
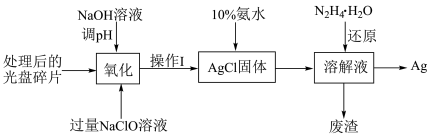
(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为_____ 。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为______ 。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是_______ 。
(3)操作Ⅰ的名称为_______ 。化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1:2反应可生成Cl-和一种阳离子__________ 的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是_______ 。
(4)常温时N2H4·H2O(水合肼)在碱性条件下能还原(3)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到______ g的单质Ag。
(5)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为_____ ,负极的产物有____ 。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为
(3)操作Ⅰ的名称为
(4)常温时N2H4·H2O(水合肼)在碱性条件下能还原(3)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到
(5)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为
您最近一年使用:0次
名校
10 . I.某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:
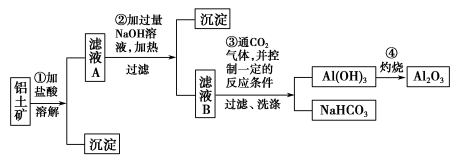
(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是______________ 。
(2)写出步骤①中发生反应的离子方程式___________
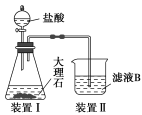
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?________ 。若合理,请用离子方程式解释其原因_________________________________ (若你认为不合理,该空不作答)。
II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:_____________________________
(2)实验②的化学反应中转移电子的物质的量是_______________________ 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是__________________________________________________________ 。

(1)在实验中需用1 mol·L-1的NaOH溶液480 mL,配制该溶液已有下列仪器:烧杯、托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是
(2)写出步骤①中发生反应的离子方程式
(3)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?

II.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:
(2)实验②的化学反应中转移电子的物质的量是
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是
您最近一年使用:0次



