2024·陕西榆林·三模
名校
1 .  (三氯化六氨合钴,
(三氯化六氨合钴,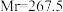 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知:①在 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示;
在水中的溶解度如图所示; 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。
制备步骤如下:
Ⅰ. 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。 锥形瓶内加入
锥形瓶内加入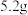 研细的
研细的 、
、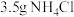 和
和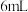 水,加热溶解后加入
水,加热溶解后加入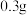 活性炭作催化剂。
活性炭作催化剂。
Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入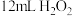 溶液。
溶液。
Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的 晶体
晶体 。
。
请回答下列问题:
(1)仪器a的名称为___________ 。
(2)用图中的装置组合制备 ,仪器的连接顺序为
,仪器的连接顺序为___________ 。装置B的作用是___________ 。
(3)制备三氯化六氨合钴的反应方程式为___________ 。
(4)在制备 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因___________ 。
(5)步骤Ⅲ中在加入 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是___________ 。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为___________ 、___________ 。
(7)制得 产品的产率为
产品的产率为___________ %(精确到0.1%)。
 (三氯化六氨合钴,
(三氯化六氨合钴,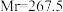 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;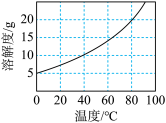
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入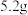 研细的
研细的 、
、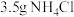 和
和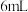 水,加热溶解后加入
水,加热溶解后加入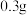 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
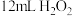 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
您最近一年使用:0次
解题方法
2 . 利用硫酸烧渣(主要含Fe2O3、FeO,还含有SiO2和CuO等)来制取FeSO4溶液。
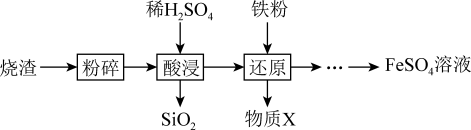
(1)“酸浸”时,Fe2O3发生反应的离子方程式是_______ 。
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是______ 。
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有_______ 。
②根据计算,选用的容量瓶规格应为______ 。
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是_______ 。
②试通过计算,求原FeSO4溶液的物质的量浓度是多少_______ ?(写出计算过程)

(1)“酸浸”时,Fe2O3发生反应的离子方程式是
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是
②试通过计算,求原FeSO4溶液的物质的量浓度是多少
您最近一年使用:0次
名校
解题方法
3 . 纳米磁性Fe3O4在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米的工艺流程如下:
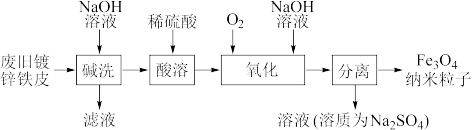
(1)将废旧镀锌铁皮“碱洗”的目的是除油污和___________ 。
(2)“酸溶”后的溶液中阳离子主要有___________ 。
(3)“氧化”时发生的总反应化学方程式为___________ 。在酸性条件下,FeSO4很容易发生如下反应: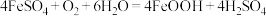 ,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为___________ 。
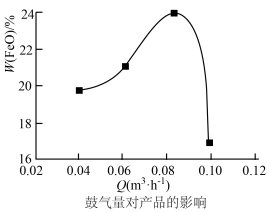
(4)空气的流量影响磁性性能的好坏。由图可知,当空气的鼓入量为0.08m3·h-1时,磁性Fe3O4会混有FeO(纵坐标w为质量分数)。此时实际产品中Fe2+与Fe3+的物质的量之比约为___________ 。
(5)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是___________ 。

(1)将废旧镀锌铁皮“碱洗”的目的是除油污和
(2)“酸溶”后的溶液中阳离子主要有
(3)“氧化”时发生的总反应化学方程式为
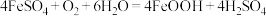 ,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为(4)空气的流量影响磁性性能的好坏。由图可知,当空气的鼓入量为0.08m3·h-1时,磁性Fe3O4会混有FeO(纵坐标w为质量分数)。此时实际产品中Fe2+与Fe3+的物质的量之比约为

(5)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是
您最近一年使用:0次
解题方法
4 . 丙烯是重要的有机化合物,具有广泛应用。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。
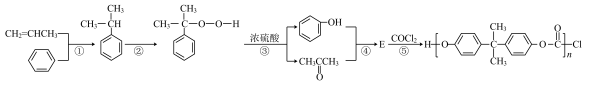
(1)丙酮与水互溶的原因是______ 。
(2)反应②的原子利用率为100%,加入的氧化剂是______ (填分子式)。
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择______ (选填序号)。
A.NaOH B. C.
C.
(4)E的分子式为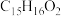 ,则其结构简式为
,则其结构简式为______ 。
Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
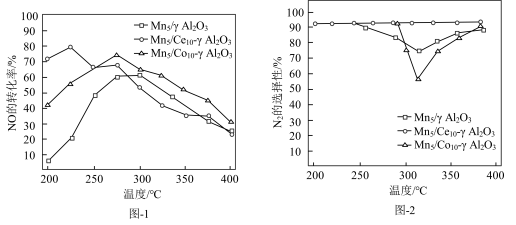
添加助剂______ (选填“Ce”、“Co”)改善催化剂的催化活性效果更加显著。
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
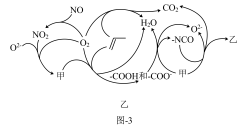
①图中,甲为______ ,乙为______ 。(用化学式表示)
②若参加反应的丙烯与NO物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为______ 。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。

(1)丙酮与水互溶的原因是
(2)反应②的原子利用率为100%,加入的氧化剂是
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择
A.NaOH B.
 C.
C.
(4)E的分子式为
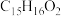 ,则其结构简式为
,则其结构简式为Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂
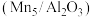 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
添加助剂
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性
 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
①图中,甲为
②若参加反应的丙烯与NO物质的量之比为
 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
解题方法
5 . Ⅰ. 广泛用作水处理剂及漂白剂。
广泛用作水处理剂及漂白剂。
已知:25℃时 溶液中
溶液中 、
、 物质的量分数随
物质的量分数随 的分布如图所示。
的分布如图所示。

(1)工业上将 通入
通入 的
的 溶液中制备
溶液中制备 。
。
①制备 的化学方程式为
的化学方程式为______ 。
②溶液 时,该溶液中主要存在的阴离子有
时,该溶液中主要存在的阴离子有______ (填化学式)。
Ⅱ. 是一种重要的杀菌消毒剂,其一种生产工艺如下:
是一种重要的杀菌消毒剂,其一种生产工艺如下:

(2)写出“反应”步骤中生成 的化学方程式
的化学方程式______ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 和
和 ,要加入的试剂分别为
,要加入的试剂分别为______ ,______ 。精制时如何证明 已经完全除尽:
已经完全除尽:______ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ,发生如下反应:
,发生如下反应:
______ ______
______ ______
______ ______
______ ______
______ ______
______
①配平上述化学方程式。______
②某容器中发生一个化学反应,其中涉及 、
、 、
、 、
、 、
、 、
、 六种粒子。其中
六种粒子。其中 、
、 的物质的量随时间变化的曲线如图所示。
的物质的量随时间变化的曲线如图所示。

则该反应的离子方程式为:______ 。
 广泛用作水处理剂及漂白剂。
广泛用作水处理剂及漂白剂。已知:25℃时
 溶液中
溶液中 、
、 物质的量分数随
物质的量分数随 的分布如图所示。
的分布如图所示。
(1)工业上将
 通入
通入 的
的 溶液中制备
溶液中制备 。
。①制备
 的化学方程式为
的化学方程式为②溶液
 时,该溶液中主要存在的阴离子有
时,该溶液中主要存在的阴离子有Ⅱ.
 是一种重要的杀菌消毒剂,其一种生产工艺如下:
是一种重要的杀菌消毒剂,其一种生产工艺如下:
(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 和
和 ,要加入的试剂分别为
,要加入的试剂分别为 已经完全除尽:
已经完全除尽:(4)“尾气吸收”是吸收“电解”过程排出的少量
 ,发生如下反应:
,发生如下反应:______
 ______
______ ______
______ ______
______ ______
______ ______
______
①配平上述化学方程式。
②某容器中发生一个化学反应,其中涉及
 、
、 、
、 、
、 、
、 、
、 六种粒子。其中
六种粒子。其中 、
、 的物质的量随时间变化的曲线如图所示。
的物质的量随时间变化的曲线如图所示。
则该反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
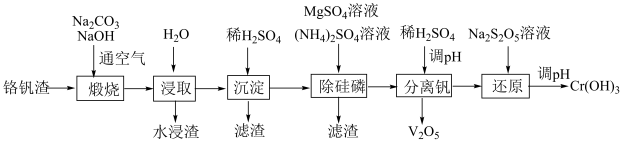
6 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以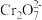 存在,在碱性介质中以
存在,在碱性介质中以 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ 。(填化学式)。
(2)水浸渣中主要有 和
和___________ 。
(3)“除硅磷”步骤中,使硅、磷分别以 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的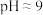 以达到最好的除杂效果,其原因是
以达到最好的除杂效果,其原因是___________ 。
(4)“还原”步骤中加入焦亚硫酸钠( )溶液。
)溶液。
①写出 还原
还原 的离子方程式:
的离子方程式:___________ 。
②若用过氧化氢还原 过程中还会生成较稳定的蓝色的过氧化铬(
过程中还会生成较稳定的蓝色的过氧化铬( ,
, 为+6价)。
为+6价)。 分子中存在过氧键,其结构式可表示为
分子中存在过氧键,其结构式可表示为___________ 。
(5)为研究净水剂聚合硫酸铁 组成,某化学兴趣小组取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的
组成,某化学兴趣小组取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 溶液,得到白色沉淀
溶液,得到白色沉淀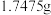 。另一份溶液,先将
。另一份溶液,先将 还原为
还原为 ,再用
,再用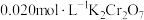 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。求
。求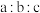 值
值___________ 。(写出计算过程)(已知: 。)
。)

已知:最高价铬酸根在酸性介质中以
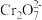 存在,在碱性介质中以
存在,在碱性介质中以 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有
 和
和(3)“除硅磷”步骤中,使硅、磷分别以
 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的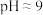 以达到最好的除杂效果,其原因是
以达到最好的除杂效果,其原因是(4)“还原”步骤中加入焦亚硫酸钠(
 )溶液。
)溶液。①写出
 还原
还原 的离子方程式:
的离子方程式:②若用过氧化氢还原
 过程中还会生成较稳定的蓝色的过氧化铬(
过程中还会生成较稳定的蓝色的过氧化铬( ,
, 为+6价)。
为+6价)。 分子中存在过氧键,其结构式可表示为
分子中存在过氧键,其结构式可表示为(5)为研究净水剂聚合硫酸铁
 组成,某化学兴趣小组取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的
组成,某化学兴趣小组取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的 溶液,得到白色沉淀
溶液,得到白色沉淀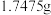 。另一份溶液,先将
。另一份溶液,先将 还原为
还原为 ,再用
,再用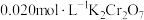 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。求
。求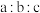 值
值 。)
。)
您最近一年使用:0次
名校
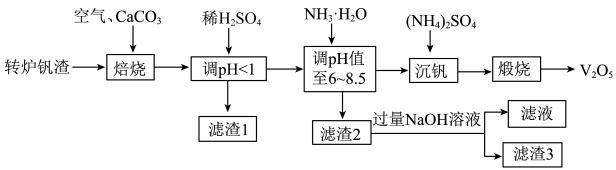
7 . 一种以转炉钒渣(主要成分为V2O3、FeO、SiO2及少量MgO、CaO、Al2O3)为原料实现低成本回收钒资源的生产工艺如下:
表一:相关金属离子[c0(Mn+) = 0.01 mol·L−1]形成氢氧化物沉淀的pH范围如下:
表二:部分含钒物质在水溶液中主要存在形式如下:
已知:①“焙烧”的主要反应之一为:CaCO3(s) = CaO(s) + CO2(g);
②在焙烧过程中产生Ca2V2O7;其中,Ca2V2O7在水中的溶解度小,易溶于稀硫酸和碱溶液。
(1)焙烧前将转炉钒渣研磨的目的是___________ 。
(2)Ca2V2O7中V的化合价为___________ ,写出在焙烧过程中产生Ca2V2O7的化学方程式___________ 。
(3)写出用稀H2SO4调pH<1的离子方程式为___________ 。
(4)“滤渣2”的主要成分是___________ 。
(5)“调pH值至6~8.5”时控制温度不超过40℃,原因是___________ 。
(6)沉钒后的操作是___________ 、干燥,得到NH4VO3.写出NH4VO3分解生成V2O5的化学方程式___________ 。

表一:相关金属离子[c0(Mn+) = 0.01 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 7.5 | 2.2 | 3.7 | 9.4 |
| 沉淀完全的pH | 9.0 | 3.2 | 4.7 | 10.9 |
| pH | <1 | 1 ~ 4 | 6 ~ 8.5 | >13 |
| 主要形式 | VO | V2O5 | VO | VO |
| 备注 | 多钒酸盐在水中溶解度较小 | |||
②在焙烧过程中产生Ca2V2O7;其中,Ca2V2O7在水中的溶解度小,易溶于稀硫酸和碱溶液。
(1)焙烧前将转炉钒渣研磨的目的是
(2)Ca2V2O7中V的化合价为
(3)写出用稀H2SO4调pH<1的离子方程式为
(4)“滤渣2”的主要成分是
(5)“调pH值至6~8.5”时控制温度不超过40℃,原因是
(6)沉钒后的操作是
您最近一年使用:0次
名校
解题方法
8 . 水合肼 的制备方法有多种,实验室以
的制备方法有多种,实验室以 、NaOH和尿素
、NaOH和尿素 为原料制备,也可以利用电解法制备。再用水合肼处理铜氨溶液并制得铜粉,其实验过程可表示为:
为原料制备,也可以利用电解法制备。再用水合肼处理铜氨溶液并制得铜粉,其实验过程可表示为:
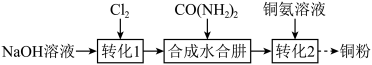
已知: 沸点约118℃,具有强还原性。
沸点约118℃,具有强还原性。
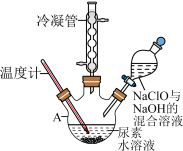
(1)“合成水合肼”用如图所示装置。仪器A的名称是_______ ,仪器A中反应的离子方程式是_______ 。
(2)若滴加NaClO与NaOH的混合溶液的速度较快,水合肼的产率会下降,原因是_______ 。
(3)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
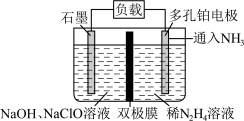
①双极膜中产生的_______ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应方程式为_______ 。
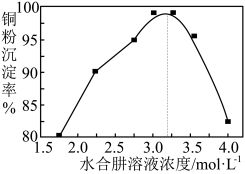
(4)已知: 。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨溶液[主要含有
。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨溶液[主要含有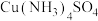 ]回收铜粉的实验方案:取一定体积
]回收铜粉的实验方案:取一定体积 水合肼溶液,
水合肼溶液,_______ ,静置、过滤、洗涤、干燥。(须使用的试剂: 硫酸、NaOH固体、铜氨溶液、蒸馏水)
硫酸、NaOH固体、铜氨溶液、蒸馏水)
 的制备方法有多种,实验室以
的制备方法有多种,实验室以 、NaOH和尿素
、NaOH和尿素 为原料制备,也可以利用电解法制备。再用水合肼处理铜氨溶液并制得铜粉,其实验过程可表示为:
为原料制备,也可以利用电解法制备。再用水合肼处理铜氨溶液并制得铜粉,其实验过程可表示为:
已知:
 沸点约118℃,具有强还原性。
沸点约118℃,具有强还原性。(1)“合成水合肼”用如图所示装置。仪器A的名称是

(2)若滴加NaClO与NaOH的混合溶液的速度较快,水合肼的产率会下降,原因是
(3)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应方程式为
(4)已知:
 。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨溶液[主要含有
。铜粉沉淀率与水合肼溶液初始浓度的关系如图所示。请设计由铜氨溶液[主要含有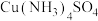 ]回收铜粉的实验方案:取一定体积
]回收铜粉的实验方案:取一定体积 水合肼溶液,
水合肼溶液, 硫酸、NaOH固体、铜氨溶液、蒸馏水)
硫酸、NaOH固体、铜氨溶液、蒸馏水)
您最近一年使用:0次
名校
解题方法
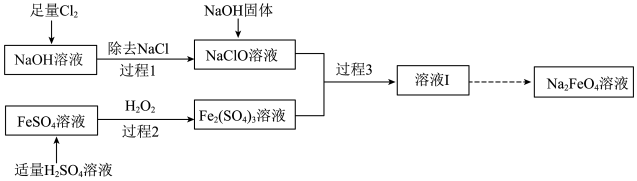
9 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,Na2FeO4只能在强碱性条件下稳定存在,主要用于饮用水处理,制备高铁酸钠有多种方法,其中一种方法的实验流程如下:
请回答下列问题。
(1)流程中需要使用Cl2。下图装置可用于制备较干燥、纯净的Cl2。
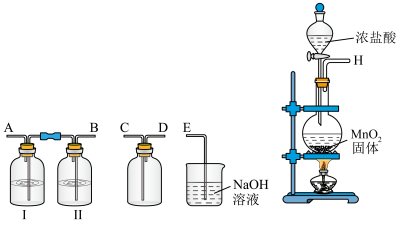
①广口瓶Ⅱ中盛放的溶液为_________ (填字母)。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
②请按正确的顺序连接装置:H→_____、_____→____、____→E,_________ 。
③MnO2与浓盐酸反应的化学方程式为___________ ;反应中,体现还原性和酸性的HC1之比
_________ 。
(2)过程1所得NaClO溶液中需要加入NaOH固体,其目的是___________ 。
(3)过程2中所发生反应的离子方程式为___________ 。
(4)过程3中所发生反应的离子方程式如下:

①请将上述离子方程式配平,并用双线桥表示电子的转移__________ 。
②一个完整的氧化还原反应往往可以拆成两个半反应,一个为“氧化半反应”,另一个为“还原半反应”,两个半反应可以通过叠加得到总反应。如Zn+Cu2+=Zn2++Cu的氧化半反应为Zn-2e- =Zn2+,还原半反应为Cu2++2e- =Cu。则上述离子方程式对应的氧化半反应为___________ (请将化学计量数化到最简整数比)。

请回答下列问题。
(1)流程中需要使用Cl2。下图装置可用于制备较干燥、纯净的Cl2。

①广口瓶Ⅱ中盛放的溶液为
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
②请按正确的顺序连接装置:H→_____、_____→____、____→E,
③MnO2与浓盐酸反应的化学方程式为

(2)过程1所得NaClO溶液中需要加入NaOH固体,其目的是
(3)过程2中所发生反应的离子方程式为
(4)过程3中所发生反应的离子方程式如下:

①请将上述离子方程式配平,并用双线桥表示电子的转移
②一个完整的氧化还原反应往往可以拆成两个半反应,一个为“氧化半反应”,另一个为“还原半反应”,两个半反应可以通过叠加得到总反应。如Zn+Cu2+=Zn2++Cu的氧化半反应为Zn-2e- =Zn2+,还原半反应为Cu2++2e- =Cu。则上述离子方程式对应的氧化半反应为
您最近一年使用:0次
10 . 氮氧化物(NOx)是硝酸和肼等工业的主要污染物。采用选择性催化还原或氧化吸收法可有效脱除烟气中的氮氧化物。
(1)利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=___________ kJ·mol-1。
(2)一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,A在沸石笼内转化为B、C、D等中间体的过程如图2所示。
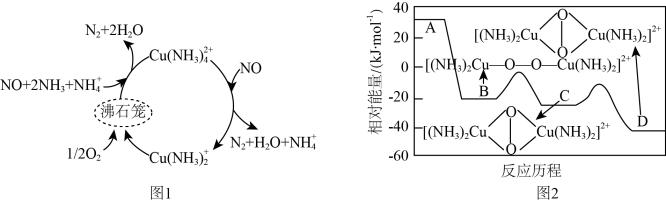
①由A到B的变化过程可用离子反应方程式表示为___________ 。
②脱除NO的总反应为___________ 。
(3)电解氧化吸收法可将废气中的NOx转变为硝态氮。分别向0.1mol·L-1NaCl溶液和0.08mol·L-1Na2SO4溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图3所示。
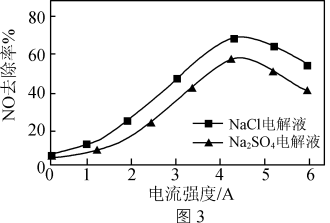
①电解Na2SO4溶液时产生H2O2。H2O2氧化吸收NO的离子方程式为___________ 。
②电解NaCl溶液作吸收液时,NO的去除率始终比Na2SO4溶液的大,原因是___________ 。
(1)利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH=
(2)一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,A在沸石笼内转化为B、C、D等中间体的过程如图2所示。

①由A到B的变化过程可用离子反应方程式表示为
②脱除NO的总反应为
(3)电解氧化吸收法可将废气中的NOx转变为硝态氮。分别向0.1mol·L-1NaCl溶液和0.08mol·L-1Na2SO4溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图3所示。

①电解Na2SO4溶液时产生H2O2。H2O2氧化吸收NO的离子方程式为
②电解NaCl溶液作吸收液时,NO的去除率始终比Na2SO4溶液的大,原因是
您最近一年使用:0次



