名校
1 . 一氧化氮是一种大气污染物,是吸烟、汽车尾气及垃圾燃烧等释放出的有害气体,但是这种最常见、最简单的气体小分子在生物体内却是一种重要的信使分子,具有保护心血管、降低血压以及提高性能力的作用。NO与 中氮元素的价态均处于中间价态,则NO与
中氮元素的价态均处于中间价态,则NO与 均既有氧化性又有还原性。
均既有氧化性又有还原性。
(1)NO在一定条件下与氨气发生归中反应生成 ,其化学方程式为
,其化学方程式为___________ 。
(2) 可发生自身歧化反应,
可发生自身歧化反应, 与
与 的化学方程式为
的化学方程式为___________ ,氧化剂和还原剂的物质的量之比为___________ , 与NaOH溶液反应可生成两种盐,其中一种是
与NaOH溶液反应可生成两种盐,其中一种是 ,化学方程式为
,化学方程式为___________ 。
(3)实验室收集NO的方法为。治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:___________ ,当生成 时,被还原的NO为
时,被还原的NO为___________ mol。
 中氮元素的价态均处于中间价态,则NO与
中氮元素的价态均处于中间价态,则NO与 均既有氧化性又有还原性。
均既有氧化性又有还原性。(1)NO在一定条件下与氨气发生归中反应生成
 ,其化学方程式为
,其化学方程式为(2)
 可发生自身歧化反应,
可发生自身歧化反应, 与
与 的化学方程式为
的化学方程式为 与NaOH溶液反应可生成两种盐,其中一种是
与NaOH溶液反应可生成两种盐,其中一种是 ,化学方程式为
,化学方程式为(3)实验室收集NO的方法为。治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
 时,被还原的NO为
时,被还原的NO为
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)一种新型的人工固氮原理如图a所示,该过程中属于氧化还原反应的是_________ (填反应编号)。_________ 。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放,SCR(选择性催化还原)工作原理如图b所示,NSR(NOx储存还原)工作原理如图c所示。_________ 。
②SCR催化过程中,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒,用化学方程式表示(NH4)2SO4的形成:_________ 。
③NSR转化中,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原,其中储存NOx的物质是_________ 。
④用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图d表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的H2与Ba(NO3)2的物质的量之比是_________ 。
经过简单猜测,小组成员认为该氮肥的有效成分为铵盐,为了验证猜想,他们取了少量氮肥配制为溶液,后续应当进行的操作为_________ 。
(1)一种新型的人工固氮原理如图a所示,该过程中属于氧化还原反应的是

(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放,SCR(选择性催化还原)工作原理如图b所示,NSR(NOx储存还原)工作原理如图c所示。

②SCR催化过程中,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒,用化学方程式表示(NH4)2SO4的形成:
③NSR转化中,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原,其中储存NOx的物质是
④用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图d表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的H2与Ba(NO3)2的物质的量之比是

经过简单猜测,小组成员认为该氮肥的有效成分为铵盐,为了验证猜想,他们取了少量氮肥配制为溶液,后续应当进行的操作为
您最近一年使用:0次
2024-04-10更新
|
166次组卷
|
2卷引用:江苏省无锡市第一中学2023-2024学年高一下学期3月月考化学试题
3 . 回答下列问题。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中___________ 元素被氧化,___________ (填化学式)是氧化剂。
(2)用单线桥标出电子转移方向和数目___________ 。
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为___________ 。
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:
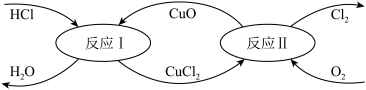
(4)反应Ⅱ的化学方程式为___________ 。
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式___________ 。
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共___________ mol。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中
(2)用单线桥标出电子转移方向和数目
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:

(4)反应Ⅱ的化学方程式为
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共
您最近一年使用:0次
名校
4 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2 +3Cl-+yH2O。
+3Cl-+yH2O。
(1)上述反应中的x=___________ ,y=___________ 。
(2)上述反应中氧化剂为___________ ;还原产物为___________ 。
(3)由上述反应可知,氧化性强弱:ClO-___________  (填“>”或“<”,下同);还原性强弱:Cl-
(填“>”或“<”,下同);还原性强弱:Cl-_________ Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:___________ 。
 +3Cl-+yH2O。
+3Cl-+yH2O。(1)上述反应中的x=
(2)上述反应中氧化剂为
(3)由上述反应可知,氧化性强弱:ClO-
 (填“>”或“<”,下同);还原性强弱:Cl-
(填“>”或“<”,下同);还原性强弱:Cl-(4)请用单线桥法表示该反应中电子的转移情况:
您最近一年使用:0次
名校
5 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯( )的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 。
。
①关于二氧化氯的说法不正确的是_______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②下列试剂中,可将 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.
d.
(2)亚氯酸钠( )是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
① 的氧化性
的氧化性______  的氧化性(填“大于”或“小于”)。
的氧化性(填“大于”或“小于”)。
②当消耗 时,生成
时,生成 的质量为
的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收 的过程如下图。
的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收 过程中作氧化剂的微粒有
过程中作氧化剂的微粒有___________ ,催化剂是___________ 。
(1)二氧化氯(
 )的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 。
。①关于二氧化氯的说法不正确的是
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②下列试剂中,可将
 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.
d.
(2)亚氯酸钠(
 )是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。①
 的氧化性
的氧化性 的氧化性(填“大于”或“小于”)。
的氧化性(填“大于”或“小于”)。②当消耗
 时,生成
时,生成 的质量为
的质量为(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收
 的过程如下图。
的过程如下图。
①该过程的总反应的离子方程式是
②整个吸收
 过程中作氧化剂的微粒有
过程中作氧化剂的微粒有
您最近一年使用:0次
名校
6 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
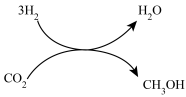
(1)利用 可合成多种化工产品。
可合成多种化工产品。
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现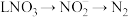 的转化,将
的转化,将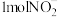 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
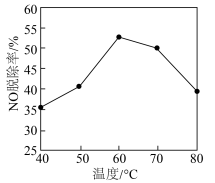
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现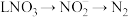 的转化,将
的转化,将 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近一年使用:0次
名校
7 . 氮氧化物对环境的污染及防治是化学研究的热点之一。请回答下列问题:
(1)汽车尾气中的 、
、 (氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
(氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式:
还原的化学方程式:_____ 。
(2)用氨气可以将氮氧化物转化为无毒气体,如 ,
,
①对该反应来说,每生成10个氮气分子,参与反应的氧化剂与还原剂的质量之比是______ (填最简整数比)。
②写出氨气将 转化为无毒气体的化学方程式:
转化为无毒气体的化学方程式:________________________ 。
(3)工业尾气中的氮氧化物常采用碱液吸收法处理。
 与
与 按计量数之比
按计量数之比 被足量
被足量 溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式
溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式______ 。
Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
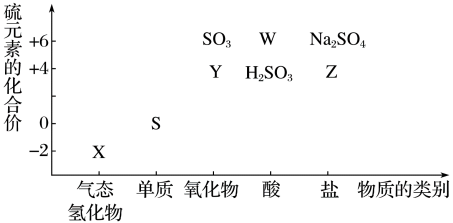
(4)X的化学式为____________ 。
(5)欲制备 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是______ (填字母)。
A B.
B. C.
C. D.
D.
(6)工业上常用以下反应炼铁和制硫酸:
①
②
已知 中
中 为
为 价,
价, 中
中 为
为 价。则反应①的氧化产物为
价。则反应①的氧化产物为______ (填化学式);当反应①、②生成数量相等的 分子时,转移的电子数之比为
分子时,转移的电子数之比为____________ (填最简整数比)。
(1)汽车尾气中的
 、
、 (氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
(氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式:
还原的化学方程式:(2)用氨气可以将氮氧化物转化为无毒气体,如
 ,
,①对该反应来说,每生成10个氮气分子,参与反应的氧化剂与还原剂的质量之比是
②写出氨气将
 转化为无毒气体的化学方程式:
转化为无毒气体的化学方程式:(3)工业尾气中的氮氧化物常采用碱液吸收法处理。
 与
与 按计量数之比
按计量数之比 被足量
被足量 溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式
溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(4)X的化学式为
(5)欲制备
 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是A
 B.
B. C.
C. D.
D.
(6)工业上常用以下反应炼铁和制硫酸:
①

②

已知
 中
中 为
为 价,
价, 中
中 为
为 价。则反应①的氧化产物为
价。则反应①的氧化产物为 分子时,转移的电子数之比为
分子时,转移的电子数之比为
您最近一年使用:0次
8 . 回答下列问题:
(1)配平下列反应,并用双线桥标明电子转移方向和数目_______ 。
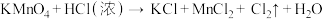
(2) 是一种新的消毒剂,工业上可用
是一种新的消毒剂,工业上可用 氧化
氧化 溶液制取
溶液制取 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(3)二氧化氯( )是国际上公认的高效、安全的杀菌消毒剂。工业上制备
)是国际上公认的高效、安全的杀菌消毒剂。工业上制备 的反应原理常采用:
的反应原理常采用: 。
。
①浓盐酸在反应中显示出来的性质是_______ (填序号)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol ,则转移电子数约为
,则转移电子数约为_______ 。
(1)配平下列反应,并用双线桥标明电子转移方向和数目
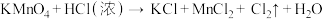
(2)
 是一种新的消毒剂,工业上可用
是一种新的消毒剂,工业上可用 氧化
氧化 溶液制取
溶液制取 ,写出该反应的化学方程式
,写出该反应的化学方程式(3)二氧化氯(
 )是国际上公认的高效、安全的杀菌消毒剂。工业上制备
)是国际上公认的高效、安全的杀菌消毒剂。工业上制备 的反应原理常采用:
的反应原理常采用: 。
。①浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1mol
 ,则转移电子数约为
,则转移电子数约为
您最近一年使用:0次
2023-10-08更新
|
31次组卷
|
2卷引用:江苏省无锡市南菁高级中学2023-2024学年高一上学期9月阶段性检测化学试题
名校
解题方法
9 . 废水中氨氮(NH3、NH )的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
)的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
(1)氨氮污水直接排放入河流、湖泊导致的环境问题是_____ 。
(2)生物脱氮法:利用微生物脱氮,原理如下:



 N2
N2
反应①的离子方程式为_____ 。
(3)化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液, 转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是
转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是_____ (用离子方程式表示)。
(4)折点加氯法:向废水中加入NaClO溶液,使氨氮氧化成N2,相关反应如下:
NaClO+H2O=HClO+NaOH(Ⅰ);
NH3+HClO=NH2Cl+H2O(Ⅱ);
NH2Cl+HClO=NHCl2+H2O(Ⅲ);
NHCl2+H2O=NOH+2HCl(Ⅳ);
NHCl2+NOH=N2↑+HClO+HCl(Ⅴ)。
探究NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。

①当m(Cl2)∶m(NH3)≥7.7时,污水中总氮去除率缓慢下降,其原因是_____ 。
②当m(Cl2)∶m(NH3)<7.7时,随着m(Cl2)∶m(NH3)的减小,污水中余氯(除Cl-外的氯元素存在形式)浓度升高,其原因是_____ 。
 )的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
)的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。(1)氨氮污水直接排放入河流、湖泊导致的环境问题是
(2)生物脱氮法:利用微生物脱氮,原理如下:



 N2
N2反应①的离子方程式为
(3)化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,
 转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是
转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是(4)折点加氯法:向废水中加入NaClO溶液,使氨氮氧化成N2,相关反应如下:
NaClO+H2O=HClO+NaOH(Ⅰ);
NH3+HClO=NH2Cl+H2O(Ⅱ);
NH2Cl+HClO=NHCl2+H2O(Ⅲ);
NHCl2+H2O=NOH+2HCl(Ⅳ);
NHCl2+NOH=N2↑+HClO+HCl(Ⅴ)。
探究NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。

①当m(Cl2)∶m(NH3)≥7.7时,污水中总氮去除率缓慢下降,其原因是
②当m(Cl2)∶m(NH3)<7.7时,随着m(Cl2)∶m(NH3)的减小,污水中余氯(除Cl-外的氯元素存在形式)浓度升高,其原因是
您最近一年使用:0次
名校
10 . 硫和氮及其化合物在生产生活中应用广泛,含氮氧化物和硫氧化物的尾气需处理后才能排放。请回答下列问题:
(1)稀硫酸、稀硝酸与铜粉反应制胆矾晶体,过程中生成一种无色气体,该气体是_____ (填化学式),制得的胆矾晶体中可能存在的杂质是_____  填名称
填名称 。
。
(2)Na2SO3是实验室重要的常见药品,有一瓶放置了很久,小明同学想设计一个实验验证这瓶药品是否变质。请你帮助他设计一个实验_____ 。
(3)一种NH3催化还原NO的物质转化如图所示。若参与反应的NH3和O2物质的量之比为4∶1,写出转化时总反应的化学方程式:_____ 。

(4)利用氨水可以将SO2和NO2吸收,原理如图所示:

NO2被吸收的离子方程式是_____ 。
(5)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO 。其他条件相同,NO转化为NO
。其他条件相同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是_____ 。

(1)稀硫酸、稀硝酸与铜粉反应制胆矾晶体,过程中生成一种无色气体,该气体是
 填名称
填名称 。
。(2)Na2SO3是实验室重要的常见药品,有一瓶放置了很久,小明同学想设计一个实验验证这瓶药品是否变质。请你帮助他设计一个实验
(3)一种NH3催化还原NO的物质转化如图所示。若参与反应的NH3和O2物质的量之比为4∶1,写出转化时总反应的化学方程式:

(4)利用氨水可以将SO2和NO2吸收,原理如图所示:

NO2被吸收的离子方程式是
(5)在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO
 。其他条件相同,NO转化为NO
。其他条件相同,NO转化为NO 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次
2023-04-23更新
|
316次组卷
|
2卷引用:江苏省江阴市四校联考2022-2023学年高一下学期4月期中测试化学试题



