解题方法
1 . 含有氮氧化物(NO、NO2)的尾气和含有氨氮(NH3、 )的废水需处理后才能排放。
)的废水需处理后才能排放。
(1)氨氮污水直接排放入河流、湖泊导致的环境问题是_______ 。
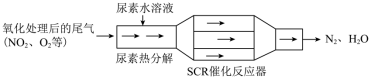
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:_______ 。
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。
② 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是_______ 。
(4)向含氨氮(NH3、 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。_______ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+_______ +2H2O。
 )的废水需处理后才能排放。
)的废水需处理后才能排放。(1)氨氮污水直接排放入河流、湖泊导致的环境问题是
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 时发生反应的离子方程式为
时发生反应的离子方程式为②
 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是(4)向含氨氮(NH3、
 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。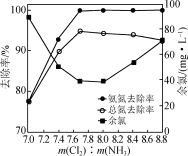
(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+
您最近一年使用:0次
名校
解题方法
2 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入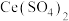 与
与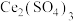 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=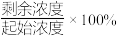 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。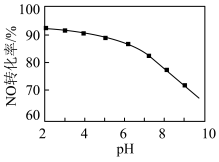
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入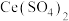 与
与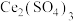 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。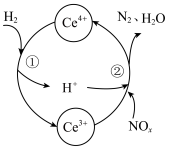
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=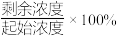 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是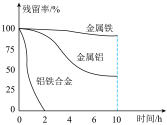
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为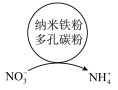
您最近一年使用:0次
2024-05-06更新
|
181次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
解题方法
3 . 已知氮元素及其化合物的转化关系如下图所示,回答下列问题。_______ 。
(2)反应④的离子方程式为_______ 。理论上如图N2合成1mol硝酸,至少需要氧气共_______ mol。
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为_______ 。
①根据上图得知_______ (填字母)。
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是_______ 。

(2)反应④的离子方程式为
(3)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示,该过程的总反应化学方程式为
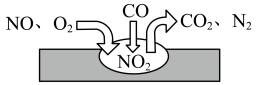

①根据上图得知
A.NaOH溶液浓度越大,氮氧化物的吸收率越大
B.NO2含量越大,氮氧化物的吸收率越大
②当α小于50%时,加入H2O2能提升氮氧化物的吸收率,原因是
您最近一年使用:0次
名校
解题方法
4 . 工业废水中的氨氮(以 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。
① 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
② 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)次氯酸钠氧化法:向氨氮废水中加入 ,氨氮转化为
,氨氮转化为 而除去。
而除去。
① 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
②一定 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。 :
: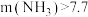 时,总氮的去除率随
时,总氮的去除率随 :
: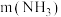 的增大不升反降的原因是
的增大不升反降的原因是_______ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,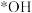 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。_______ 。
②其它条件不变调节废水的 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是_______ 。 晶体进行纯度测定:
晶体进行纯度测定:
a.称取 样品,将其配成
样品,将其配成 溶液。
溶液。
b.先向锥形瓶内加入一定浓度的 溶液,加热至
溶液,加热至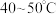 。冷却后再向其中加入
。冷却后再向其中加入
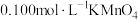 溶液,充分混合。
溶液,充分混合。
c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液 。
。
(NaNO2与 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)
通过计算,该样品中 的质量分数是
的质量分数是_______ 。(写出计算过程)
 形式存在),可通过微生物法或氧化法处理,转化为
形式存在),可通过微生物法或氧化法处理,转化为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 或
或 或
或 再与
再与 作用生成
作用生成 。
。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为
在转化为 的反应中消耗
的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入
 ,氨氮转化为
,氨氮转化为 而除去。
而除去。①
 氧化
氧化 的离子方程式为
的离子方程式为②一定
 下,
下, 的投加量对污水中氨氮去除率的影响如图所示。
的投加量对污水中氨氮去除率的影响如图所示。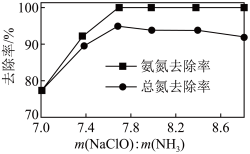
 :
: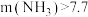 时,总氮的去除率随
时,总氮的去除率随 :
: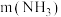 的增大不升反降的原因是
的增大不升反降的原因是(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,
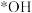 为羟基自由基,其氧化性比
为羟基自由基,其氧化性比 更强。
更强。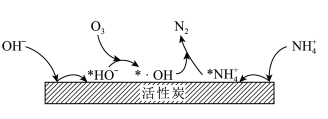
②其它条件不变调节废水的
 ,废水中氨氮去除率随
,废水中氨氮去除率随 的变化如下图所示。随
的变化如下图所示。随 增大氨氮去除率先明显增大,后变化较小,可能的原因是
增大氨氮去除率先明显增大,后变化较小,可能的原因是
 晶体进行纯度测定:
晶体进行纯度测定:a.称取
 样品,将其配成
样品,将其配成 溶液。
溶液。b.先向锥形瓶内加入一定浓度的
 溶液,加热至
溶液,加热至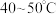 。冷却后再向其中加入
。冷却后再向其中加入
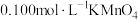 溶液,充分混合。
溶液,充分混合。c.最后用待测的样品溶液与之恰好完全反应,消耗样品溶液
 。
。(NaNO2与
 反应的关系式为:2KMnO4~5NaNO2)
反应的关系式为:2KMnO4~5NaNO2)通过计算,该样品中
 的质量分数是
的质量分数是
您最近一年使用:0次
解题方法
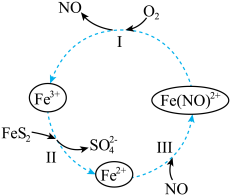
5 . 在酸性条件下,黄铁矿( ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
总反应:
(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:_______ 。
②反应Ⅱ:_______ 。
(2)NO在总反应中的作用是_______ 。
 ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
总反应:

(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
您最近一年使用:0次
解题方法
6 . 自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。
(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。 的结构式为
的结构式为___________ 。 与
与 和
和 溶液反应转化为
溶液反应转化为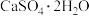 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为___________  。
。
(2)工业上利用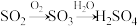 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。___________ (写出两点)。
②装置Ⅲ用于吸收 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是___________ (填字母)。
A. 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸
③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是___________ 。若用 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将___________ (填“增大”“减小”或“不变”)。
(3) 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。___________ 。
(4) 的“再生”是在
的“再生”是在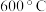 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是___________ 。
 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。
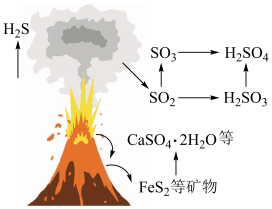
 的结构式为
的结构式为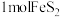 与
与 和
和 溶液反应转化为
溶液反应转化为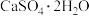 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为 。
。(2)工业上利用
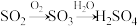 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。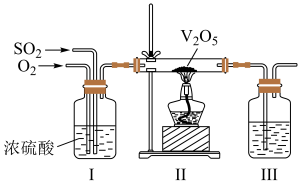
②装置Ⅲ用于吸收
 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是A.
 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是
 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将(3)
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。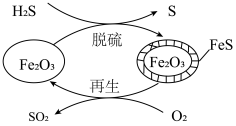
(4)
 的“再生”是在
的“再生”是在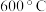 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是
您最近一年使用:0次
2024-02-04更新
|
567次组卷
|
2卷引用:江苏省扬州市2023-2024学年高一上学期1月期末考试化学试题
7 .  是实验室的常用试剂,可以由
是实验室的常用试剂,可以由 为原料经过多步反应制得。
为原料经过多步反应制得。
(1) 与KOH在空气中熔融可以制得
与KOH在空气中熔融可以制得 。该反应的方程式为:
。该反应的方程式为:
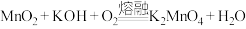 (未配平)
(未配平)
①该反应的还原剂为______ 。
②反应中每生成1 mol ,转移电子的物质的量为
,转移电子的物质的量为______ 。
③配平后的反应方程式中 前的化学计量数为
前的化学计量数为______ 。
(2)将制得的 固体溶于水,向其中通入
固体溶于水,向其中通入 .会发生如下反应:
.会发生如下反应:
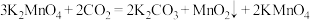 ;
;
用单线桥表示该反应中电子转移的方向和数目:______ 。
(3) 时,向
时,向 的溶液中滴加
的溶液中滴加 溶液,反应后Mn元素均转化为
溶液,反应后Mn元素均转化为 沉淀。
沉淀。
由此可知酸性条件下粒子的氧化性大小:______ >______ 。
(4)磷酸锰铵是重要的复盐,在工农业生产中具有广泛应用。实验室为了测定磷酸锰铵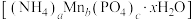 的组成,进行如下实验:①称取样品2.4480g,加水溶解后配成100.00mL溶液A;②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成(标准状况下)0.06720 L
的组成,进行如下实验:①称取样品2.4480g,加水溶解后配成100.00mL溶液A;②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成(标准状况下)0.06720 L  ;③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中
;③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中 转化为
转化为 ,得
,得 0.2290 g。通过计算确定该样品的化学式
0.2290 g。通过计算确定该样品的化学式____ (写出计算过程)。
 是实验室的常用试剂,可以由
是实验室的常用试剂,可以由 为原料经过多步反应制得。
为原料经过多步反应制得。(1)
 与KOH在空气中熔融可以制得
与KOH在空气中熔融可以制得 。该反应的方程式为:
。该反应的方程式为: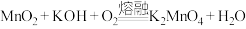 (未配平)
(未配平)①该反应的还原剂为
②反应中每生成1 mol
 ,转移电子的物质的量为
,转移电子的物质的量为③配平后的反应方程式中
 前的化学计量数为
前的化学计量数为(2)将制得的
 固体溶于水,向其中通入
固体溶于水,向其中通入 .会发生如下反应:
.会发生如下反应: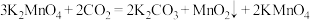 ;
;用单线桥表示该反应中电子转移的方向和数目:
(3)
 时,向
时,向 的溶液中滴加
的溶液中滴加 溶液,反应后Mn元素均转化为
溶液,反应后Mn元素均转化为 沉淀。
沉淀。由此可知酸性条件下粒子的氧化性大小:
(4)磷酸锰铵是重要的复盐,在工农业生产中具有广泛应用。实验室为了测定磷酸锰铵
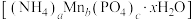 的组成,进行如下实验:①称取样品2.4480g,加水溶解后配成100.00mL溶液A;②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成(标准状况下)0.06720 L
的组成,进行如下实验:①称取样品2.4480g,加水溶解后配成100.00mL溶液A;②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成(标准状况下)0.06720 L  ;③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中
;③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中 转化为
转化为 ,得
,得 0.2290 g。通过计算确定该样品的化学式
0.2290 g。通过计算确定该样品的化学式
您最近一年使用:0次
名校
8 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图:
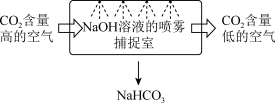
①在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________ ,发生的离子方程式为___________ ;
②若将NaHCO3溶液进行处理,从而实现NaOH溶液的循环利用,可采取的措施为___________ 。
③下列溶液中,同样能用于“捕捉”二氧化碳的是___________ (填序号)。
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
(2)科学家提出用FeO作催化剂,利用太阳能热化学循环分解CO2制取C。用FeO作催化剂,通过两步反应分解CO2制取C。已知第二步反应为: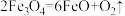 ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
(3)《JournalofEnergyChemistry》杂志报道我国科学家设计的CO2熔盐捕获与转化电解装置如图所示。以下说法正确的是___________ (填序号)。

A.电解总反应为CO2 C+O2
C+O2
B.①②中捕获CO2时碳元素化合价发生了变化
C.转移1mol电子理论上可捕获CO25.6L
(4)科研人员发现CO2捕获和转化还可以通过如下途径实现,其原理如图所示。
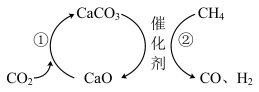
请写出过程②的化学方程式___________ 。
(1)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图:

①在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了
②若将NaHCO3溶液进行处理,从而实现NaOH溶液的循环利用,可采取的措施为
③下列溶液中,同样能用于“捕捉”二氧化碳的是
A.KNO3溶液 B.CaCl2溶液 C.CuSO4溶液 D.Na2CO3溶液
(2)科学家提出用FeO作催化剂,利用太阳能热化学循环分解CO2制取C。用FeO作催化剂,通过两步反应分解CO2制取C。已知第二步反应为:
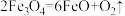 ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)《JournalofEnergyChemistry》杂志报道我国科学家设计的CO2熔盐捕获与转化电解装置如图所示。以下说法正确的是

A.电解总反应为CO2
 C+O2
C+O2B.①②中捕获CO2时碳元素化合价发生了变化
C.转移1mol电子理论上可捕获CO25.6L
(4)科研人员发现CO2捕获和转化还可以通过如下途径实现,其原理如图所示。

请写出过程②的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 含铬废水中通常含有Cr(Ⅵ),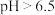 时主要以
时主要以 形式存在,
形式存在,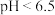 时主要以
时主要以 、
、 形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
(1)酸性条件下,加入 溶液能将Cr(Ⅵ)还原为
溶液能将Cr(Ⅵ)还原为 ,再加碱沉淀出
,再加碱沉淀出 。
。 将
将 还原为
还原为 的离子方程式为
的离子方程式为___________ 。
(2)将含Cr(Ⅵ)废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的 ,将Cr(Ⅵ)还原为
,将Cr(Ⅵ)还原为 ,并生成
,并生成 和
和 。
。
①加入NaCl固体的目的是___________ 。
②电解过程中能生成 和
和 的原因是
的原因是___________ 。
③上述电解过程不能用石墨电极取代铁电极的原因是___________ 。
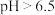 时主要以
时主要以 形式存在,
形式存在,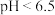 时主要以
时主要以 、
、 形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。(1)酸性条件下,加入
 溶液能将Cr(Ⅵ)还原为
溶液能将Cr(Ⅵ)还原为 ,再加碱沉淀出
,再加碱沉淀出 。
。 将
将 还原为
还原为 的离子方程式为
的离子方程式为(2)将含Cr(Ⅵ)废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的
 ,将Cr(Ⅵ)还原为
,将Cr(Ⅵ)还原为 ,并生成
,并生成 和
和 。
。①加入NaCl固体的目的是
②电解过程中能生成
 和
和 的原因是
的原因是③上述电解过程不能用石墨电极取代铁电极的原因是
您最近一年使用:0次
名校
10 . 工厂烟气(主要污染物有SO2、NO)直接排放会造成空气污染,水溶性硝态氮(NO 、NO
、NO 等)是水体污染物,需要处理才能排放。
等)是水体污染物,需要处理才能排放。
(1)CO(NH2)2溶液脱硫的反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2(该反应为非氧化还原反应)。若吸收烟气时通入少量ClO2,可同时实现脱硫、脱硝。脱硝的反应分为两步。
第一步:5NO+2ClO2+H2O=5NO2+2HCl
第二步:NO2和CO(NH2)2反应生成N2、CO2和水。
请写出第二步反应的化学方程式为__ 。
(2)“纳米零价铁—H2O2”体系可将烟气中难溶的NO氧化为可溶的NO 。
。
在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①NO与H2O2反应生成HNO3的化学方程式为__ 。
②Fe2+催化H2O2分解产生HO•,HO•将NO氧化为NO 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为__ 。

③通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示。已知O2-可在固体电解质中自由移动。NiO电极上的电极反应式为__ 。

(3)纳米铁粉可用于去除废水中的硝态氮(以NO 表示)可大致分为2个过程,反应原理如图所示。
表示)可大致分为2个过程,反应原理如图所示。
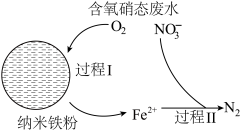
①有研究发现,在铁粉总量一定的条件下,水中的溶解氧过少或过多均不利于硝态氮去除。若水中的溶解氧过少,硝态氮去除率下降的原因是__ 。
②利用纳米铁粉与活性炭混合物可提升硝态废水中硝态氮的去除效率,可能原因是__ 。
 、NO
、NO 等)是水体污染物,需要处理才能排放。
等)是水体污染物,需要处理才能排放。(1)CO(NH2)2溶液脱硫的反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2(该反应为非氧化还原反应)。若吸收烟气时通入少量ClO2,可同时实现脱硫、脱硝。脱硝的反应分为两步。
第一步:5NO+2ClO2+H2O=5NO2+2HCl
第二步:NO2和CO(NH2)2反应生成N2、CO2和水。
请写出第二步反应的化学方程式为
(2)“纳米零价铁—H2O2”体系可将烟气中难溶的NO氧化为可溶的NO
 。
。在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
①NO与H2O2反应生成HNO3的化学方程式为
②Fe2+催化H2O2分解产生HO•,HO•将NO氧化为NO
 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为
③通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示。已知O2-可在固体电解质中自由移动。NiO电极上的电极反应式为

(3)纳米铁粉可用于去除废水中的硝态氮(以NO
 表示)可大致分为2个过程,反应原理如图所示。
表示)可大致分为2个过程,反应原理如图所示。
①有研究发现,在铁粉总量一定的条件下,水中的溶解氧过少或过多均不利于硝态氮去除。若水中的溶解氧过少,硝态氮去除率下降的原因是
②利用纳米铁粉与活性炭混合物可提升硝态废水中硝态氮的去除效率,可能原因是
您最近一年使用:0次
2023-04-22更新
|
297次组卷
|
2卷引用:江苏省扬州市邗江区2022-2023学年高一下学期期中调研测试化学试题



