1 . 赤铜矿(主要成分为 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为:
(1) 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、_______ 。_______ 。 发生反应的离子方程式为
发生反应的离子方程式为_______ 。检验氧化完全的试剂为_______ (填化学式)。
(4)沉铁。离子浓度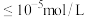 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为_______ 。
(5)试从产率、试剂选择角度评价该制备流程并提出修改建议_______ 。
 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为:

(1)
 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、

 发生反应的离子方程式为
发生反应的离子方程式为(4)沉铁。离子浓度
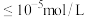 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为(5)试从产率、试剂选择角度评价该制备流程并提出修改建议
您最近一年使用:0次
2 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为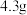 。
。
②乙二胺四乙酸( ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为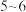 发生反应:
发生反应: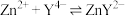 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为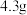 。
。②乙二胺四乙酸(
 ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为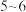 发生反应:
发生反应: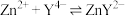 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
3 . 处理工业废气中的 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中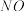 和
和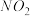 去除率的有
去除率的有_______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
②吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是_______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: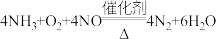 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为_______ 。
(3)氧化吸收法。
① 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
② 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
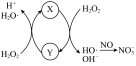
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式:_______ ; 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是_______ 。
 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中
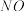 和
和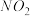 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液②吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为(3)氧化吸收法。
①
 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②
 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式: 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是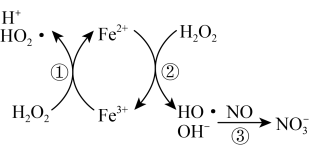
您最近一年使用:0次
名校
4 . 许多含氮物质会造成环境污染,硝酸工业的尾气(含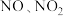 )会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮(
)会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮( 和
和 )会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。
)会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。
(1)废气中氮氧化物的吸收。
①在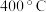 左右且有催化剂存在的情况下,
左右且有催化剂存在的情况下, 能把
能把 还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为
还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为___________ 。
②碱液吸收法。该工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),得到的滤渣可循环使用,该滤渣的主要成分是___________ (填化学式)。工艺需控制 和
和 的物质的量之比接近
的物质的量之比接近___________ ,若小于这个比值,则会导致___________ 。
 溶液也可以吸收氮氧化物,写出
溶液也可以吸收氮氧化物,写出 溶液吸收
溶液吸收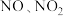 混合气体得到亚硝酸钠的化学方程式
混合气体得到亚硝酸钠的化学方程式___________ 。
(2)废水中过量的氨氮(如 和
和 )处理,科研小组用
)处理,科研小组用 氧化法处理氨氮废水。
氧化法处理氨氮废水。
已知:
A. 的氧化性比
的氧化性比 强;
强;
B. 比
比 更易被氧化;
更易被氧化;
C.国家标准要求经处理过的氨氨废水 要控制在
要控制在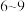 。
。
进水 对氨氨去除率的影响如下图所示。
对氨氨去除率的影响如下图所示。 为
为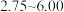 范围内,氨氮去除率随
范围内,氨氮去除率随 升高而上升的原因是
升高而上升的原因是___________ 。
写出酸性条件下 氧化
氧化 的离子方程式:
的离子方程式:___________ 。
已知:a. 的氧化性比
的氧化性比 弱;b.
弱;b. 氧化氨氮的速率比
氧化氨氮的速率比 小。
小。
在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率___________ (填“显著变大”“显著变小”或“几乎不变”)。
(3)微生物脱氮氯法: 。
。
写出酸性条件下步骤a的离子方程式:___________ 。
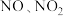 )会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮(
)会造成大气污染,通常用选择性非催化还原法或碱液吸收法。而废水中过量的氨氮( 和
和 )会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。
)会导致水体富营养化,则通常用强氧化剂或微生物法来吸收。(1)废气中氮氧化物的吸收。
①在
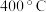 左右且有催化剂存在的情况下,
左右且有催化剂存在的情况下, 能把
能把 还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为
还原成无色无毒气体直接排入空气中,则发生反应的化学方程式为②碱液吸收法。该工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),得到的滤渣可循环使用,该滤渣的主要成分是
 和
和 的物质的量之比接近
的物质的量之比接近 溶液也可以吸收氮氧化物,写出
溶液也可以吸收氮氧化物,写出 溶液吸收
溶液吸收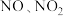 混合气体得到亚硝酸钠的化学方程式
混合气体得到亚硝酸钠的化学方程式(2)废水中过量的氨氮(如
 和
和 )处理,科研小组用
)处理,科研小组用 氧化法处理氨氮废水。
氧化法处理氨氮废水。已知:
A.
 的氧化性比
的氧化性比 强;
强;B.
 比
比 更易被氧化;
更易被氧化;C.国家标准要求经处理过的氨氨废水
 要控制在
要控制在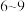 。
。进水
 对氨氨去除率的影响如下图所示。
对氨氨去除率的影响如下图所示。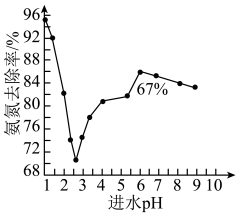
 为
为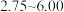 范围内,氨氮去除率随
范围内,氨氮去除率随 升高而上升的原因是
升高而上升的原因是写出酸性条件下
 氧化
氧化 的离子方程式:
的离子方程式:已知:a.
 的氧化性比
的氧化性比 弱;b.
弱;b. 氧化氨氮的速率比
氧化氨氮的速率比 小。
小。在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率
(3)微生物脱氮氯法:
 。
。写出酸性条件下步骤a的离子方程式:
您最近一年使用:0次
解题方法
5 . 水合肼 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
(1)肼分解制氢的主要反应为 ,肼的理论储氢密度
,肼的理论储氢密度 。测得肼实际分解时产生的气体中含
。测得肼实际分解时产生的气体中含 ,肼实际储氢密度小于理论值的原因是
,肼实际储氢密度小于理论值的原因是__________ (用化学方程式表示)。
(2)水合肼制氢过程中涉及肼在 催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
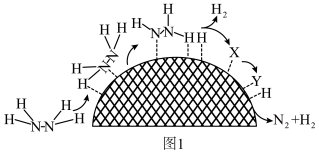
①X的结构简式为__________ 。
②催化剂表面存在 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于__________ (填 或
或 )活性位点。已知:断开
)活性位点。已知:断开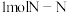 键需要吸收
键需要吸收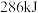 能量,断开
能量,断开 键需要吸收
键需要吸收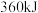 能量。肼在该催化剂表面反应断裂的化学键不是
能量。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是__________ 。
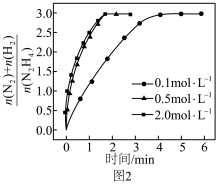
③催化剂存在下,不同浓度的 分解时,测得
分解时,测得 随时间的变化如题图2所示。当
随时间的变化如题图2所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变,其原因是
时,反应速率几乎不变,其原因是__________ 。
 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。(1)肼分解制氢的主要反应为
 ,肼的理论储氢密度
,肼的理论储氢密度 。测得肼实际分解时产生的气体中含
。测得肼实际分解时产生的气体中含 ,肼实际储氢密度小于理论值的原因是
,肼实际储氢密度小于理论值的原因是(2)水合肼制氢过程中涉及肼在
 催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
催化剂表面分解,如题图1所示。已知催化剂中起作用的部分并不是整个催化剂表面,而是一些特定的位点。
①X的结构简式为
②催化剂表面存在
 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于 或
或 )活性位点。已知:断开
)活性位点。已知:断开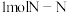 键需要吸收
键需要吸收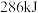 能量,断开
能量,断开 键需要吸收
键需要吸收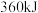 能量。肼在该催化剂表面反应断裂的化学键不是
能量。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是③催化剂存在下,不同浓度的
 分解时,测得
分解时,测得 随时间的变化如题图2所示。当
随时间的变化如题图2所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变,其原因是
时,反应速率几乎不变,其原因是
您最近一年使用:0次
名校
6 . 含氨污染物治理及其回收利用是重要课题。
(1)用碱液脱硝是目前研究的课题之一。将 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制
。该工艺需控制 和
和 物质的量之比接近
物质的量之比接近 。若
。若 ,则会导致
,则会导致___________ 。若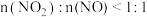 ,则会导致
,则会导致___________ 。
(2)用尿素 (N元素为
(N元素为 价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与
价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与 反应转化成无毒气体,该反应的化学方程式:
反应转化成无毒气体,该反应的化学方程式:___________ 。
(3)工业上在催化剂作用下用 还原工业废气中所含少量
还原工业废气中所含少量 生成
生成 和
和 达到脱除目的,但当温度高于
达到脱除目的,但当温度高于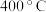 时,
时, 脱除率下降,原因可能是
脱除率下降,原因可能是___________ 。
(4)用纳米铁粉处理废水中的 :
:
①酸性条件下,纳米铁粉与废水中 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是___________ 。
②研究发现,废水中溶解氧会对 的去除产生一定影响。在初始
的去除产生一定影响。在初始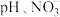 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下
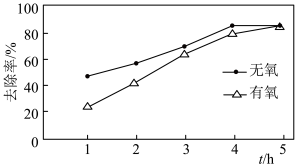
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下 的去除率随反应时间的变化如图所示。
的去除率随反应时间的变化如图所示。 时,有氧条件下
时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是___________ 。
(5)将 铜与
铜与 一定浓度的硝酸反应,铜完全溶解,产生的气体为
一定浓度的硝酸反应,铜完全溶解,产生的气体为 和
和 混合气体,其在标准状况下的体积为
混合气体,其在标准状况下的体积为 ,则混合气体中
,则混合气体中 的体积为
的体积为___________ 。(写出计算过程)
(1)用碱液脱硝是目前研究的课题之一。将
 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制
。该工艺需控制 和
和 物质的量之比接近
物质的量之比接近 。若
。若 ,则会导致
,则会导致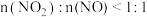 ,则会导致
,则会导致(2)用尿素
 (N元素为
(N元素为 价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与
价)吸收氮氧化物是一种可行的方法。尿素在高温条存下与 反应转化成无毒气体,该反应的化学方程式:
反应转化成无毒气体,该反应的化学方程式:(3)工业上在催化剂作用下用
 还原工业废气中所含少量
还原工业废气中所含少量 生成
生成 和
和 达到脱除目的,但当温度高于
达到脱除目的,但当温度高于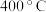 时,
时, 脱除率下降,原因可能是
脱除率下降,原因可能是(4)用纳米铁粉处理废水中的
 :
:①酸性条件下,纳米铁粉与废水中
 反应生成
反应生成 与
与 ,其反应的离子方程式是
,其反应的离子方程式是②研究发现,废水中溶解氧会对
 的去除产生一定影响。在初始
的去除产生一定影响。在初始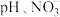 初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下
初始浓度、纳米铁粉与硝酸盐质量比均一定的条件下,有氧与无氧条作下 的去除率随反应时间的变化如图所示。
的去除率随反应时间的变化如图所示。 时,有氧条件下
时,有氧条件下 去除率低于无氧条件下,其可能的原因是
去除率低于无氧条件下,其可能的原因是
(5)将
 铜与
铜与 一定浓度的硝酸反应,铜完全溶解,产生的气体为
一定浓度的硝酸反应,铜完全溶解,产生的气体为 和
和 混合气体,其在标准状况下的体积为
混合气体,其在标准状况下的体积为 ,则混合气体中
,则混合气体中 的体积为
的体积为
您最近一年使用:0次
名校
7 . 工业或机动车尾气中的 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。
(1)碱液吸收:石灰乳可吸收硝酸工业的尾气(含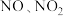 ),获得副产品
),获得副产品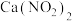 。
。
①等物质的量 与
与 被
被 吸收,反应的化学方程式为
吸收,反应的化学方程式为___________ 。
②下列措施能提高尾气中 和
和 去除率的有
去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
③该工艺需控制 和
和 的物质的量之比接近
的物质的量之比接近 ,若
,若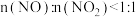 ,则会导致
,则会导致___________ ;若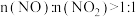 ,则会导致
,则会导致___________ 。
④生产中需保持弱碱性,在酸性溶液中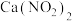 会发生分解,产物之一是
会发生分解,产物之一是 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(2)还原法:尿素水溶液热解产生的氨气发生催化反应可去除尾气中的 。
。 与
与 转化生成
转化生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
(3)氯化法:“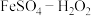 ”试剂可将
”试剂可将 氧化为可溶的
氧化为可溶的 。
。 催化
催化 分解产生有很强的氧化性的
分解产生有很强的氧化性的 ,
, 将
将 氧化为
氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为___________ 。
 会造成环境问题,可用多种方法脱除。
会造成环境问题,可用多种方法脱除。(1)碱液吸收:石灰乳可吸收硝酸工业的尾气(含
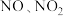 ),获得副产品
),获得副产品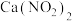 。
。①等物质的量
 与
与 被
被 吸收,反应的化学方程式为
吸收,反应的化学方程式为②下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液③该工艺需控制
 和
和 的物质的量之比接近
的物质的量之比接近 ,若
,若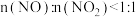 ,则会导致
,则会导致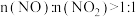 ,则会导致
,则会导致④生产中需保持弱碱性,在酸性溶液中
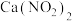 会发生分解,产物之一是
会发生分解,产物之一是 ,其反应的离子方程式为
,其反应的离子方程式为(2)还原法:尿素水溶液热解产生的氨气发生催化反应可去除尾气中的
 。
。 与
与 转化生成
转化生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。(3)氯化法:“
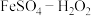 ”试剂可将
”试剂可将 氧化为可溶的
氧化为可溶的 。
。 催化
催化 分解产生有很强的氧化性的
分解产生有很强的氧化性的 ,
, 将
将 氧化为
氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为
您最近一年使用:0次
名校
8 . 有效去除大气和水体中的氮氧化物是环境保护的重要课题。
(1)某学者使用 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。
①通入 的目的是
的目的是________ 。
②若不通入 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是_____ 。
(2)含氯化合物可将废气中的 转化成
转化成 脱除。
脱除。
①提高废气中 脱除率的可行措施有
脱除率的可行措施有______ (填字母)。
A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL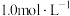
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是______ 。
③按一定流速将含 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是______ 。
(3)有人研究了用纳米零价铁去除水体中 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是_______ 。

(1)某学者使用
 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。①通入
 的目的是
的目的是②若不通入
 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是(2)含氯化合物可将废气中的
 转化成
转化成 脱除。
脱除。①提高废气中
 脱除率的可行措施有
脱除率的可行措施有A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL
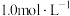
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是③按一定流速将含
 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是(3)有人研究了用纳米零价铁去除水体中
 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是
您最近一年使用:0次
2024-02-16更新
|
133次组卷
|
2卷引用:11.2024年苏州木渎高级中学高一3月月考
9 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用 溶液实现“碳捕获”的技术的装置如图:
溶液实现“碳捕获”的技术的装置如图:
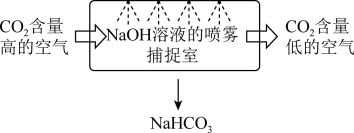
①在整个“捕捉”过程中,发生的离子反应方程式_______ ,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为________ 。
②下列溶液中,同样能用于“捕捉”二氧化碳的是_________ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(2)科学家提出用 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C.用
制取C.用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C.已知第二步反应为:
制取C.已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原 制
制 。则每生成
。则每生成 (标准状况下)
(标准状况下) 的过程中电子转移的物质的量为
的过程中电子转移的物质的量为___________ 。
(4)科研人员发现 捕获和转化还可以通过如下途径实现,其原理如图所示。
捕获和转化还可以通过如下途径实现,其原理如图所示。
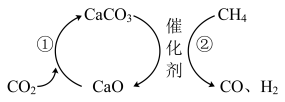
请用必要的化学用语和文字描述上述捕获和转化过程:___________ 。
(1)某校科研人员利用
 溶液实现“碳捕获”的技术的装置如图:
溶液实现“碳捕获”的技术的装置如图:
①在整个“捕捉”过程中,发生的离子反应方程式
 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为②下列溶液中,同样能用于“捕捉”二氧化碳的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(2)科学家提出用
 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C.用
制取C.用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C.已知第二步反应为:
制取C.已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原
 制
制 。则每生成
。则每生成 (标准状况下)
(标准状况下) 的过程中电子转移的物质的量为
的过程中电子转移的物质的量为(4)科研人员发现
 捕获和转化还可以通过如下途径实现,其原理如图所示。
捕获和转化还可以通过如下途径实现,其原理如图所示。
请用必要的化学用语和文字描述上述捕获和转化过程:
您最近一年使用:0次
名校
10 . Ⅰ.分类法是进行化学研究的重要方法。不同的标准可以把事物分为不同的类别。现有以下物质:
①固体NaHCO3②Fe③CaCO3④Fe(OH)3胶体⑤熔融的NaHSO4⑥干冰⑦稀盐酸⑧蔗糖
(1)以上物质中属于强电解质的是______ (填序号);
(2)写出①在水溶液中的电离方程式______ ;
(3)④的实验室制备:向沸水中滴加几滴______ 溶液,加热至液体呈红褐色,停止加热。
Ⅱ.空气质量与我们的生活息息相关。SO2是主要的大气污染物之一。
(4)SO2属于______ (填“酸性”或“碱性”)氧化物。
(5)将SO2气体通入蒸馏水中,取部分溶液用pH计测定其pH,每隔10min读数一次,随着时间推移,pH逐渐变小的原因是______ 。(用化学方程式表示)
(6)下列反应中,能用同一离子方程式表示的有______(填序号)。
①固体NaHCO3②Fe③CaCO3④Fe(OH)3胶体⑤熔融的NaHSO4⑥干冰⑦稀盐酸⑧蔗糖
(1)以上物质中属于强电解质的是
(2)写出①在水溶液中的电离方程式
(3)④的实验室制备:向沸水中滴加几滴
Ⅱ.空气质量与我们的生活息息相关。SO2是主要的大气污染物之一。
(4)SO2属于
(5)将SO2气体通入蒸馏水中,取部分溶液用pH计测定其pH,每隔10min读数一次,随着时间推移,pH逐渐变小的原因是
(6)下列反应中,能用同一离子方程式表示的有______(填序号)。
| A.Ca(OH)2和稀CH3COOH | B.NaOH和稀H2SO4 |
| C.Ba(OH)2与稀HNO3 | D.Ba(OH)2与稀H2SO4 |
您最近一年使用:0次



