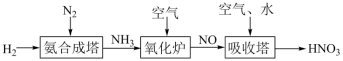
1 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2)氨气在氧化炉中发生反应的化学方程式为___________ 。
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
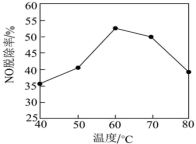
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是___________ 。
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成
 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是
您最近一年使用:0次
解题方法
2 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取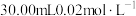 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: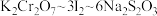 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: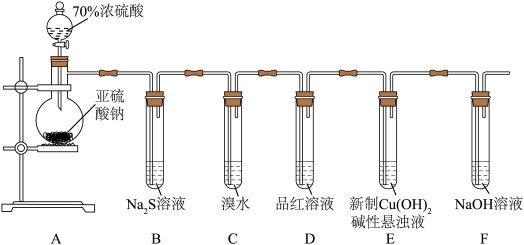
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取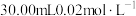 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
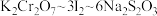 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
解题方法
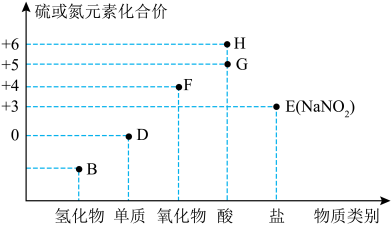
3 . “价—类”二维图是学习元素化合物的一种好方法。硫或氮及其化合物的部分“价—类”二维图如图所示,回答下列问题: ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):_______ 。
(2)若B为 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( ),该反应的化学方程式为
),该反应的化学方程式为_______ ;某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是_______ (填字母)。
A.NaOH B. C.
C. D.浓硫酸
D.浓硫酸
(4)D可以是 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=_____ 。
(5) 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:_______ 。
(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是_______ 。
 ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):(2)若B为
 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。| A.氨气易液化;液氨可用作制冷剂 | B.可用排水法收集氨气 |
| C.氨气是一种无色、无味的气体 | D.向氨水中滴加酚酞,溶液变红 |
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 ),该反应的化学方程式为
),该反应的化学方程式为 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是A.NaOH B.
 C.
C. D.浓硫酸
D.浓硫酸(4)D可以是
 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=(5)
 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是
您最近一年使用:0次
4 . 以软锰矿浆(含 及少量
及少量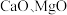 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿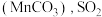 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 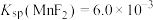 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入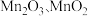 等,其原因是
等,其原因是_______ 。
 及少量
及少量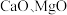 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是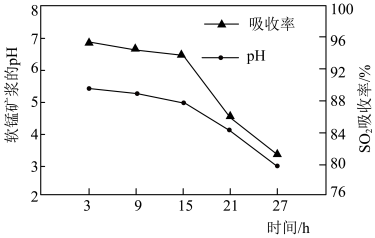
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 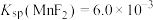 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为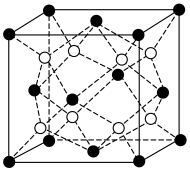
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入 等,其原因是
等,其原因是
您最近一年使用:0次
7日内更新
|
216次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题
名校
解题方法
5 . 回答下列问题
(1)图1记录了1940~2000的60年间 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因______ 。 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:
①工业生产中的 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
碱液吸收法中沙及到的主要反应为: ,
, 。
。
若碱液回收尾气以后,溶液中 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为______ 。
氨还原法是在催化剂作用下,用 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为______ 、______ 。
若在相同条件下消耗的 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为______ 。
②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为______ 。
③结合社会生活中交通工具的变化,你认为 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?______ (请至少例举一条)
(1)图1记录了1940~2000的60年间
 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因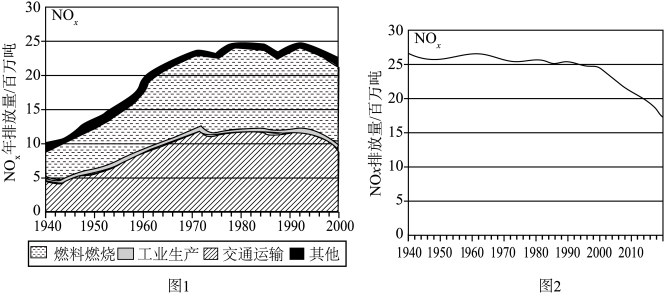
 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:①工业生产中的
 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。碱液吸收法中沙及到的主要反应为:
 ,
, 。
。若碱液回收尾气以后,溶液中
 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为氨还原法是在催化剂作用下,用
 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为若在相同条件下消耗的
 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为
③结合社会生活中交通工具的变化,你认为
 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?
您最近一年使用:0次
6 . 图表、坐标系、转化图等都是化学学科学习中常用的表达形式和工具,是高中生必备的基本技能之一。请大家通过阅读和分析,发现图示背后的化学原理,完成下列各题,并体会和感悟自然科学的研究方法和价值。
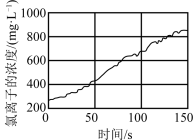
(1)某兴趣小组利用数字化实验测定光照过程中氯水中氯离子的浓度实验结果如图所示,请解释原因是___________ (用化学方程式表示)。 在空气中灼烧,测得灼烧过程中剩余固体的质量与起始
在空气中灼烧,测得灼烧过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时,
的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为___________ (化学式),请写出该反应的化学方程式___________ 。 可用于水体中
可用于水体中 的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得
的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所示。
浓度随反应时间的变化如图所示。 转化为
转化为 ,
, 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②反应相同时间,水体中 浓度随pH增大而降低的原因是
浓度随pH增大而降低的原因是___________ 。
(4)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图所示,在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________ ,如果想要实现NaOH溶液的循环利用,你采取的措施是___________ 。
(1)某兴趣小组利用数字化实验测定光照过程中氯水中氯离子的浓度实验结果如图所示,请解释原因是
 在空气中灼烧,测得灼烧过程中剩余固体的质量与起始
在空气中灼烧,测得灼烧过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时,
的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为
 可用于水体中
可用于水体中 的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得
的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所示。
浓度随反应时间的变化如图所示。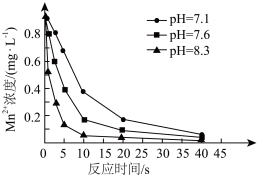
 转化为
转化为 ,
, 转化为
转化为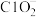 ,该反应的离子方程式为
,该反应的离子方程式为②反应相同时间,水体中
 浓度随pH增大而降低的原因是
浓度随pH增大而降低的原因是(4)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图所示,在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了

您最近一年使用:0次
解题方法
7 . 含有氮氧化物(NO、NO2)的尾气和含有氨氮(NH3、 )的废水需处理后才能排放。
)的废水需处理后才能排放。
(1)氨氮污水直接排放入河流、湖泊导致的环境问题是_______ 。
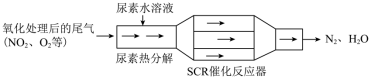
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:_______ 。
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。
② 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是_______ 。
(4)向含氨氮(NH3、 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。_______ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+_______ +2H2O。
 )的废水需处理后才能排放。
)的废水需处理后才能排放。(1)氨氮污水直接排放入河流、湖泊导致的环境问题是
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 时发生反应的离子方程式为
时发生反应的离子方程式为②
 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是(4)向含氨氮(NH3、
 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。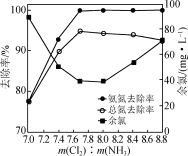
(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+
您最近一年使用:0次
名校
解题方法
8 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入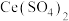 与
与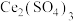 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=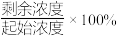 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。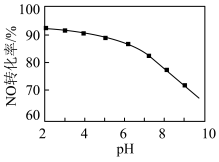
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入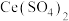 与
与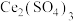 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=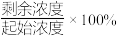 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为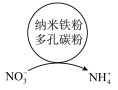
您最近一年使用:0次
2024-05-06更新
|
172次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
9 . 处理工业废气中的 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中 和
和 去除率的有
去除率的有_______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
②吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是_______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: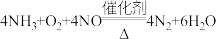 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为_______ 。
(3)氧化吸收法。
① 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
② 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式:_______ ; 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是_______ 。
 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中
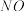 和
和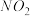 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液②吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为(3)氧化吸收法。
①
 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②
 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式: 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是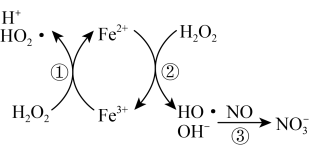
您最近一年使用:0次
解题方法
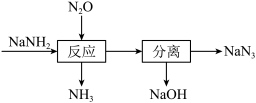
10 . 叠氮化钠(NaN3)可用于汽车安全气囊的产气药。一种由氨基化钠(NaNH2)制备NaN3的工艺流程如图。
①钠元素位于周期表第_____ 周期_____ 族。
②NaNH2中氮元素的化合价为_____ 。
③用单线桥 标出该反应电子转移的方向和数目_____ 。
(2)NaOH的电子式为_____ ,流程中“反应”的化学方程式为_____ 。
(3)NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积为_____ L。
①钠元素位于周期表第
②NaNH2中氮元素的化合价为
③用
(2)NaOH的电子式为
(3)NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积为
您最近一年使用:0次



