名校
1 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
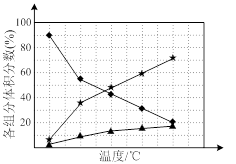
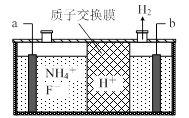
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近一年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
名校
2 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是_______ 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为_______ 。
(3)根据上述反应可推知_________ 。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的计量数填入下列方框中,并标出电子转移的方向和数目。

______________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为
(3)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的计量数填入下列方框中,并标出电子转移的方向和数目。

您最近一年使用:0次
2014-04-11更新
|
391次组卷
|
6卷引用:2014-2015江苏省南通中学高二上学期期末化学(理)试卷
2014-2015江苏省南通中学高二上学期期末化学(理)试卷(已下线)2014年高考化学苏教版总复习 1-4 氧化还原反应练习卷(已下线)2014-2015学年辽宁省沈阳二中高一上学期期中化学试卷2015-2016学年河北冀州市中学高一上第四次月考化学试卷陕西省西安市长安区第一中学2017-2018学年高一上学期期中考试化学试题(已下线)上海市行知中学2014-2015学年高二上学期期中考试化学试题
名校
3 . 储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空(不用配平):C+________ +H2SO4——________ +______ +Cr2(SO4)3+H2O。
(2)上述反应中氧化剂是(填化学式)________ ,被氧化的元素是(填元素符号)________ 。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)________ 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________ 。
(1)请用上述物质填空(不用配平):C+
(2)上述反应中氧化剂是(填化学式)
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
11-12高三上·江苏南通·期中
4 . 近年来,我国研究储氢碳管获得重大进展,用电弧法合成碳纳米管,常伴有大量碳纳米颗粒生成,这种碳纳米颗粒可用氧化气化法除去,其反应的化学方程式为:
C +K2Cr2O7 +H2SO4(稀) → CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
(1)此反应的氧化剂________ ,还原剂___________ ;
(2)硫酸在上述反应中表现出的性质是__________ (填选项编号);
A. 酸性 B. 氧化性 C. 吸水性 D. 脱水性
(3)上述反应若产生11克气体物质,则转移电子的数目__________ 。
C +K2Cr2O7 +H2SO4(稀) → CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
(1)此反应的氧化剂
(2)硫酸在上述反应中表现出的性质是
A. 酸性 B. 氧化性 C. 吸水性 D. 脱水性
(3)上述反应若产生11克气体物质,则转移电子的数目
您最近一年使用:0次
11-12高二上·江苏盐城·期中
5 . 某地有一池塘,生长着丰富的水生植物和多种鱼、虾。后来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:
(1)从生态平衡角度看,池塘这种变化说明了____________________ 。
(2)造成这种变化的原因是__________________________________ 。
(3)经检验,污水中含有0.012mol/L的游离溴,可用亚硫酸钠除去污水中的溴,请写出其化学方程式:__________________________________________ 。
(4)处理10L这种污水需加入0.05mol/L的亚硫酸钠_______ 升才能将溴全部除去。
(5)要使池塘恢复本来面目,首先要解决的问题是______________ ,首先要恢复的生物是______________ 。
(1)从生态平衡角度看,池塘这种变化说明了
(2)造成这种变化的原因是
(3)经检验,污水中含有0.012mol/L的游离溴,可用亚硫酸钠除去污水中的溴,请写出其化学方程式:
(4)处理10L这种污水需加入0.05mol/L的亚硫酸钠
(5)要使池塘恢复本来面目,首先要解决的问题是
您最近一年使用:0次
名校
解题方法
6 . 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为: 8HClO3→ 3O2↑+ 2Cl2↑+ 4HClO4+ 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:___________ →___________ (填化学式)。
(2)该反应的氧化产物是______________ (填化学式);所得混合气体的平均式量为_______ 。
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,有关离子反应方程式为:_____________ 。
(4)在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1升,测得溶液的pH = 2,则在反应中转移电子的物质的量为_______ mol。
(1)在上述变化过程中,发生还原反应的过程是:
(2)该反应的氧化产物是
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,有关离子反应方程式为:
(4)在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1升,测得溶液的pH = 2,则在反应中转移电子的物质的量为
您最近一年使用:0次
9-10高二下·江苏南通·期末
7 . 联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联氨分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是___
A.联氨(N2H4)结构与C2H4相似,存在N=N双键
B. 一分子联氨中含有的电子对数目为5
C. 联氨中的N原子的杂化类型为sp3杂化
D. 联氨能与HCl发生化合反应生成N2H6Cl2
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式___________________ ;
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式______________________ 。
⑴已知联氨分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
A.联氨(N2H4)结构与C2H4相似,存在N=N双键
B. 一分子联氨中含有的电子对数目为5
C. 联氨中的N原子的杂化类型为sp3杂化
D. 联氨能与HCl发生化合反应生成N2H6Cl2
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式
您最近一年使用:0次
2010·江苏扬州·模拟预测
8 . 氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,容易引起爆炸。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为_________ 。
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为________ 。该工艺选择氯气的优点是__________ 。(答一点即可)
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为___________ mol/L。
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4++ 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛bmL于锥形瓶,加入1滴酚酞,用浓度为Cmol/L的NaOH溶液中和,滴定管的初始读数V1mL,当溶液呈微红色时,滴定管的读数V2mL。
②向其中加入饱和食盐水试样amL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3mL。
则饱和食盐水中的含氮量为__________ mg/L。
(1)三氯化氮易水解,其水解的最初产物除生成氨气外,另一产物为
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为10-3 mol/L,则理论上生成的SO42-为
(4)生产和实验中广泛采用甲醛法测定样品的含氮量。甲醛和铵根离子的反应如下:
4NH4++ 6HCHO =(CH2)6N4H+(一元酸)+ 3H+ + 6H2O
实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。可取甲醛bmL于锥形瓶,加入1滴酚酞,用浓度为Cmol/L的NaOH溶液中和,滴定管的初始读数V1mL,当溶液呈微红色时,滴定管的读数V2mL。
②向其中加入饱和食盐水试样amL,静置1分钟。
③再加1~2滴酚酞,再用上述NaOH溶液滴定至微红色,滴定管的读数V3mL。
则饱和食盐水中的含氮量为
您最近一年使用:0次
2010·江苏徐州·三模
9 . 重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为Cr2O3,还含有FeO、A12O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1)Cr2O3在高温焙烧时反应的化学方程式为_____ 。
(2)生产过程中,调节(含Na2CrO4、Na2SiO3、NaAlO2的溶液)pH的目的是_______ 。
(3)某化工厂采用石墨作电极电解Na2CrO4溶液,实现了Na2CrO4转化为Na2Cr2O7的生产,其原理如下图所示。
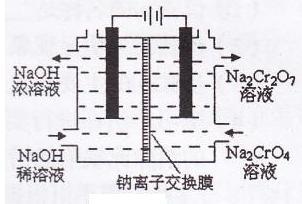
①写出阳极的电极方程式:________ ;
②此生产方法和上述流程相比的优点主要有_____ 。
(4)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的O2的质量)。现有某水样100.00 mL,酸化后加入clmol/L的Na2Cr2O7溶液V1mL,使水中的还原性物质完全被氧化(还原产物为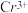 );再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2mL。则该水样的COD为
);再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2mL。则该水样的COD为___ mg/L。

请回答下列问题:
(1)Cr2O3在高温焙烧时反应的化学方程式为
(2)生产过程中,调节(含Na2CrO4、Na2SiO3、NaAlO2的溶液)pH的目的是
(3)某化工厂采用石墨作电极电解Na2CrO4溶液,实现了Na2CrO4转化为Na2Cr2O7的生产,其原理如下图所示。

①写出阳极的电极方程式:
②此生产方法和上述流程相比的优点主要有
(4)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的O2的质量)。现有某水样100.00 mL,酸化后加入clmol/L的Na2Cr2O7溶液V1mL,使水中的还原性物质完全被氧化(还原产物为
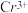 );再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2mL。则该水样的COD为
);再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2mL。则该水样的COD为
您最近一年使用:0次



