1 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为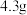 。
。
②乙二胺四乙酸( ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为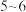 发生反应:
发生反应: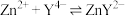 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为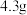 。
。②乙二胺四乙酸(
 ,用
,用 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为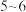 发生反应:
发生反应: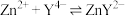 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
2 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2)氨气在氧化炉中发生反应的化学方程式为___________ 。
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
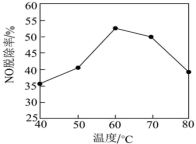
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是___________ 。
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成
 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取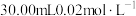 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: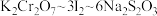 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: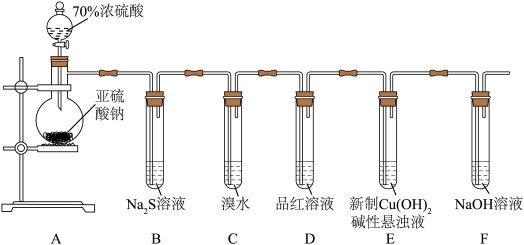
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取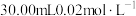 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
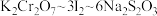 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
解题方法
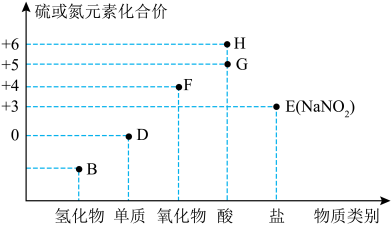
4 . “价—类”二维图是学习元素化合物的一种好方法。硫或氮及其化合物的部分“价—类”二维图如图所示,回答下列问题: ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):_______ 。
(2)若B为 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( ),该反应的化学方程式为
),该反应的化学方程式为_______ ;某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是_______ (填字母)。
A.NaOH B. C.
C. D.浓硫酸
D.浓硫酸
(4)D可以是 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=_____ 。
(5) 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:_______ 。
(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是_______ 。
 ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):(2)若B为
 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。| A.氨气易液化;液氨可用作制冷剂 | B.可用排水法收集氨气 |
| C.氨气是一种无色、无味的气体 | D.向氨水中滴加酚酞,溶液变红 |
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 ),该反应的化学方程式为
),该反应的化学方程式为 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是A.NaOH B.
 C.
C. D.浓硫酸
D.浓硫酸(4)D可以是
 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=(5)
 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是
您最近一年使用:0次
5 . 以软锰矿浆(含 及少量
及少量 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 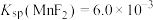 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入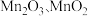 等,其原因是
等,其原因是_______ 。
 及少量
及少量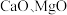 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是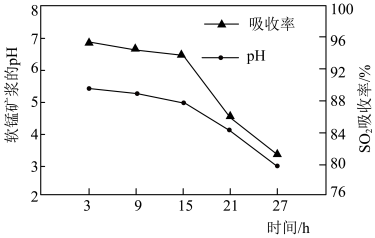
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿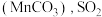 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 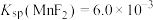 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为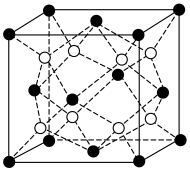
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入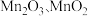 等,其原因是
等,其原因是
您最近一年使用:0次
7日内更新
|
232次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题
名校
解题方法
6 . 回答下列问题
(1)图1记录了1940~2000的60年间 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因______ 。 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:
①工业生产中的 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
碱液吸收法中沙及到的主要反应为: ,
, 。
。
若碱液回收尾气以后,溶液中 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为______ 。
氨还原法是在催化剂作用下,用 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为______ 、______ 。
若在相同条件下消耗的 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为______ 。
②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为______ 。
③结合社会生活中交通工具的变化,你认为 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?______ (请至少例举一条)
(1)图1记录了1940~2000的60年间
 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因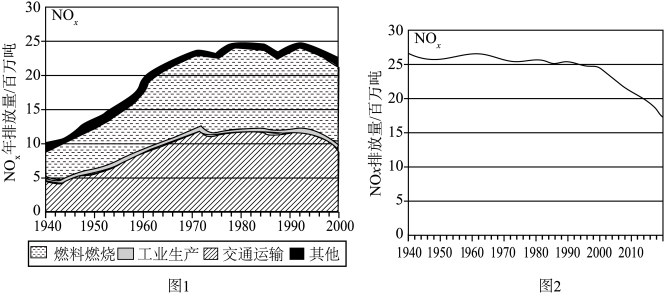
 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:①工业生产中的
 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。碱液吸收法中沙及到的主要反应为:
 ,
, 。
。若碱液回收尾气以后,溶液中
 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为氨还原法是在催化剂作用下,用
 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为若在相同条件下消耗的
 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为
③结合社会生活中交通工具的变化,你认为
 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?
您最近一年使用:0次
解题方法
7 . 含有氮氧化物(NO、NO2)的尾气和含有氨氮(NH3、 )的废水需处理后才能排放。
)的废水需处理后才能排放。
(1)氨氮污水直接排放入河流、湖泊导致的环境问题是_______ 。
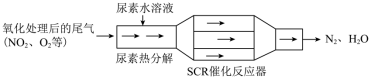
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:_______ 。
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。
② 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是_______ 。
(4)向含氨氮(NH3、 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。_______ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+_______ +2H2O。
 )的废水需处理后才能排放。
)的废水需处理后才能排放。(1)氨氮污水直接排放入河流、湖泊导致的环境问题是
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 时发生反应的离子方程式为
时发生反应的离子方程式为②
 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是(4)向含氨氮(NH3、
 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。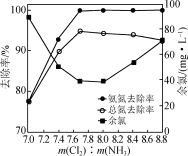
(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+
您最近一年使用:0次
名校
解题方法
8 . 硝酸生产的尾气中NO和 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。
Ⅰ.硝酸生产的尾气中NO和 的处理。
的处理。
(1)硝酸尾气可用NaOH溶液吸收,主要反应为 ;
; ;
;
①吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是___________ (填化学式);
②吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 的离子方程式为
的离子方程式为___________ ;NaClO溶液的初始pH越大,NO转化率越低。其原因是___________ 。
(3)利用 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入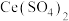 与
与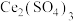 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。 参与的离子方程式为
参与的离子方程式为___________ 。
②若该过程中,每转移3.6mol电子消耗1mol氮氧化物( ),则x为
),则x为___________ 。
Ⅱ.酸性废水中 的处理
的处理
(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=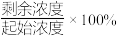 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是___________ 。 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为___________ 。
 等氮氧化物以及酸性废水中
等氮氧化物以及酸性废水中 均须处理达标后再排放。
均须处理达标后再排放。Ⅰ.硝酸生产的尾气中NO和
 的处理。
的处理。(1)硝酸尾气可用NaOH溶液吸收,主要反应为
 ;
; ;
;①吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是②吸收后排放的尾气中含量较高的氮氧化物是
(2)用NaClO溶液也能除去尾气中NO。其他条件相同,NO去除为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。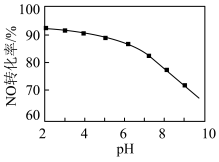
 的离子方程式为
的离子方程式为(3)利用
 也能够还原氮氧化物(
也能够还原氮氧化物( )实现氮污染的治理。将硝酸尾气与
)实现氮污染的治理。将硝酸尾气与 的混合气体通入
的混合气体通入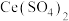 与
与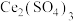 的混合溶液中实现无害化处理,其转化过程如图所示。
的混合溶液中实现无害化处理,其转化过程如图所示。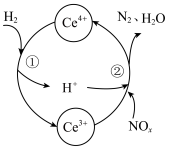
 参与的离子方程式为
参与的离子方程式为②若该过程中,每转移3.6mol电子消耗1mol氮氧化物(
 ),则x为
),则x为Ⅱ.酸性废水中
 的处理
的处理(4)在45℃、惰性气体氛围中金属或合金可以将溶液废水中的
 还原为
还原为 ,从而实现脱氨。量取三份50mL含
,从而实现脱氨。量取三份50mL含 的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中
的废水,分别用金属铝、金属铁和铝铁合金进行处理,溶液中 的残留率(残留率=
的残留率(残留率=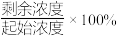 )与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是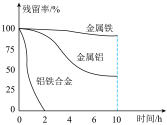
 ,废水中的
,废水中的 在水处理剂表面的变化如图所示,该电池正极上的电极反应式为
在水处理剂表面的变化如图所示,该电池正极上的电极反应式为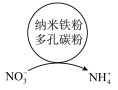
您最近一年使用:0次
2024-05-06更新
|
177次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
9 . 处理工业废气中的 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中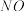 和
和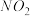 去除率的有
去除率的有_______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
②吸收后的溶液经浓缩、结晶、过滤,得到 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是_______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: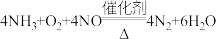 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为_______ 。
(3)氧化吸收法。
① 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
② 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式:_______ ; 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是_______ 。
 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。(1)碱液吸收法。
 可用
可用 溶液吸收,主要反应为:
溶液吸收,主要反应为:

①下列措施能提高尾气中
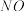 和
和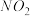 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液②吸收后的溶液经浓缩、结晶、过滤,得到
 晶体,该晶体中的主要杂质是
晶体,该晶体中的主要杂质是(2)催化还原法。
 能在催化剂作用下催化脱除烟气中的
能在催化剂作用下催化脱除烟气中的 ,反应为:
,反应为: 当该反应有
当该反应有 电子转移时,脱除的
电子转移时,脱除的 气体的物质的量为
气体的物质的量为(3)氧化吸收法。
①
 氧化
氧化 结合水洗,可产生
结合水洗,可产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②
 催化
催化 分解产生
分解产生 ,
, 将
将 氧化为
氧化为 ,反应机理见下图所示。写出③的离子方程式:
,反应机理见下图所示。写出③的离子方程式: 脱除率随温度升高呈现下降趋势的主要原因是
脱除率随温度升高呈现下降趋势的主要原因是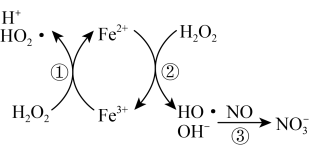
您最近一年使用:0次
名校
10 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为___________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2 +H2O
+H2O
2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2
 +H2O
+H2O2NO2+2OH-=
 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。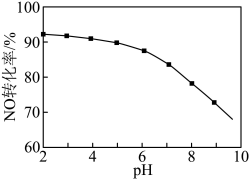
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次



