1 . 回答下列问题。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中___________ 元素被氧化,___________ (填化学式)是氧化剂。
(2)用单线桥标出电子转移方向和数目___________ 。
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为___________ 。
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:
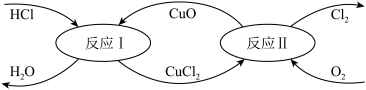
(4)反应Ⅱ的化学方程式为___________ 。
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式___________ 。
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共___________ mol。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中
(2)用单线桥标出电子转移方向和数目
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:

(4)反应Ⅱ的化学方程式为
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共
您最近一年使用:0次
名校
解题方法
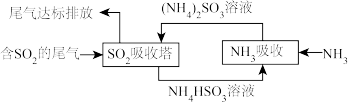
2 . 含SO2和H2S废气的治理可以变废为宝,使硫资源得以利用。
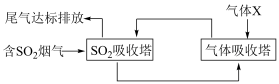
(1)一种处理SO2废气的工艺流程如图所示。_______ ;SO2吸收塔中发生反应化学方程式为_______ 。
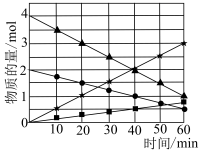
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:_______ 。_______ 。
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:_______ 。(必须使用 的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。_______ 。
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为_______ 。
(1)一种处理SO2废气的工艺流程如图所示。
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:
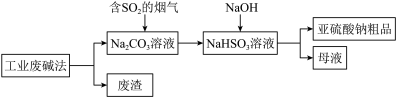
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。
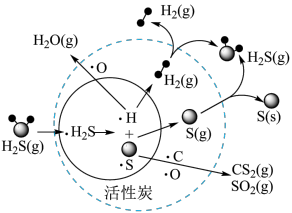
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为
您最近一年使用:0次
2024-02-13更新
|
394次组卷
|
2卷引用:江苏省盐城市盐城一中、射阳中学、滨海中学2023-2024学年高一上学期期末联考化学试卷
3 . V2O5-WO3/TiO2催化剂可以催化NH3脱除烟气中的NO,反应为:4NO(g) + 4NH3(g) + O2(g)=4N2(g) + 6H2O(g)  =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧, 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为___________ ;在水溶液中VO 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为___________ 。
(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为___________ 。

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是___________ 。

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
则V2O5样品的纯度为___________ 。(写出计算过程)
 =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧,
 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为
 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO
 +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。则V2O5样品的纯度为
您最近一年使用:0次
4 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用 溶液实现“碳捕获”技术的装置如图,若实现
溶液实现“碳捕获”技术的装置如图,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为___________ 。

(2)科学家提出用 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C。用
制取C。用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C,已知第二步反应为:
制取C,已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原 制CO,如图,每生成
制CO,如图,每生成 (标准状况下)CO的过程中电子转移的物质的量为
(标准状况下)CO的过程中电子转移的物质的量为___________ 。
(1)某校科研人员利用
 溶液实现“碳捕获”技术的装置如图,若实现
溶液实现“碳捕获”技术的装置如图,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为
(2)科学家提出用
 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C。用
制取C。用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C,已知第二步反应为:
制取C,已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原
 制CO,如图,每生成
制CO,如图,每生成 (标准状况下)CO的过程中电子转移的物质的量为
(标准状况下)CO的过程中电子转移的物质的量为
您最近一年使用:0次
名校
解题方法
5 . 按要求完成下列题目
(1)下列物质中①CO2②乙醇③熔融NaCl④CuCl2溶液⑤固态Na2CO3其中属于电解质的是___________ (只填序号,下同),属于非电解质的是___________ 。所给状态下能导电的是___________ 。
(2)牙膏是日常生活中常用的清洁用品,由粉状摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂及其他特殊成分构成。下表列出了三种牙膏中的摩擦剂。
①将上述摩擦剂a、b所属物质的正确类别填入空格___________ 、___________
②你推测上述三种摩擦剂都___________ (填“溶于”或者“不溶于”)水。
③已知二氧化硅的化学式为SiO2,该物质能与NaOH溶液反应,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3属于___________ (填“酸”“碱”或“盐”)类。非金属氧化物SO2也具有类似的性质,请你写出SO2与NaOH溶液反应的化学方程式___________
(3)工业废水中含有重铬酸根离子(Cr2O72—)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下: (未配平)
(未配平)
在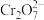 中Cr的化合价为
中Cr的化合价为___________ ;
②该反应中氧化剂和还原剂的个数之比为___________ 。
(1)下列物质中①CO2②乙醇③熔融NaCl④CuCl2溶液⑤固态Na2CO3其中属于电解质的是
(2)牙膏是日常生活中常用的清洁用品,由粉状摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂及其他特殊成分构成。下表列出了三种牙膏中的摩擦剂。

| 牙膏 | X牙膏 | Y牙膏 | Z牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂物质类别(指酸、碱、盐、氧化物) | a | b |
②你推测上述三种摩擦剂都
③已知二氧化硅的化学式为SiO2,该物质能与NaOH溶液反应,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3属于
(3)工业废水中含有重铬酸根离子(Cr2O72—)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:
 (未配平)
(未配平)在
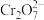 中Cr的化合价为
中Cr的化合价为②该反应中氧化剂和还原剂的个数之比为
您最近一年使用:0次
2024-01-05更新
|
93次组卷
|
2卷引用:江苏省南京市大厂,溧水二高,秦中,江浦文昌四校联考2023-2024学年高一上学期11月期中化学试题
解题方法
6 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)一定条件下,将 通入
通入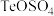 溶液中,反应一段时间后过滤、洗涤得到粗Te。
溶液中,反应一段时间后过滤、洗涤得到粗Te。
① 还原
还原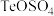 溶液得到Te的反应中,
溶液得到Te的反应中,
___________ 。
②检验沉淀是否洗涤干净的具体操作为___________ 。
③过程中须控制反应温度为80℃,适宜的加热方式为___________ ;采取该加热方式的优点为___________ 。
(2)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到有价值的单质S。反应分两步完成,如图所示,
污染,还可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。

(3)工业上常用 溶液对燃煤烟气进行脱硫。已知
溶液对燃煤烟气进行脱硫。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
, 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
①在实验室模拟脱硫过程:先加稀硫酸调节 吸收液的pH为5,再向其中通入含
吸收液的pH为5,再向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 ,则脱硫反应的离子方程式为
,则脱硫反应的离子方程式为___________ 。
②测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是___________ 。

(4) 水悬浊液吸收
水悬浊液吸收 。已知:室温下,
。已知:室温下,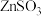 微溶于水,
微溶于水, 易溶于水;溶液中
易溶于水;溶液中 、
、 、
、 的物质的量分数随pH的分布如图1所示。向
的物质的量分数随pH的分布如图1所示。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的
,在开始吸收的 内,
内, 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是___________ (填化学式); 吸收率迅速降低阶段,主要反应的离子方程式为
吸收率迅速降低阶段,主要反应的离子方程式为___________ 。

(1)一定条件下,将
 通入
通入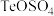 溶液中,反应一段时间后过滤、洗涤得到粗Te。
溶液中,反应一段时间后过滤、洗涤得到粗Te。①
 还原
还原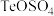 溶液得到Te的反应中,
溶液得到Te的反应中,
②检验沉淀是否洗涤干净的具体操作为
③过程中须控制反应温度为80℃,适宜的加热方式为
(2)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到有价值的单质S。反应分两步完成,如图所示,
污染,还可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(3)工业上常用
 溶液对燃煤烟气进行脱硫。已知
溶液对燃煤烟气进行脱硫。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
, 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①在实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的pH为5,再向其中通入含
吸收液的pH为5,再向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 ,则脱硫反应的离子方程式为
,则脱硫反应的离子方程式为②测得脱硫效率(即
 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
(4)
 水悬浊液吸收
水悬浊液吸收 。已知:室温下,
。已知:室温下,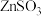 微溶于水,
微溶于水, 易溶于水;溶液中
易溶于水;溶液中 、
、 、
、 的物质的量分数随pH的分布如图1所示。向
的物质的量分数随pH的分布如图1所示。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的
,在开始吸收的 内,
内, 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是 吸收率迅速降低阶段,主要反应的离子方程式为
吸收率迅速降低阶段,主要反应的离子方程式为
您最近一年使用:0次
2023-12-13更新
|
256次组卷
|
2卷引用:江苏省百校大联考2023-2024学年高一上学期12月阶段检测化学试卷
22-23高一上·江苏南通·期末
名校
7 . 利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择最合适的完成指定转化(试剂可以重复选择)。
试剂: 溶液、氨水、
溶液、氨水、 溶液、
溶液、 溶液、
溶液、 溶液、稀盐酸、
溶液、稀盐酸、 溶液
溶液
① 溶液
溶液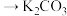 溶液的化学方程式:
溶液的化学方程式:_______ 。
②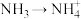 的离子方程式:
的离子方程式:_______ 。
③碱性条件下, 溶液的离子方程式:
溶液的离子方程式:_______ 。
(2)生物浸出法可有效回收含硫矿石中的有色金属,酸性条件下,某生物浸出法主要物质转化如图。

①步骤Ⅰ发生反应的离子方程式为_______ 。
②步骤Ⅱ发生反应的离子方程式为_______ 。
(1)请从下列试剂中选择最合适的完成指定转化(试剂可以重复选择)。
试剂:
 溶液、氨水、
溶液、氨水、 溶液、
溶液、 溶液、
溶液、 溶液、稀盐酸、
溶液、稀盐酸、 溶液
溶液①
 溶液
溶液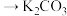 溶液的化学方程式:
溶液的化学方程式:②
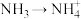 的离子方程式:
的离子方程式:③碱性条件下,
 溶液的离子方程式:
溶液的离子方程式:(2)生物浸出法可有效回收含硫矿石中的有色金属,酸性条件下,某生物浸出法主要物质转化如图。

①步骤Ⅰ发生反应的离子方程式为
②步骤Ⅱ发生反应的离子方程式为
您最近一年使用:0次
2023-01-13更新
|
322次组卷
|
3卷引用:江苏省南通市如皋市2022-2023学年高一上学期期末考试化学试题
(已下线)江苏省南通市如皋市2022-2023学年高一上学期期末考试化学试题江苏省南通市通州区金沙中学2022-2023学年高一下学期3月质量监测化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题
解题方法
8 .  是一种常用消毒剂。
是一种常用消毒剂。 与酸性
与酸性 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为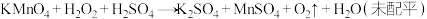 。回答下列问题:
。回答下列问题:
(1)该反应中氧化剂是_______ (填化学式), 发生
发生_______ 反应(填“氧化”或“还原”)。
(2)参加反应的氧化剂与还原剂的化学计量数之比为_______ 。
(3)用双线桥法表示该反应中电子转移的方向和数目:_______ 。
(4)该反应的离子方程式为_______ 。
 是一种常用消毒剂。
是一种常用消毒剂。 与酸性
与酸性 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为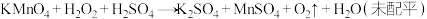 。回答下列问题:
。回答下列问题:(1)该反应中氧化剂是
 发生
发生(2)参加反应的氧化剂与还原剂的化学计量数之比为
(3)用双线桥法表示该反应中电子转移的方向和数目:
(4)该反应的离子方程式为
您最近一年使用:0次
2022-11-23更新
|
112次组卷
|
2卷引用:江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
名校
9 . 硫有多种化合物,如 、
、 等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(1)有学者提出利用 、
、 等离子的作用,在常温下将
等离子的作用,在常温下将 氧化成
氧化成 而实现
而实现 的回收利用,写出
的回收利用,写出 将
将 氧化成
氧化成 反应的离子方程式
反应的离子方程式___________ 。
(2)含有 、
、 的硫酸盐混合溶液可用于吸收
的硫酸盐混合溶液可用于吸收 回收硫单质,其转化关系如图所示。其中反应①中作氧化剂的是
回收硫单质,其转化关系如图所示。其中反应①中作氧化剂的是___________ (填离子符号或化学式),该图示中总反应的化学方程式为___________ 。
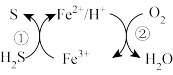
(3)某企业利用下列流程综合处理工厂排放的含 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为___________ ,该流程中可循环利用的物质为___________ (填化学式)。
(4)生产过程中的尾气需要测定 的含量符合标准才能排放。已知有VL(已换算成标准状况)尾气,通入足量
的含量符合标准才能排放。已知有VL(已换算成标准状况)尾气,通入足量 溶液吸收再加入足量
溶液吸收再加入足量 溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。
溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。 溶液的作用是
溶液的作用是___________ ;尾气中 含量(体积分数)的计算式是
含量(体积分数)的计算式是___________ (用含V、b的代数式表示)。
 、
、 等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。(1)有学者提出利用
 、
、 等离子的作用,在常温下将
等离子的作用,在常温下将 氧化成
氧化成 而实现
而实现 的回收利用,写出
的回收利用,写出 将
将 氧化成
氧化成 反应的离子方程式
反应的离子方程式(2)含有
 、
、 的硫酸盐混合溶液可用于吸收
的硫酸盐混合溶液可用于吸收 回收硫单质,其转化关系如图所示。其中反应①中作氧化剂的是
回收硫单质,其转化关系如图所示。其中反应①中作氧化剂的是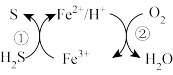
(3)某企业利用下列流程综合处理工厂排放的含
 的烟气,以减少其对环境造成的污染。“
的烟气,以减少其对环境造成的污染。“ 吸收塔”中发生反应的化学方程式为
吸收塔”中发生反应的化学方程式为
(4)生产过程中的尾气需要测定
 的含量符合标准才能排放。已知有VL(已换算成标准状况)尾气,通入足量
的含量符合标准才能排放。已知有VL(已换算成标准状况)尾气,通入足量 溶液吸收再加入足量
溶液吸收再加入足量 溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。
溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。 溶液的作用是
溶液的作用是 含量(体积分数)的计算式是
含量(体积分数)的计算式是
您最近一年使用:0次
2022-07-12更新
|
193次组卷
|
2卷引用:江苏省海安高级中学2023-2024学年高一上学期阶段性检测(三)化学试题
10 .  、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。
Ⅰ.一种脱除 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:
第一阶段:
第二阶段:
(1)该工艺需控制第一阶段与第二阶段参加反应的 的物质的量之比
的物质的量之比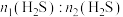 约为1:2.若过大,会导致
约为1:2.若过大,会导致_______ 。
(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为_______ 。

Ⅱ.有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
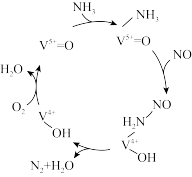
(3)根据如图机理,等物质的量的NO、 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是_______ 。
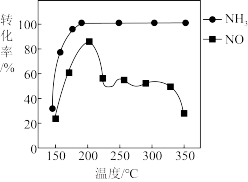
(4)按上述图中 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是_______ 。
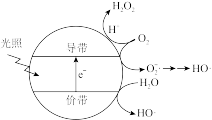
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:_______ 。
 、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。Ⅰ.一种脱除
 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:第一阶段:

第二阶段:

(1)该工艺需控制第一阶段与第二阶段参加反应的
 的物质的量之比
的物质的量之比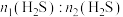 约为1:2.若过大,会导致
约为1:2.若过大,会导致(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为
Ⅱ.有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
(3)根据如图机理,等物质的量的NO、
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(4)按上述图中
 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上
 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:
您最近一年使用:0次
2022-05-28更新
|
724次组卷
|
5卷引用:江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题
江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷(已下线)期末模拟预测卷B-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】



