名校
1 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)湿法制备高铁酸钾的反应体系有六种微粒: 。
。
①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是______ 。
②若反应过程中转移了0.6mol电子,则还原产物的物质的量为______ mol。
③高铁酸钾作为一种理想的水处理剂,其处理水的原理______
(2)铁明矾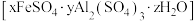 常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。
常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。
①称取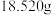 样品,准确配成100mL溶液A。
样品,准确配成100mL溶液A。
②量取 溶液A,加入盐酸酸化的
溶液A,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固
溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固
体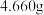 。
。
③再量取 溶液A,滴加适量稀硫酸,用
溶液A,滴加适量稀硫酸,用 溶液滴定至终点,生成
溶液滴定至终点,生成 ,消耗
,消耗 溶液
溶液 。
。
(已知 、
、 的相对分子质量分别是152、342)
的相对分子质量分别是152、342)
①在25.00mL试样中,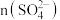
______ mol,
______ mol。
②铁明矾的化学式为______ (写出详细的解题步骤)
(1)湿法制备高铁酸钾的反应体系有六种微粒:
 。
。①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是
②若反应过程中转移了0.6mol电子,则还原产物的物质的量为
③高铁酸钾作为一种理想的水处理剂,其处理水的原理
(2)铁明矾
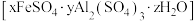 常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。
常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。①称取
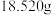 样品,准确配成100mL溶液A。
样品,准确配成100mL溶液A。②量取
 溶液A,加入盐酸酸化的
溶液A,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固
溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体
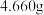 。
。③再量取
 溶液A,滴加适量稀硫酸,用
溶液A,滴加适量稀硫酸,用 溶液滴定至终点,生成
溶液滴定至终点,生成 ,消耗
,消耗 溶液
溶液 。
。(已知
 、
、 的相对分子质量分别是152、342)
的相对分子质量分别是152、342)①在25.00mL试样中,
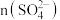

②铁明矾的化学式为
您最近一年使用:0次
2 . I.根据所学知识完成下列问题:
(1)按要求写出下列电离或离子方程式:
① 在水溶液中的电离方程式:
在水溶液中的电离方程式:_______ 。
②将醋酸( )溶液逐滴滴入到
)溶液逐滴滴入到 溶液中,
溶液中,刚开始 时发生的离子方程式是_______ 。
③将饱和 溶液滴入到沸水中,继续加热溶液呈红褐色,即制得
溶液滴入到沸水中,继续加热溶液呈红褐色,即制得 胶体,写出该反应离子方程式:
胶体,写出该反应离子方程式:_______ 。
(2)亚硝酸钠( )是肉制品加工中常用的发色剂。有毒,使用时必须严格控制用量。在酸性条件下,
)是肉制品加工中常用的发色剂。有毒,使用时必须严格控制用量。在酸性条件下, 可将
可将 转变为
转变为 ,自身转化为
,自身转化为 ,写出该过程的离子反应方程式为
,写出该过程的离子反应方程式为_______ 。
II.物质的量是高中化学常用的物理量,请完成以下有关计算:
(3)①某条件下,16g氧气所占的体积为12L,则在该条件下的气体摩尔体积为_______ 。
②16.25g某三价金属的氯化物中含有0.3
 ,则此氯化物的摩尔质量为
,则此氯化物的摩尔质量为_______ 。
(4)取100 0.3
0.3 和200
和200 0.2
0.2 的硫酸溶液注入500
的硫酸溶液注入500 容量瓶中,加水稀释至刻度线,该混合溶液中
容量瓶中,加水稀释至刻度线,该混合溶液中 的物质的量浓度是
的物质的量浓度是_______  。
。
(1)按要求写出下列电离或离子方程式:
①
 在水溶液中的电离方程式:
在水溶液中的电离方程式:②将醋酸(
 )溶液逐滴滴入到
)溶液逐滴滴入到 溶液中,
溶液中,③将饱和
 溶液滴入到沸水中,继续加热溶液呈红褐色,即制得
溶液滴入到沸水中,继续加热溶液呈红褐色,即制得 胶体,写出该反应离子方程式:
胶体,写出该反应离子方程式:(2)亚硝酸钠(
 )是肉制品加工中常用的发色剂。有毒,使用时必须严格控制用量。在酸性条件下,
)是肉制品加工中常用的发色剂。有毒,使用时必须严格控制用量。在酸性条件下, 可将
可将 转变为
转变为 ,自身转化为
,自身转化为 ,写出该过程的离子反应方程式为
,写出该过程的离子反应方程式为II.物质的量是高中化学常用的物理量,请完成以下有关计算:
(3)①某条件下,16g氧气所占的体积为12L,则在该条件下的气体摩尔体积为
②16.25g某三价金属的氯化物中含有0.3

 ,则此氯化物的摩尔质量为
,则此氯化物的摩尔质量为(4)取100
 0.3
0.3 和200
和200 0.2
0.2 的硫酸溶液注入500
的硫酸溶液注入500 容量瓶中,加水稀释至刻度线,该混合溶液中
容量瓶中,加水稀释至刻度线,该混合溶液中 的物质的量浓度是
的物质的量浓度是 。
。
您最近一年使用:0次
解题方法
3 . 在酸性条件下,黄铁矿( ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
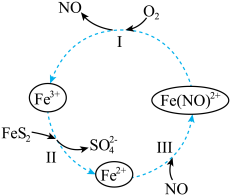
总反应:
(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:_______ 。
②反应Ⅱ:_______ 。
(2)NO在总反应中的作用是_______ 。
 ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
总反应:

(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
您最近一年使用:0次
名校
解题方法
4 . 含SO2和H2S废气的治理可以变废为宝,使硫资源得以利用。
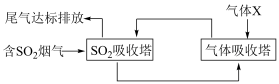
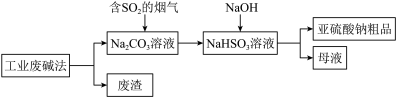
(1)一种处理SO2废气的工艺流程如图所示。_______ ;SO2吸收塔中发生反应化学方程式为_______ 。
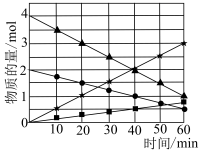
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:_______ 。_______ 。
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:_______ 。(必须使用 的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。_______ 。
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为_______ 。
(1)一种处理SO2废气的工艺流程如图所示。
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。
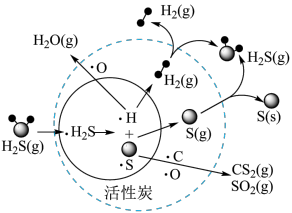
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为
您最近一年使用:0次
2024-02-13更新
|
394次组卷
|
2卷引用:江苏省盐城市盐城一中、射阳中学、滨海中学2023-2024学年高一上学期期末联考化学试卷
名校
5 . 根据信息书写相关反应的方程式:
(1)用铁炭混合物处理含硝基苯( )的弱酸性废水,可得到含苯胺(
)的弱酸性废水,可得到含苯胺(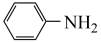 )和
)和 的溶液。写出该反应的离子方程式:
的溶液。写出该反应的离子方程式:___________ 。
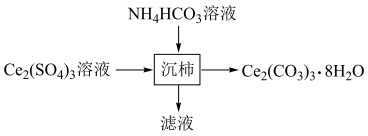
(2) 是生产含铈化合物的重要原料,可由
是生产含铈化合物的重要原料,可由 溶液经过如图所示流程转化得到。写出“沉铈”时反应的离子方程式:
溶液经过如图所示流程转化得到。写出“沉铈”时反应的离子方程式:___________ 。
(1)用铁炭混合物处理含硝基苯(
 )的弱酸性废水,可得到含苯胺(
)的弱酸性废水,可得到含苯胺( )和
)和 的溶液。写出该反应的离子方程式:
的溶液。写出该反应的离子方程式:(2)
 是生产含铈化合物的重要原料,可由
是生产含铈化合物的重要原料,可由 溶液经过如图所示流程转化得到。写出“沉铈”时反应的离子方程式:
溶液经过如图所示流程转化得到。写出“沉铈”时反应的离子方程式:
您最近一年使用:0次
名校
6 . 回答下列问题:
(一)下列物质中:①漂白粉固体 ② 固体 ③
固体 ③ 固体 ④熔融
固体 ④熔融 ⑤食醋⑥
⑤食醋⑥ 片 ⑦
片 ⑦ ⑧盐酸 ⑨石墨 ⑩
⑧盐酸 ⑨石墨 ⑩ 葡萄糖(填序号)
葡萄糖(填序号)
(1)以上物质中属于强电解质且能导电的是___________________________ ;
(2)以上物质中属于非电解质的是___________________________ ;
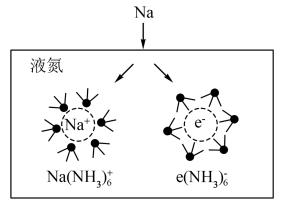
(二)氨基钠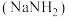 是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子 和蓝色的氨合电子
和蓝色的氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
(3)导电性:蓝色溶液____________ 液氨(填“>、<、=”)
(4)将 钠投入液氨中,得到
钠投入液氨中,得到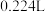 (标准状况下)
(标准状况下) ,与液氨反应产生
,与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为______________ 。
(5)钠与液氨反应方程式为:________________________________________ 。
(一)下列物质中:①漂白粉固体 ②
 固体 ③
固体 ③ 固体 ④熔融
固体 ④熔融 ⑤食醋⑥
⑤食醋⑥ 片 ⑦
片 ⑦ ⑧盐酸 ⑨石墨 ⑩
⑧盐酸 ⑨石墨 ⑩ 葡萄糖(填序号)
葡萄糖(填序号)(1)以上物质中属于强电解质且能导电的是
(2)以上物质中属于非电解质的是
(二)氨基钠
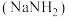 是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子 和蓝色的氨合电子
和蓝色的氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
(3)导电性:蓝色溶液
(4)将
 钠投入液氨中,得到
钠投入液氨中,得到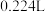 (标准状况下)
(标准状况下) ,与液氨反应产生
,与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为(5)钠与液氨反应方程式为:
您最近一年使用:0次
7 . “2060年实现碳中和”的目标提出之后, 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。

(1)HCOOH是有机物,分子中所含官能团的名称为___________ 。
(2)将 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要___________ 能量(填“吸收”或“放出”)。
(3)一定条件下, 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为___________ 。
 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。
(1)HCOOH是有机物,分子中所含官能团的名称为
(2)将
 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要(3)一定条件下,
 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
您最近一年使用:0次
2024-01-12更新
|
203次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
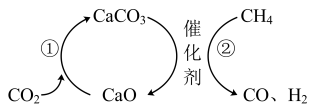
8 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用 溶液实现“碳捕获”技术的装置如图,若实现
溶液实现“碳捕获”技术的装置如图,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为___________ 。

(2)科学家提出用 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C。用
制取C。用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C,已知第二步反应为:
制取C,已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原 制CO,如图,每生成
制CO,如图,每生成 (标准状况下)CO的过程中电子转移的物质的量为
(标准状况下)CO的过程中电子转移的物质的量为___________ 。
(1)某校科研人员利用
 溶液实现“碳捕获”技术的装置如图,若实现
溶液实现“碳捕获”技术的装置如图,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为
(2)科学家提出用
 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C。用
制取C。用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C,已知第二步反应为:
制取C,已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原
 制CO,如图,每生成
制CO,如图,每生成 (标准状况下)CO的过程中电子转移的物质的量为
(标准状况下)CO的过程中电子转移的物质的量为
您最近一年使用:0次
名校
解题方法
9 . 人们在认识自然的过程中所形成的化学知识和观念,都始于对实验的观察、想象和思考.
(1)两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的 溶液和
溶液和 溶液,实验中发现加入
溶液,实验中发现加入 水的试管中溶液迅速变为蓝色,而加入
水的试管中溶液迅速变为蓝色,而加入 溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到
溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到 和
和 的混合溶液中,首先发生的离子反应为
的混合溶液中,首先发生的离子反应为__________________________________ ,由此可以推知,将等物质的量的 与
与 在溶液中反应,发生反应的离子方程式为
在溶液中反应,发生反应的离子方程式为_________________ .
(2)①将5mL饱和 (滴有酚酞试液)溶液迅速滴加到充满
(滴有酚酞试液)溶液迅速滴加到充满 气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为
气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为_________________ .
②两支试管中分别放有 固体,现向两支试管中分别加入等体积(约10mL)的水和饱和
固体,现向两支试管中分别加入等体积(约10mL)的水和饱和 溶液振荡,两试管中
溶液振荡,两试管中 固体均完全溶解且有放热的现象,同时加入
固体均完全溶解且有放热的现象,同时加入 饱和溶液的试管的温度明显高于加水的试管,可见
饱和溶液的试管的温度明显高于加水的试管,可见 固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应_________________
(1)两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的
 溶液和
溶液和 溶液,实验中发现加入
溶液,实验中发现加入 水的试管中溶液迅速变为蓝色,而加入
水的试管中溶液迅速变为蓝色,而加入 溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到
溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到 和
和 的混合溶液中,首先发生的离子反应为
的混合溶液中,首先发生的离子反应为 与
与 在溶液中反应,发生反应的离子方程式为
在溶液中反应,发生反应的离子方程式为(2)①将5mL饱和
 (滴有酚酞试液)溶液迅速滴加到充满
(滴有酚酞试液)溶液迅速滴加到充满 气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为
气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为②两支试管中分别放有
 固体,现向两支试管中分别加入等体积(约10mL)的水和饱和
固体,现向两支试管中分别加入等体积(约10mL)的水和饱和 溶液振荡,两试管中
溶液振荡,两试管中 固体均完全溶解且有放热的现象,同时加入
固体均完全溶解且有放热的现象,同时加入 饱和溶液的试管的温度明显高于加水的试管,可见
饱和溶液的试管的温度明显高于加水的试管,可见 固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
您最近一年使用:0次
名校
10 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2 +3Cl-+yH2O。
+3Cl-+yH2O。
(1)上述反应中的x=___________ ,y=___________ 。
(2)上述反应中氧化剂为___________ ;还原产物为___________ 。
(3)由上述反应可知,氧化性强弱:ClO-___________  (填“>”或“<”,下同);还原性强弱:Cl-
(填“>”或“<”,下同);还原性强弱:Cl-_________ Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:___________ 。
 +3Cl-+yH2O。
+3Cl-+yH2O。(1)上述反应中的x=
(2)上述反应中氧化剂为
(3)由上述反应可知,氧化性强弱:ClO-
 (填“>”或“<”,下同);还原性强弱:Cl-
(填“>”或“<”,下同);还原性强弱:Cl-(4)请用单线桥法表示该反应中电子的转移情况:
您最近一年使用:0次



