名校
1 . “纳米零价铁-H2O2”体系可将烟气中难溶的NO氧化为可溶的 。
。
(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为___________ ,该反应的还原产物是___________ (写化学式)。
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +___________ + Fe = Fe3+ +  + 4H2O
+ 4H2O
①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是___________ 。
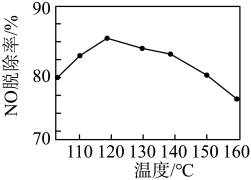
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是___________ 。___________ (填化学式),写出该物质的一种用途___________ 。
 。
。(1)制备纳米零价铁:将FeSO4溶液与NaOH、Na2S2O4的混合溶液混合后可生成纳米零价铁和Na2SO3等,Na2S2O4中S元素的化合价为
(2)NO的氧化:在一定温度下,将H2O2溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化为HNO3,总反应的离子方程式为3H2O2 + NO +
 + 4H2O
+ 4H2O①补充完整以上的离子方程式,若反应生成36g水,则反应的氧化剂的质量是
②NO脱除率随温度的变化如图所示。当温度高于120℃时,NO脱除率随温度升高呈现下降趋势,其主要原因是
您最近半年使用:0次
名校
2 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近半年使用:0次
3 . 实验室用 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: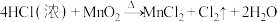
(1)该反应中被氧化的元素是___________ ,还原产物是___________ ;
(2)用单线桥标明电子转移的方向与数目___________ 。
(3)该反应中,氧化剂与还原剂的物质的量之比为___________ (前者比后者);盐酸在反应中表现出来的性质是___________ 。
(4)当生成标准状况下 时,转移的电子数目为
时,转移的电子数目为___________ ,被氧化的还原剂的物质的量为___________ 。
(5)也可以用 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:___________ 。
(6)举例说明氯气的氧化性比硫单质强,___________ 。
 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: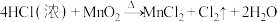
(1)该反应中被氧化的元素是
(2)用单线桥标明电子转移的方向与数目
(3)该反应中,氧化剂与还原剂的物质的量之比为
(4)当生成标准状况下
 时,转移的电子数目为
时,转移的电子数目为(5)也可以用
 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:(6)举例说明氯气的氧化性比硫单质强,
您最近半年使用:0次
解题方法
4 . 空气质量日报中涉及的污染物主要是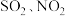 和可吸入颗粒物。
和可吸入颗粒物。
Ⅰ.汽车尾气是城市大气氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使 和
和 反应生成可参与大气生态环境循环的无毒气体。
反应生成可参与大气生态环境循环的无毒气体。
(1)以 为例写出反应的化学方程式:
为例写出反应的化学方程式:_________ 。
Ⅱ.SO2的排放是造成酸雨的主要因素,形成酸雨的原理之一可简单表示为:
______________ (填“>”“<”或“=”)5.6。
(3)反应 的化学方程式为
的化学方程式为______________ 。
(4)用足量的氨水吸收 ,其离子方程式为
,其离子方程式为________ 。
(5) 溶液可以吸收含
溶液可以吸收含 的烟气,若
的烟气,若 溶液与
溶液与 恰好反应完全,检验反应后的溶液中是否含有
恰好反应完全,检验反应后的溶液中是否含有 的方法为
的方法为_____________ 。
Ⅲ.利用溶液吸收尾气(主要含 及少量
及少量 )中的氮氧化物,实验装置如图所示.已知:
)中的氮氧化物,实验装置如图所示.已知: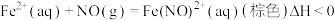
______ 时,说明 中
中 溶液需要更换。
溶液需要更换。
(7)若尾气体积为 (标准状况),用
(标准状况),用 溶液滴定a中溶液,消耗
溶液滴定a中溶液,消耗 溶液体积为
溶液体积为 ,尾气中
,尾气中 的体积分数为
的体积分数为_________ 。
 和可吸入颗粒物。
和可吸入颗粒物。Ⅰ.汽车尾气是城市大气氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使
 和
和 反应生成可参与大气生态环境循环的无毒气体。
反应生成可参与大气生态环境循环的无毒气体。(1)以
 为例写出反应的化学方程式:
为例写出反应的化学方程式:Ⅱ.SO2的排放是造成酸雨的主要因素,形成酸雨的原理之一可简单表示为:


(3)反应
 的化学方程式为
的化学方程式为(4)用足量的氨水吸收
 ,其离子方程式为
,其离子方程式为(5)
 溶液可以吸收含
溶液可以吸收含 的烟气,若
的烟气,若 溶液与
溶液与 恰好反应完全,检验反应后的溶液中是否含有
恰好反应完全,检验反应后的溶液中是否含有 的方法为
的方法为Ⅲ.利用溶液吸收尾气(主要含
 及少量
及少量 )中的氮氧化物,实验装置如图所示.已知:
)中的氮氧化物,实验装置如图所示.已知: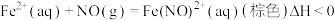

 中
中 溶液需要更换。
溶液需要更换。(7)若尾气体积为
 (标准状况),用
(标准状况),用 溶液滴定a中溶液,消耗
溶液滴定a中溶液,消耗 溶液体积为
溶液体积为 ,尾气中
,尾气中 的体积分数为
的体积分数为
您最近半年使用:0次
解题方法
5 . Ⅰ.过氧化氢是用途很广的绿色氧化剂,常用于消毒、杀菌、漂白等.试回答下列问题:
(1)写出酸性高锰酸钾溶液和 反应的离子方程式:
反应的离子方程式:______________ 。
(2)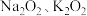 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是______________ 。
Ⅱ.某工厂废水中含 ,其浓度为
,其浓度为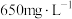 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):
(3)反应 中被氧化的元素是
中被氧化的元素是______________ 。
(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:_____________ 。
(1)写出酸性高锰酸钾溶液和
 反应的离子方程式:
反应的离子方程式:(2)
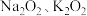 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是Ⅱ.某工厂废水中含
 ,其浓度为
,其浓度为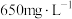 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):(3)反应
 中被氧化的元素是
中被氧化的元素是(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:

您最近半年使用:0次
名校
6 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
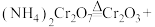 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
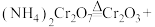 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为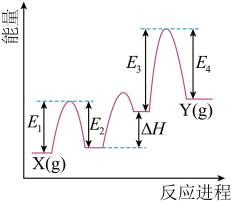
您最近半年使用:0次
名校
7 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)湿法制备高铁酸钾的反应体系有六种微粒: 。
。
①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是______ 。
②若反应过程中转移了0.6mol电子,则还原产物的物质的量为______ mol。
③高铁酸钾作为一种理想的水处理剂,其处理水的原理______
(2)铁明矾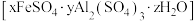 常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。
常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。
①称取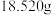 样品,准确配成100mL溶液A。
样品,准确配成100mL溶液A。
②量取 溶液A,加入盐酸酸化的
溶液A,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固
溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固
体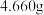 。
。
③再量取 溶液A,滴加适量稀硫酸,用
溶液A,滴加适量稀硫酸,用 溶液滴定至终点,生成
溶液滴定至终点,生成 ,消耗
,消耗 溶液
溶液 。
。
(已知 、
、 的相对分子质量分别是152、342)
的相对分子质量分别是152、342)
①在25.00mL试样中,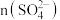
______ mol,
______ mol。
②铁明矾的化学式为______ (写出详细的解题步骤)
(1)湿法制备高铁酸钾的反应体系有六种微粒:
 。
。①在碱性条件下,湿法生产高铁酸钾的离子反应方程式是
②若反应过程中转移了0.6mol电子,则还原产物的物质的量为
③高铁酸钾作为一种理想的水处理剂,其处理水的原理
(2)铁明矾
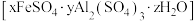 常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。
常用于制备高效复合型高效混凝剂。其组成通过下列实验测定。①称取
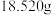 样品,准确配成100mL溶液A。
样品,准确配成100mL溶液A。②量取
 溶液A,加入盐酸酸化的
溶液A,加入盐酸酸化的 溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固
溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体
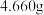 。
。③再量取
 溶液A,滴加适量稀硫酸,用
溶液A,滴加适量稀硫酸,用 溶液滴定至终点,生成
溶液滴定至终点,生成 ,消耗
,消耗 溶液
溶液 。
。(已知
 、
、 的相对分子质量分别是152、342)
的相对分子质量分别是152、342)①在25.00mL试样中,
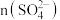

②铁明矾的化学式为
您最近半年使用:0次
解题方法
8 . 按要求完成下面小题。
(1)有以下转化关系:
反应①:___________
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是___________ (填序号)。
(2) 。该反应中,生成物M是
。该反应中,生成物M是___________ (填化学式)。
(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是___________ (填序号,下同)。
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为___________ 。
(5) 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:___________ 。
(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平___________ 。
(1)有以下转化关系:

反应①:
 在上述有序号的反应中,除了①⑥外,需用氧化剂的是
在上述有序号的反应中,除了①⑥外,需用氧化剂的是(2)
 。该反应中,生成物M是
。该反应中,生成物M是(3)针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.Na2O2+HCl→H2O2+NaCl
B.Ag2O+H2O2→Ag+O2↑+H2O
C.H2O2→H2O+O2↑
D.H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O
H2O2仅作氧化剂的反应是
(4)取少量NaH放入水中,剧烈反应放出一种无色、无味的气体,并形成一种碱性溶液。NaH与水反应的化学方程式为
(5)
 与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:
与H+或OH-在溶液都不能大量共存,试用离子方程式说明与OH-不共存的原因:(6)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药是将硫磺、木炭、硝酸钾按照一定比例混合,在发生爆炸时,没有产生污染性物质。请书写出该反应方程式并配平
您最近半年使用:0次
9 . 现有下列六种物质:①液态氯化氢;②二氧化碳;③硫酸铜溶液;④熔融氯化钠;⑤ 固体;⑥铁丝.
固体;⑥铁丝.
(1)上述六种物质中,属于非电解质的是__________ ,能导电的电解质是__________ (填序号)。
(2)③和⑥反应的基本反应类型为__________ ,其离子方程式为__________ 。
(3)氯化氢在水溶液中的电离方程式为__________ 。
(4)向③中加入⑤的水溶液的现象为__________ 。
(5) 与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失
与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失______ 。
__________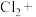 __________
__________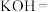 __________
__________ __________
__________ __________
__________
 固体;⑥铁丝.
固体;⑥铁丝.(1)上述六种物质中,属于非电解质的是
(2)③和⑥反应的基本反应类型为
(3)氯化氢在水溶液中的电离方程式为
(4)向③中加入⑤的水溶液的现象为
(5)
 与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失
与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失__________
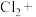 __________
__________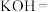 __________
__________ __________
__________ __________
__________
您最近半年使用:0次
10 . Cl2、SO2、CO2均是中学化学常见的气体,减少Cl2、SO2的排放可以防止污染空气,减少CO2的排放,有利于保护环境,实现碳中和。回答下列问题:
(1)化工厂可用浓氨水来检验Cl2是否泄漏,当有少量Cl2泄漏时,可以观察到的现象是________ 。
(2)用热烧碱溶液吸收Cl2反应后的混合溶液,若含NaCl、NaClO和NaClO3物质的量比值为n∶1∶2,则n=________ 。
(3)常温下,可用NaOH溶液作CO2的捕捉剂。若经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为3:1,则所得溶液中溶质成分为________ (填化学式)。
(4)①除品红外,鉴别SO2、CO2两种气体还可以采用________ (填试剂名称),SO2、Cl2均有漂白性,若将两者1∶1通入品红溶液中,不能使品红褪色,理由是________ (写离子方程式),除去SO2中的HCl可采用________ (填试剂名称)。
②用硫酸酸化的K2Cr2O7溶液处理SO2气体,会析出铬钾矾[KCr(SO4)2·12H2O]晶体。写出该反应的化学方程式:________ 。
(1)化工厂可用浓氨水来检验Cl2是否泄漏,当有少量Cl2泄漏时,可以观察到的现象是
(2)用热烧碱溶液吸收Cl2反应后的混合溶液,若含NaCl、NaClO和NaClO3物质的量比值为n∶1∶2,则n=
(3)常温下,可用NaOH溶液作CO2的捕捉剂。若经测定某次捕捉所得溶液中,Na和C两种元素物质的量比值为3:1,则所得溶液中溶质成分为
(4)①除品红外,鉴别SO2、CO2两种气体还可以采用
②用硫酸酸化的K2Cr2O7溶液处理SO2气体,会析出铬钾矾[KCr(SO4)2·12H2O]晶体。写出该反应的化学方程式:
您最近半年使用:0次



