名校
解题方法
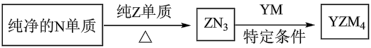
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近一年使用:0次
名校
解题方法
2 . 硒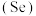 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子IV的合成路线如下:
分子IV的合成路线如下: 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为_______ 。
(2) 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
_______  (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是_______ ;热稳定性:
_______  。
。
(3)研究发现,给小鼠喂食适量硒酸钠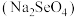 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。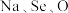 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为_______ 。
(4)反应物III的部分结构与肼 十分相似,
十分相似, 的电子式为
的电子式为_______ 。以 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼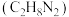 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为_______ 。
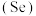 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子IV的合成路线如下:
分子IV的合成路线如下: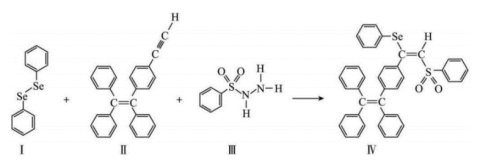
 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为(2)
 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
 (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是
 。
。(3)研究发现,给小鼠喂食适量硒酸钠
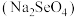 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。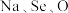 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为(4)反应物III的部分结构与肼
 十分相似,
十分相似, 的电子式为
的电子式为 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼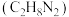 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
2023-03-24更新
|
267次组卷
|
2卷引用:湖北省名校3月联考2022-2023学年高一下学期化学试题
3 . 工业上湿法合成硼氢化钠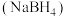 路线如下:
路线如下:

已知:硼酸的结构为: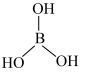
请回答下列问题:
(1)“合成”步骤中常将 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是___________ 。
(2)“合成”反应的化学方程式为___________ 。
(3)“合成”反应也可以利用KH,其还原能力比 更强,请说明原因
更强,请说明原因___________ 。
(4)硼氢化钠在催化剂钌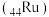 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。

(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素___________ 。并写出检验过程中涉及的离子方程式___________ 。
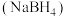 路线如下:
路线如下:
已知:硼酸的结构为:

请回答下列问题:
(1)“合成”步骤中常将
 分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是
分散到矿物油中,再与硼酸三甲酯反应,其中矿物油的作用是(2)“合成”反应的化学方程式为
(3)“合成”反应也可以利用KH,其还原能力比
 更强,请说明原因
更强,请说明原因(4)硼氢化钠在催化剂钌
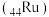 表面与水反应的历程如图所示,下列说法正确的是___________。
表面与水反应的历程如图所示,下列说法正确的是___________。
A.元素钌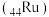 在元素周期表中位于第五周期Ⅷ族 在元素周期表中位于第五周期Ⅷ族 |
B. 分子中B原子为 分子中B原子为 杂化且不含孤对电子 杂化且不含孤对电子 |
C.过程④中产生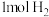 ,转移电子的物质的量为 ,转移电子的物质的量为 |
D.硼氢化钠中硼元素的化合价为 价,反应过程中硼元素的化合价始终保持不变 价,反应过程中硼元素的化合价始终保持不变 |
(5)已知氢化铝钾能与水发生剧烈反应,请设计实验证明其反应后的溶液中存在铝元素
您最近一年使用:0次
4 . 氯元素形成的单质或化合物用途广泛。
(1)氯元素在周期表中的位置_____ 。
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是_____ (填合适的化学方程式)。
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:
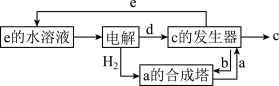
(3)C为______ (填化学式)。
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为______ 。
(5)“a的合成塔”中发生反应的化学方程式为______ 。
(6)“c的发生器”中发生反应的离子方程式为_____ (写出正确的离子方程式并用单线桥法分析电子转移的情况)。
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是_____ 。
(1)氯元素在周期表中的位置
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:

(3)C为
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为
(5)“a的合成塔”中发生反应的化学方程式为
(6)“c的发生器”中发生反应的离子方程式为
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是
您最近一年使用:0次
名校
5 .  、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
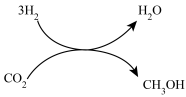
(1)利用 可合成多种化工产品。
可合成多种化工产品。
2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为___________ 。
(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为___________ 。
②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为___________ 。过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇( )实现
)实现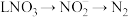 的转化,将
的转化,将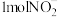 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为___________ 。
(3)硫酸生产及煤燃烧过程中产生的废气 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于___________ (填“电解质”或“非电解质”),氨水吸收少量 ,反应的离子方程式为
,反应的离子方程式为___________ 。
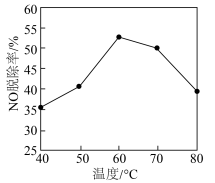
(4)氮的氧化物(NO、 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是___________ 。
 、
、 和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
和含氮化合物的资源化利用,既能解决环保问题,又能提供化工原料,缓解能源紧张,具有重要的现实意义和广阔的应用前景。
(1)利用
 可合成多种化工产品。
可合成多种化工产品。2021年9月24日我国科学家首次报告了
 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为(2)氨氮废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 的形式存在,我们可以通过一些化学方法把
的形式存在,我们可以通过一些化学方法把 和
和 转化为
转化为 。
。 在催化剂的作用会和氧气发生反应,该反应的化学方程式为
在催化剂的作用会和氧气发生反应,该反应的化学方程式为②某团队设计处理氨氮废水的流程如下:

过程Ⅰ为硝化过程,在微生物的作用下实现
 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应离子方程式为
的总反应离子方程式为 )实现
)实现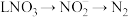 的转化,将
的转化,将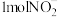 完全转化为
完全转化为 转移电子的物质的量为
转移电子的物质的量为(3)硫酸生产及煤燃烧过程中产生的废气
 等会对大气造成污染,可用氨水吸收
等会对大气造成污染,可用氨水吸收 或采用钙基固硫法。
或采用钙基固硫法。 属于
属于 ,反应的离子方程式为
,反应的离子方程式为(4)氮的氧化物(NO、
 等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的
等)是主要的大气污染物,必须脱除才能排放。研究不同温度下经酸化处理的 溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
您最近一年使用:0次
6 . 在元素周期表中除了同族元素的性质相似外,还有一些处于对角线上的元素的性质也呈现相似性。例如Li和Mg、Be和Al、B和Si,这种相似关系称为对角线关系,也称对角线规则。回答下列问题:
(1)Ge与Si同主族,二者属于周期表中____________ 区元素;Ge能与NaOH溶液反应生成Na2GeO3,其中发生反应的化学方程式为_____________ 。
(2)基态Mg原子和基态A1原子中第一电离能较大的是___________ ,原因为____________ 。
(3)硼氢化钠(NaBH4)是有机合成中常用的还原剂。
①硼氢化钠中存在的化学键为_____________ (填标号)。
a.离子键 c.氢键 b.共价键 d.配位键
②_____________ gNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成失去电子的量)。
(4)半径:Mg2+____________ Al3+(填“>”或“<”),若某溶液中的金属阳离子只含Mg2+或Al3+,验证金属离子的方法及现象为____________ 。
(1)Ge与Si同主族,二者属于周期表中
(2)基态Mg原子和基态A1原子中第一电离能较大的是
(3)硼氢化钠(NaBH4)是有机合成中常用的还原剂。
①硼氢化钠中存在的化学键为
a.离子键 c.氢键 b.共价键 d.配位键
②
(4)半径:Mg2+
您最近一年使用:0次
名校
解题方法
7 . 氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。
(1)元素铬(Cr)的几种化合物(化合物中氧元素均为-2价)存在下列转化关系:
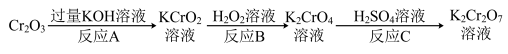
①K2Cr2O7中铬元素化合价为_______ ,上述过程属于氧化还原反应的是_______ (填字母)。
②已知B反应中H2O2只发生如下过程:H2O2→H2O,则B反应被还原的元素是_______ (填化学式),写出B反应的化学方程式_______ ,H2O2被称为“绿色氧化剂”的理由是_______ 。
(2)近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:3C+2 K2Cr2O7+8H2SO4(稀)=3CO2↑+3K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题。
①分析元素化合价可知该反应的氧化产物为_______ (填化学式)。
②根据化合价,推测Cr2O 能和
能和_______ 反应(填标号)。
A.KMnO4 B.SO2 C.H2S D.O2
③+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为_______ 。
(3)化工厂常用浓氨水检验管道是否漏气,其原理为3Cl2+8NH3=6NH4Cl+N2,被氧化的NH3与被还原的Cl2的分子个数之比为_______ 。
(1)元素铬(Cr)的几种化合物(化合物中氧元素均为-2价)存在下列转化关系:
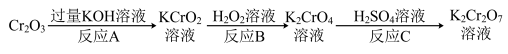
①K2Cr2O7中铬元素化合价为
②已知B反应中H2O2只发生如下过程:H2O2→H2O,则B反应被还原的元素是
(2)近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,常伴有大量物质-碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:3C+2 K2Cr2O7+8H2SO4(稀)=3CO2↑+3K2SO4+2Cr2(SO4)3+8H2O。请回答下列问题。
①分析元素化合价可知该反应的氧化产物为
②根据化合价,推测Cr2O
 能和
能和A.KMnO4 B.SO2 C.H2S D.O2
③+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O
 还原成Cr3+,反应的离子方程式为
还原成Cr3+,反应的离子方程式为(3)化工厂常用浓氨水检验管道是否漏气,其原理为3Cl2+8NH3=6NH4Cl+N2,被氧化的NH3与被还原的Cl2的分子个数之比为
您最近一年使用:0次
名校
8 . 硝酸是用途广泛的重要化工原料,自然界和化工生产中合成硝酸各物质转化关系如下图所示,请结合你所学的知识回答以下问题:

(1) 在自然界中能稳定存在的原因是
在自然界中能稳定存在的原因是___________ ;
(2)上图①~⑥各步转化中,属于氮的固定的是___________ (填序号);
(3)氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比___________ ;
(4)写出反应②的化学方程式___________ ;写出反应⑥的化学方程式___________ ;
(5)工业制硝酸时含有NO、NO2等大气污染物。用尿素 (NH2)2CO水溶液吸收氮氧化物是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。

①用尿素 (NH2)2CO 水溶液吸收体积比为1:1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式___________ ;
②随着NO和NO2配比的提高,总氮还原率降低的主要原因是___________ 。

(1)
 在自然界中能稳定存在的原因是
在自然界中能稳定存在的原因是(2)上图①~⑥各步转化中,属于氮的固定的是
(3)氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比
(4)写出反应②的化学方程式
(5)工业制硝酸时含有NO、NO2等大气污染物。用尿素 (NH2)2CO水溶液吸收氮氧化物是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。

①用尿素 (NH2)2CO 水溶液吸收体积比为1:1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式
②随着NO和NO2配比的提高,总氮还原率降低的主要原因是
您最近一年使用:0次



