解题方法
1 . 根据要求填空。
(1)氯气和石灰乳反应制取漂白粉的化学方程式为________ ,漂白粉的组成为________ (填写化学式)。
(2)过氧化钠和水反应的化学方程式为________ ,每生成1mol  转移电子
转移电子________ 个。
(3)工业上用黄铁矿( )制硫酸第一步,在
)制硫酸第一步,在________ (填写设备名称)中发生反应的化学方程式________ 。
(4)红热的炭块放入浓硫酸中发生反应的化学方程式为________ ,浓硫酸在反应中表现出________ 性。
(5)写出 和足量
和足量 反应的离子方程式为
反应的离子方程式为________ 。
(6)碘盐中的 和KI在酸性溶液中发生反应的离子方程式为
和KI在酸性溶液中发生反应的离子方程式为________ 。
(1)氯气和石灰乳反应制取漂白粉的化学方程式为
(2)过氧化钠和水反应的化学方程式为
 转移电子
转移电子(3)工业上用黄铁矿(
 )制硫酸第一步,在
)制硫酸第一步,在(4)红热的炭块放入浓硫酸中发生反应的化学方程式为
(5)写出
 和足量
和足量 反应的离子方程式为
反应的离子方程式为(6)碘盐中的
 和KI在酸性溶液中发生反应的离子方程式为
和KI在酸性溶液中发生反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 2022年央视春晚的节目《只此青绿》,提到了颜料石绿{铜绿,又名孔雀石,主要成分是碱式碳酸铜{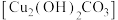 }。某同学利用下述反应实现了“铜→铜绿→……→Cu”的转化。回答下列问题:
}。某同学利用下述反应实现了“铜→铜绿→……→Cu”的转化。回答下列问题:
铜 铜绿
铜绿
(1)铜在潮湿的空气中容易产生铜绿,写出此反应的化学方程式:____________ 。
(2)AB在无色火焰上灼烧时,其焰色______ (填“相同”或“不同”),该原理是______ (填“物理”或“化学”)变化。
(3)完成步骤2和3可选用的试剂分别为______ 、______ 。(填标号)
a.HCl溶液 b.NaCl溶液 c.NaOH溶液 d. 溶液
溶液
写出任一所选试剂的溶质在水溶液里的电离方程式:______ 。
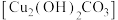 }。某同学利用下述反应实现了“铜→铜绿→……→Cu”的转化。回答下列问题:
}。某同学利用下述反应实现了“铜→铜绿→……→Cu”的转化。回答下列问题:铜
 铜绿
铜绿
(1)铜在潮湿的空气中容易产生铜绿,写出此反应的化学方程式:
(2)AB在无色火焰上灼烧时,其焰色
(3)完成步骤2和3可选用的试剂分别为
a.HCl溶液 b.NaCl溶液 c.NaOH溶液 d.
 溶液
溶液写出任一所选试剂的溶质在水溶液里的电离方程式:
您最近一年使用:0次
解题方法
3 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)一定条件下,将 通入
通入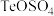 溶液中,反应一段时间后过滤、洗涤得到粗Te。
溶液中,反应一段时间后过滤、洗涤得到粗Te。
① 还原
还原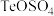 溶液得到Te的反应中,
溶液得到Te的反应中,
___________ 。
②检验沉淀是否洗涤干净的具体操作为___________ 。
③过程中须控制反应温度为80℃,适宜的加热方式为___________ ;采取该加热方式的优点为___________ 。
(2)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到有价值的单质S。反应分两步完成,如图所示,
污染,还可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。

(3)工业上常用 溶液对燃煤烟气进行脱硫。已知
溶液对燃煤烟气进行脱硫。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
, 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
①在实验室模拟脱硫过程:先加稀硫酸调节 吸收液的pH为5,再向其中通入含
吸收液的pH为5,再向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 ,则脱硫反应的离子方程式为
,则脱硫反应的离子方程式为___________ 。
②测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是___________ 。

(4) 水悬浊液吸收
水悬浊液吸收 。已知:室温下,
。已知:室温下,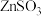 微溶于水,
微溶于水, 易溶于水;溶液中
易溶于水;溶液中 、
、 、
、 的物质的量分数随pH的分布如图1所示。向
的物质的量分数随pH的分布如图1所示。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的
,在开始吸收的 内,
内, 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是___________ (填化学式); 吸收率迅速降低阶段,主要反应的离子方程式为
吸收率迅速降低阶段,主要反应的离子方程式为___________ 。

(1)一定条件下,将
 通入
通入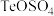 溶液中,反应一段时间后过滤、洗涤得到粗Te。
溶液中,反应一段时间后过滤、洗涤得到粗Te。①
 还原
还原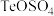 溶液得到Te的反应中,
溶液得到Te的反应中,
②检验沉淀是否洗涤干净的具体操作为
③过程中须控制反应温度为80℃,适宜的加热方式为
(2)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到有价值的单质S。反应分两步完成,如图所示,
污染,还可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(3)工业上常用
 溶液对燃煤烟气进行脱硫。已知
溶液对燃煤烟气进行脱硫。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
, 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①在实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的pH为5,再向其中通入含
吸收液的pH为5,再向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 ,则脱硫反应的离子方程式为
,则脱硫反应的离子方程式为②测得脱硫效率(即
 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
(4)
 水悬浊液吸收
水悬浊液吸收 。已知:室温下,
。已知:室温下,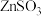 微溶于水,
微溶于水, 易溶于水;溶液中
易溶于水;溶液中 、
、 、
、 的物质的量分数随pH的分布如图1所示。向
的物质的量分数随pH的分布如图1所示。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的
,在开始吸收的 内,
内, 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是 吸收率迅速降低阶段,主要反应的离子方程式为
吸收率迅速降低阶段,主要反应的离子方程式为
您最近一年使用:0次
2023-12-13更新
|
256次组卷
|
2卷引用:江苏省百校大联考2023-2024学年高一上学期12月阶段检测化学试卷
4 . 食盐是一种重要的工业原料,可以制备多种物质。
(1)工业上用电解熔融氯化钠制取金属钠,其装置和电极上发生反应的原理示意图如图所示。

①熔融态氯化钠通电前离子的运动状态为___________ 。
②通电后阴极上发生的变化为___________ 。
③电解熔融氯化钠的化学方程式为___________ 。
(2)“候氏制碱法”是将二氧化碳通入氨化的食盐饱和溶液中,使溶解度小的碳酸氢钠从溶液中析出: 。过滤得到的碳酸氢钠晶体,经洗涤、灼烧分解后生成碳酸钠。部分物质的溶解度曲线如图所示。
。过滤得到的碳酸氢钠晶体,经洗涤、灼烧分解后生成碳酸钠。部分物质的溶解度曲线如图所示。
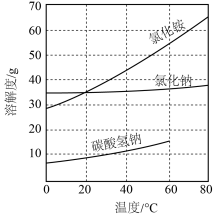
①“候氏制碱法”的原料中除NaCl外,属于电解质的是___________ 。
②碳酸氢钠晶体受热分解后生成碳酸钠的化学方程式为___________ 。
③检验 洗涤干净的操作是
洗涤干净的操作是___________ 。
④滤液中除含有大量 外,还含有少量的NaCl和
外,还含有少量的NaCl和 。设计实验方案提纯
。设计实验方案提纯 样品:
样品:___________ ,冰水洗涤,低温干燥。(实验中必须用到的试剂:盐酸)
⑤图中碳酸氢钠的溶解度在60℃后无数据的原因可能是___________ 。
(1)工业上用电解熔融氯化钠制取金属钠,其装置和电极上发生反应的原理示意图如图所示。

①熔融态氯化钠通电前离子的运动状态为
②通电后阴极上发生的变化为
③电解熔融氯化钠的化学方程式为
(2)“候氏制碱法”是将二氧化碳通入氨化的食盐饱和溶液中,使溶解度小的碳酸氢钠从溶液中析出:
 。过滤得到的碳酸氢钠晶体,经洗涤、灼烧分解后生成碳酸钠。部分物质的溶解度曲线如图所示。
。过滤得到的碳酸氢钠晶体,经洗涤、灼烧分解后生成碳酸钠。部分物质的溶解度曲线如图所示。
①“候氏制碱法”的原料中除NaCl外,属于电解质的是
②碳酸氢钠晶体受热分解后生成碳酸钠的化学方程式为
③检验
 洗涤干净的操作是
洗涤干净的操作是④滤液中除含有大量
 外,还含有少量的NaCl和
外,还含有少量的NaCl和 。设计实验方案提纯
。设计实验方案提纯 样品:
样品:⑤图中碳酸氢钠的溶解度在60℃后无数据的原因可能是
您最近一年使用:0次
5 . 化学还原稳定法是当前 水体污染修复领域的主要技术。废水中
水体污染修复领域的主要技术。废水中 主要以
主要以 和
和 形式存在,化学还原稳定法去除水中
形式存在,化学还原稳定法去除水中 主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:
主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知: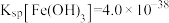 ,
,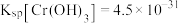 。
。
(1)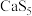 是常用的硫系还原剂,在处理
是常用的硫系还原剂,在处理 时自身转化为单质S。
时自身转化为单质S。
① 具有链状结构,其结构式可表示为
具有链状结构,其结构式可表示为_______ 。
②经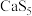 修复的水体pH明显
修复的水体pH明显_______ (填“增大”或“减小”),严重影响土壤及地下水的利用。
(2)铁系还原剂 的还原效率虽不及硫化物,但有利于Cr的固定。
的还原效率虽不及硫化物,但有利于Cr的固定。
①在酸性溶液中, 还原
还原 的离子方程式为
的离子方程式为_______ 。
②Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物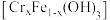 或
或 沉淀的生成;其二是
沉淀的生成;其二是_______ 。
(3)试剂联用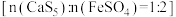 有望实现高效且稳定的修复效果。
有望实现高效且稳定的修复效果。
①待各体系充分反应后,静置2h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是_______ 。

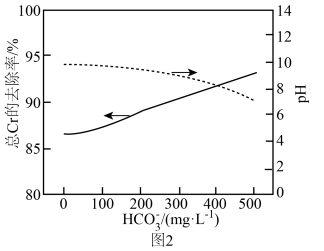
②在 存在下,试剂联用处理溶液中
存在下,试剂联用处理溶液中 ,待体系充分反应,静置2h。测得
,待体系充分反应,静置2h。测得 浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随
浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随 浓度进一步增加,总Cr的去除率明显上升的原因是
浓度进一步增加,总Cr的去除率明显上升的原因是_______ 。
③研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为_______ 。
 水体污染修复领域的主要技术。废水中
水体污染修复领域的主要技术。废水中 主要以
主要以 和
和 形式存在,化学还原稳定法去除水中
形式存在,化学还原稳定法去除水中 主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:
主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知: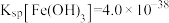 ,
,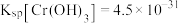 。
。(1)
 是常用的硫系还原剂,在处理
是常用的硫系还原剂,在处理 时自身转化为单质S。
时自身转化为单质S。①
 具有链状结构,其结构式可表示为
具有链状结构,其结构式可表示为②经
 修复的水体pH明显
修复的水体pH明显(2)铁系还原剂
 的还原效率虽不及硫化物,但有利于Cr的固定。
的还原效率虽不及硫化物,但有利于Cr的固定。①在酸性溶液中,
 还原
还原 的离子方程式为
的离子方程式为②Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物
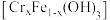 或
或 沉淀的生成;其二是
沉淀的生成;其二是(3)试剂联用
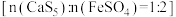 有望实现高效且稳定的修复效果。
有望实现高效且稳定的修复效果。①待各体系充分反应后,静置2h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是

②在
 存在下,试剂联用处理溶液中
存在下,试剂联用处理溶液中 ,待体系充分反应,静置2h。测得
,待体系充分反应,静置2h。测得 浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随
浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随 浓度进一步增加,总Cr的去除率明显上升的原因是
浓度进一步增加,总Cr的去除率明显上升的原因是
③研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为
您最近一年使用:0次
名校
6 . 铁的腐蚀和防护与生产、生活密切相关。已知:氢氧化物开始和完全沉淀的pH如下表(开始沉淀时,金属离子的浓度为1.0mol/L)。完成下列问题。
(1)研究铁的腐蚀。将一定量铁粉和碳粉混合后置于一密闭容器中,加入NaCl和盐酸的混合溶液。测得溶液的pH和压强随时间变化的曲线如图所示。

①容器内压强先增大后减小,除温度影响外的原因是___________ 。
②反应过程中,混合液里先生成的Fe2+会被氧化生成Fe(OH)3,反应的离子方程式为___________ 。
③700s后pH略下降,原因是___________ 。
(2)研究铁的防护。在铁表面镀锌可有效防止铁被腐蚀。
已知:溶液中Zn2+与NH3可发生反应:Zn2++nNH3 [ Zn(NH3)n]2+(n= 1~4)。某镀锌废液中含有Zn2+(<1mol/L)、Fe2+、Fe3+、
[ Zn(NH3)n]2+(n= 1~4)。某镀锌废液中含有Zn2+(<1mol/L)、Fe2+、Fe3+、 、H+等阳离子。请设计利用该电镀废液回收ZnCl2-NH4Cl溶液的实验方案:
、H+等阳离子。请设计利用该电镀废液回收ZnCl2-NH4Cl溶液的实验方案:___________ 。(实验中可选用试剂:30%H2O2、1.0mol/LNaOH溶液、1.0mol/L氨水)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀时的pH | 3.2 | 8.8 | 8.0 |

①容器内压强先增大后减小,除温度影响外的原因是
②反应过程中,混合液里先生成的Fe2+会被氧化生成Fe(OH)3,反应的离子方程式为
③700s后pH略下降,原因是
(2)研究铁的防护。在铁表面镀锌可有效防止铁被腐蚀。
已知:溶液中Zn2+与NH3可发生反应:Zn2++nNH3
 [ Zn(NH3)n]2+(n= 1~4)。某镀锌废液中含有Zn2+(<1mol/L)、Fe2+、Fe3+、
[ Zn(NH3)n]2+(n= 1~4)。某镀锌废液中含有Zn2+(<1mol/L)、Fe2+、Fe3+、 、H+等阳离子。请设计利用该电镀废液回收ZnCl2-NH4Cl溶液的实验方案:
、H+等阳离子。请设计利用该电镀废液回收ZnCl2-NH4Cl溶液的实验方案:
您最近一年使用:0次
名校
解题方法
7 . 含铬废水中通常含有Cr(Ⅵ),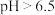 时主要以
时主要以 形式存在,
形式存在,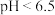 时主要以
时主要以 、
、 形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
(1)酸性条件下,加入 溶液能将Cr(Ⅵ)还原为
溶液能将Cr(Ⅵ)还原为 ,再加碱沉淀出
,再加碱沉淀出 。
。 将
将 还原为
还原为 的离子方程式为
的离子方程式为___________ 。
(2)将含Cr(Ⅵ)废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的 ,将Cr(Ⅵ)还原为
,将Cr(Ⅵ)还原为 ,并生成
,并生成 和
和 。
。
①加入NaCl固体的目的是___________ 。
②电解过程中能生成 和
和 的原因是
的原因是___________ 。
③上述电解过程不能用石墨电极取代铁电极的原因是___________ 。
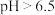 时主要以
时主要以 形式存在,
形式存在,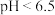 时主要以
时主要以 、
、 形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。(1)酸性条件下,加入
 溶液能将Cr(Ⅵ)还原为
溶液能将Cr(Ⅵ)还原为 ,再加碱沉淀出
,再加碱沉淀出 。
。 将
将 还原为
还原为 的离子方程式为
的离子方程式为(2)将含Cr(Ⅵ)废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的
 ,将Cr(Ⅵ)还原为
,将Cr(Ⅵ)还原为 ,并生成
,并生成 和
和 。
。①加入NaCl固体的目的是
②电解过程中能生成
 和
和 的原因是
的原因是③上述电解过程不能用石墨电极取代铁电极的原因是
您最近一年使用:0次
解题方法
8 . 根据提供的情境书写指定反应的方程式。
一种以 为原料制取
为原料制取 的流程如图所示,450℃,
的流程如图所示,450℃, 在空气中灼烧得到三种锰的氧化物,锰元素所占比例随温度变化的曲线如图所示。
在空气中灼烧得到三种锰的氧化物,锰元素所占比例随温度变化的曲线如图所示。


(1)写出450℃, 在空气中灼烧生成主要产物的化学方程式:
在空气中灼烧生成主要产物的化学方程式:___________ 。
(2)写出“浸取”时 发生反应的离子方程式:
发生反应的离子方程式:___________ 。
一种以
 为原料制取
为原料制取 的流程如图所示,450℃,
的流程如图所示,450℃, 在空气中灼烧得到三种锰的氧化物,锰元素所占比例随温度变化的曲线如图所示。
在空气中灼烧得到三种锰的氧化物,锰元素所占比例随温度变化的曲线如图所示。

(1)写出450℃,
 在空气中灼烧生成主要产物的化学方程式:
在空气中灼烧生成主要产物的化学方程式:(2)写出“浸取”时
 发生反应的离子方程式:
发生反应的离子方程式:
您最近一年使用:0次
名校
9 . 氮氧化物对环境的污染及防治是化学研究的热点之一。请回答下列问题:
(1)汽车尾气中的 、
、 (氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
(氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式:
还原的化学方程式:_____ 。
(2)用氨气可以将氮氧化物转化为无毒气体,如 ,
,
①对该反应来说,每生成10个氮气分子,参与反应的氧化剂与还原剂的质量之比是______ (填最简整数比)。
②写出氨气将 转化为无毒气体的化学方程式:
转化为无毒气体的化学方程式:________________________ 。
(3)工业尾气中的氮氧化物常采用碱液吸收法处理。
 与
与 按计量数之比
按计量数之比 被足量
被足量 溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式
溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式______ 。
Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
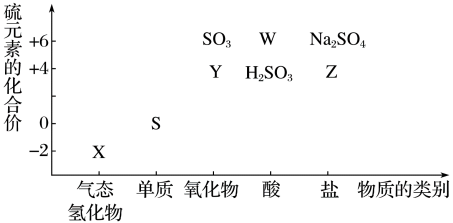
(4)X的化学式为____________ 。
(5)欲制备 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是______ (填字母)。
A B.
B. C.
C. D.
D.
(6)工业上常用以下反应炼铁和制硫酸:
①
②
已知 中
中 为
为 价,
价, 中
中 为
为 价。则反应①的氧化产物为
价。则反应①的氧化产物为______ (填化学式);当反应①、②生成数量相等的 分子时,转移的电子数之比为
分子时,转移的电子数之比为____________ (填最简整数比)。
(1)汽车尾气中的
 、
、 (氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出
(氮氧化物)在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出 被
被 还原的化学方程式:
还原的化学方程式:(2)用氨气可以将氮氧化物转化为无毒气体,如
 ,
,①对该反应来说,每生成10个氮气分子,参与反应的氧化剂与还原剂的质量之比是
②写出氨气将
 转化为无毒气体的化学方程式:
转化为无毒气体的化学方程式:(3)工业尾气中的氮氧化物常采用碱液吸收法处理。
 与
与 按计量数之比
按计量数之比 被足量
被足量 溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式
溶液完全吸收后只得到一种钠盐,试写出该钠盐的化学式Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(4)X的化学式为
(5)欲制备
 ,从氧化还原角度分析,合理的是
,从氧化还原角度分析,合理的是A
 B.
B. C.
C. D.
D.
(6)工业上常用以下反应炼铁和制硫酸:
①

②

已知
 中
中 为
为 价,
价, 中
中 为
为 价。则反应①的氧化产物为
价。则反应①的氧化产物为 分子时,转移的电子数之比为
分子时,转移的电子数之比为
您最近一年使用:0次
名校
解题方法
10 . 纯过氧化氢(H2O2,俗称双氧水)是淡蓝色的粘稠液体,可任意比例与水混溶。双氧水在医疗以及生产、生活中有广泛的应用。请分析在下列反应中,H2O2的作用(填写“氧化剂”或“还原剂”),并用单线桥标出反应过程中电子转移方向和数目。
(1)双氧水在氧化剂的作用下,可定量地产生O2,这在分析化学中,具有重要的意义。
___________ 。反应中,H2O2在反应中的作用是___________ 。
(2)双氧水曾在文艺复兴时期的油画修复中发挥很大的作用。其中发生的反应是:
___________ 。反应中,H2O2在反应中的作用是___________ 。
(3)稀释以后的双氧水常用于医疗中的杀菌消毒,使用过程中可见有气体产生,涉及到的反应有:
___________ 。H2O2在反应中的作用是___________ 。
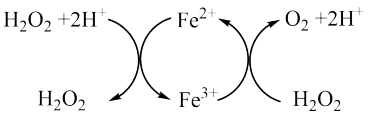
(4)将双氧水滴加到FeCl3溶液中,也会产生有趣的现象。
虽说H2O2可以将Fe2+氧化为Fe3+,可是反应中依然有气体生成。研究表明,在此主要涉及到Fe2+、Fe3+和H2O2发生的循环反应(如图)。请根据图示,写出两个相应反应的离子方程式。___________ 、___________
(1)双氧水在氧化剂的作用下,可定量地产生O2,这在分析化学中,具有重要的意义。

(2)双氧水曾在文艺复兴时期的油画修复中发挥很大的作用。其中发生的反应是:

(3)稀释以后的双氧水常用于医疗中的杀菌消毒,使用过程中可见有气体产生,涉及到的反应有:

(4)将双氧水滴加到FeCl3溶液中,也会产生有趣的现象。
虽说H2O2可以将Fe2+氧化为Fe3+,可是反应中依然有气体生成。研究表明,在此主要涉及到Fe2+、Fe3+和H2O2发生的循环反应(如图)。请根据图示,写出两个相应反应的离子方程式。

您最近一年使用:0次



