名校
1 . 下表列出了五种燃煤烟气脱硫的方法。
(1)方法Ⅰ中吸收 后的溶液通过
后的溶液通过___________ (填字母)可使吸收液再生。
a.加热 b.加入适量NaOH c.通入
(2)方法Ⅱ中CO还原 反应的化学方程式为
反应的化学方程式为___________ 。
(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充___________ 。
(4)方法Ⅳ按如图所示方式,将含有 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。___________ 。
②反应釜中采用“气-液逆流”接触吸收法的优点是___________ 。
(5)工业上方法Ⅴ的转化流程如下:___________ 。
②若用NaOH溶液代替 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止___________ 。
| 方法Ⅰ | 用 溶液吸收 溶液吸收 |
| 方法Ⅱ | 用生物质热解气(主要成分为CO、 、 、 )将 )将 在高温下还原成S 在高温下还原成S |
| 方法Ⅲ | 用 溶液吸收 溶液吸收 |
| 方法Ⅳ | 用NaClO碱性溶液吸收 |
| 方法Ⅴ | 石灰-石膏法吸收 |
(1)方法Ⅰ中吸收
 后的溶液通过
后的溶液通过a.加热 b.加入适量NaOH c.通入

(2)方法Ⅱ中CO还原
 反应的化学方程式为
反应的化学方程式为(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于
 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充(4)方法Ⅳ按如图所示方式,将含有
 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。
②反应釜中采用“气-液逆流”接触吸收法的优点是
(5)工业上方法Ⅴ的转化流程如下:

②若用NaOH溶液代替
 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止
您最近一年使用:0次
2024-01-24更新
|
314次组卷
|
2卷引用:江苏省连云港市2023-2024学年高一上学期期末调研考试化学试题
2 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
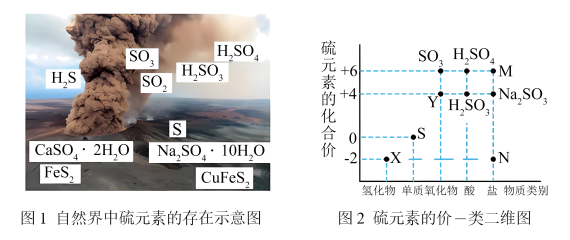
(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与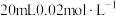 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)过二硫酸钠
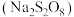 有强氧化性,在碱性条件下
有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(6)雌黄
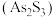 和雄黄
和雄黄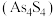 在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。
在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若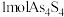 参加反应时,转移
参加反应时,转移 电子,则物质
电子,则物质 为
为
您最近一年使用:0次
名校
3 . 回答下列问题:
(一)下列物质中:①漂白粉固体 ② 固体 ③
固体 ③ 固体 ④熔融
固体 ④熔融 ⑤食醋⑥
⑤食醋⑥ 片 ⑦
片 ⑦ ⑧盐酸 ⑨石墨 ⑩
⑧盐酸 ⑨石墨 ⑩ 葡萄糖(填序号)
葡萄糖(填序号)
(1)以上物质中属于强电解质且能导电的是___________________________ ;
(2)以上物质中属于非电解质的是___________________________ ;
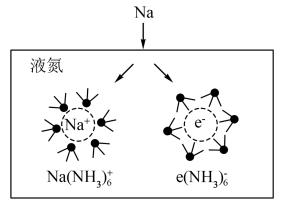
(二)氨基钠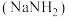 是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子 和蓝色的氨合电子
和蓝色的氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
(3)导电性:蓝色溶液____________ 液氨(填“>、<、=”)
(4)将 钠投入液氨中,得到
钠投入液氨中,得到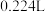 (标准状况下)
(标准状况下) ,与液氨反应产生
,与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为______________ 。
(5)钠与液氨反应方程式为:________________________________________ 。
(一)下列物质中:①漂白粉固体 ②
 固体 ③
固体 ③ 固体 ④熔融
固体 ④熔融 ⑤食醋⑥
⑤食醋⑥ 片 ⑦
片 ⑦ ⑧盐酸 ⑨石墨 ⑩
⑧盐酸 ⑨石墨 ⑩ 葡萄糖(填序号)
葡萄糖(填序号)(1)以上物质中属于强电解质且能导电的是
(2)以上物质中属于非电解质的是
(二)氨基钠
 是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子 和蓝色的氨合电子
和蓝色的氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
(3)导电性:蓝色溶液
(4)将
 钠投入液氨中,得到
钠投入液氨中,得到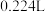 (标准状况下)
(标准状况下) ,与液氨反应产生
,与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为(5)钠与液氨反应方程式为:
您最近一年使用:0次
4 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用 溶液实现“碳捕获”的技术的装置如图:
溶液实现“碳捕获”的技术的装置如图:
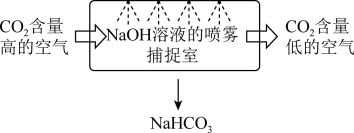
①在整个“捕捉”过程中,发生的离子反应方程式_______ ,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为________ 。
②下列溶液中,同样能用于“捕捉”二氧化碳的是_________ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(2)科学家提出用 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C.用
制取C.用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C.已知第二步反应为:
制取C.已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原 制
制 。则每生成
。则每生成 (标准状况下)
(标准状况下) 的过程中电子转移的物质的量为
的过程中电子转移的物质的量为___________ 。
(4)科研人员发现 捕获和转化还可以通过如下途径实现,其原理如图所示。
捕获和转化还可以通过如下途径实现,其原理如图所示。
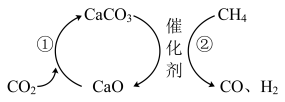
请用必要的化学用语和文字描述上述捕获和转化过程:___________ 。
(1)某校科研人员利用
 溶液实现“碳捕获”的技术的装置如图:
溶液实现“碳捕获”的技术的装置如图:
①在整个“捕捉”过程中,发生的离子反应方程式
 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为②下列溶液中,同样能用于“捕捉”二氧化碳的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(2)科学家提出用
 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C.用
制取C.用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C.已知第二步反应为:
制取C.已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原
 制
制 。则每生成
。则每生成 (标准状况下)
(标准状况下) 的过程中电子转移的物质的量为
的过程中电子转移的物质的量为(4)科研人员发现
 捕获和转化还可以通过如下途径实现,其原理如图所示。
捕获和转化还可以通过如下途径实现,其原理如图所示。
请用必要的化学用语和文字描述上述捕获和转化过程:
您最近一年使用:0次
名校
5 . Ⅰ.分类法是进行化学研究的重要方法。不同的标准可以把事物分为不同的类别。现有以下物质:
①固体NaHCO3②Fe③CaCO3④Fe(OH)3胶体⑤熔融的NaHSO4⑥干冰⑦稀盐酸⑧蔗糖
(1)以上物质中属于强电解质的是______ (填序号);
(2)写出①在水溶液中的电离方程式______ ;
(3)④的实验室制备:向沸水中滴加几滴______ 溶液,加热至液体呈红褐色,停止加热。
Ⅱ.空气质量与我们的生活息息相关。SO2是主要的大气污染物之一。
(4)SO2属于______ (填“酸性”或“碱性”)氧化物。
(5)将SO2气体通入蒸馏水中,取部分溶液用pH计测定其pH,每隔10min读数一次,随着时间推移,pH逐渐变小的原因是______ 。(用化学方程式表示)
(6)下列反应中,能用同一离子方程式表示的有______(填序号)。
①固体NaHCO3②Fe③CaCO3④Fe(OH)3胶体⑤熔融的NaHSO4⑥干冰⑦稀盐酸⑧蔗糖
(1)以上物质中属于强电解质的是
(2)写出①在水溶液中的电离方程式
(3)④的实验室制备:向沸水中滴加几滴
Ⅱ.空气质量与我们的生活息息相关。SO2是主要的大气污染物之一。
(4)SO2属于
(5)将SO2气体通入蒸馏水中,取部分溶液用pH计测定其pH,每隔10min读数一次,随着时间推移,pH逐渐变小的原因是
(6)下列反应中,能用同一离子方程式表示的有______(填序号)。
| A.Ca(OH)2和稀CH3COOH | B.NaOH和稀H2SO4 |
| C.Ba(OH)2与稀HNO3 | D.Ba(OH)2与稀H2SO4 |
您最近一年使用:0次
名校
6 . 根据要求,写出化学方程式或者离子方程式;
(1)氯气和石灰乳反应制取漂白粉的化学方程式___________ ;
(2)过氧化钠和水反应的化学方程式___________ ;
(3)写出 和足量
和足量 反应的离子方程式
反应的离子方程式___________ ;
(4)碘盐中的 和
和 在稀硫酸溶液中发生反应的离子方程式
在稀硫酸溶液中发生反应的离子方程式___________ ;
(5)工业上用黄铁矿制硫酸第一步,在沸腾炉中发生反应的化学方程式___________ ;
(6)铜和浓硫酸加热反应的化学方程式___________ 。
(1)氯气和石灰乳反应制取漂白粉的化学方程式
(2)过氧化钠和水反应的化学方程式
(3)写出
 和足量
和足量 反应的离子方程式
反应的离子方程式(4)碘盐中的
 和
和 在稀硫酸溶液中发生反应的离子方程式
在稀硫酸溶液中发生反应的离子方程式(5)工业上用黄铁矿制硫酸第一步,在沸腾炉中发生反应的化学方程式
(6)铜和浓硫酸加热反应的化学方程式
您最近一年使用:0次
7 . “2060年实现碳中和”的目标提出之后, 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。

(1)HCOOH是有机物,分子中所含官能团的名称为___________ 。
(2)将 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要___________ 能量(填“吸收”或“放出”)。
(3)一定条件下, 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为___________ 。
 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。
(1)HCOOH是有机物,分子中所含官能团的名称为
(2)将
 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要(3)一定条件下,
 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
您最近一年使用:0次
2024-01-12更新
|
203次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
8 . 二氧化碳的捕集和利用是我国能源领域实现碳达峰、碳中和目标的一个重要研究方向。
(1)某校科研人员利用 溶液实现“碳捕获”技术的装置如图,若实现
溶液实现“碳捕获”技术的装置如图,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为___________ 。

(2)科学家提出用 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C。用
制取C。用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C,已知第二步反应为:
制取C,已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为___________ 。
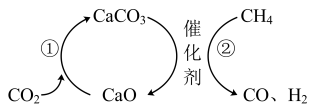
(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原 制CO,如图,每生成
制CO,如图,每生成 (标准状况下)CO的过程中电子转移的物质的量为
(标准状况下)CO的过程中电子转移的物质的量为___________ 。
(1)某校科研人员利用
 溶液实现“碳捕获”技术的装置如图,若实现
溶液实现“碳捕获”技术的装置如图,若实现 溶液的循环利用,可采取的措施为
溶液的循环利用,可采取的措施为
(2)科学家提出用
 作催化剂,利用太阳能热化学循环分解
作催化剂,利用太阳能热化学循环分解 制取C。用
制取C。用 作催化剂,通过两步反应分解
作催化剂,通过两步反应分解 制取C,已知第二步反应为:
制取C,已知第二步反应为: ,则第一步反应的化学方程式为
,则第一步反应的化学方程式为(3)大连化学物理研究所人员最新研究发现,氮掺杂碳材料具有良好的导电性和易于调变的电子特性,可以很好地电催化还原
 制CO,如图,每生成
制CO,如图,每生成 (标准状况下)CO的过程中电子转移的物质的量为
(标准状况下)CO的过程中电子转移的物质的量为
您最近一年使用:0次
名校
解题方法
9 . 人们在认识自然的过程中所形成的化学知识和观念,都始于对实验的观察、想象和思考.
(1)两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的 溶液和
溶液和 溶液,实验中发现加入
溶液,实验中发现加入 水的试管中溶液迅速变为蓝色,而加入
水的试管中溶液迅速变为蓝色,而加入 溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到
溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到 和
和 的混合溶液中,首先发生的离子反应为
的混合溶液中,首先发生的离子反应为__________________________________ ,由此可以推知,将等物质的量的 与
与 在溶液中反应,发生反应的离子方程式为
在溶液中反应,发生反应的离子方程式为_________________ .
(2)①将5mL饱和 (滴有酚酞试液)溶液迅速滴加到充满
(滴有酚酞试液)溶液迅速滴加到充满 气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为
气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为_________________ .
②两支试管中分别放有 固体,现向两支试管中分别加入等体积(约10mL)的水和饱和
固体,现向两支试管中分别加入等体积(约10mL)的水和饱和 溶液振荡,两试管中
溶液振荡,两试管中 固体均完全溶解且有放热的现象,同时加入
固体均完全溶解且有放热的现象,同时加入 饱和溶液的试管的温度明显高于加水的试管,可见
饱和溶液的试管的温度明显高于加水的试管,可见 固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应_________________
(1)两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的
 溶液和
溶液和 溶液,实验中发现加入
溶液,实验中发现加入 水的试管中溶液迅速变为蓝色,而加入
水的试管中溶液迅速变为蓝色,而加入 溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到
溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到 和
和 的混合溶液中,首先发生的离子反应为
的混合溶液中,首先发生的离子反应为 与
与 在溶液中反应,发生反应的离子方程式为
在溶液中反应,发生反应的离子方程式为(2)①将5mL饱和
 (滴有酚酞试液)溶液迅速滴加到充满
(滴有酚酞试液)溶液迅速滴加到充满 气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为
气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为②两支试管中分别放有
 固体,现向两支试管中分别加入等体积(约10mL)的水和饱和
固体,现向两支试管中分别加入等体积(约10mL)的水和饱和 溶液振荡,两试管中
溶液振荡,两试管中 固体均完全溶解且有放热的现象,同时加入
固体均完全溶解且有放热的现象,同时加入 饱和溶液的试管的温度明显高于加水的试管,可见
饱和溶液的试管的温度明显高于加水的试管,可见 固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
您最近一年使用:0次
名校
10 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为3ClO-+2Fe3++xOH-=2 +3Cl-+yH2O。
+3Cl-+yH2O。
(1)上述反应中的x=___________ ,y=___________ 。
(2)上述反应中氧化剂为___________ ;还原产物为___________ 。
(3)由上述反应可知,氧化性强弱:ClO-___________  (填“>”或“<”,下同);还原性强弱:Cl-
(填“>”或“<”,下同);还原性强弱:Cl-_________ Fe3+。
(4)请用单线桥法表示该反应中电子的转移情况:___________ 。
 +3Cl-+yH2O。
+3Cl-+yH2O。(1)上述反应中的x=
(2)上述反应中氧化剂为
(3)由上述反应可知,氧化性强弱:ClO-
 (填“>”或“<”,下同);还原性强弱:Cl-
(填“>”或“<”,下同);还原性强弱:Cl-(4)请用单线桥法表示该反应中电子的转移情况:
您最近一年使用:0次



