名校
1 . 以软锰矿(含 及少量
及少量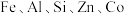 的氧化物)为主要原料可制备
的氧化物)为主要原料可制备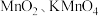 等。制备
等。制备 的实验流程如下:
的实验流程如下: 生成
生成 的离子方程式为
的离子方程式为_______ 。
(2)已知 时,
时,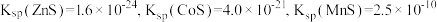 。取一定量“除
。取一定量“除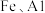 ”后的酸性滤液,分析其中
”后的酸性滤液,分析其中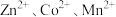 的含量
的含量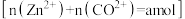 后,加入一定量
后,加入一定量 充分反应,测得金属的沉淀率随加入
充分反应,测得金属的沉淀率随加入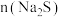 的变化如图所示。
的变化如图所示。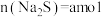 时,测得溶液中
时,测得溶液中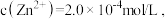 此时
此时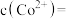
_______ 。
②当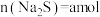 时,
时, 和
和 未完全沉淀的原因是
未完全沉淀的原因是_______ 。
(3)将一定量的 与稍过量
与稍过量 混合熔融,再分批加入一定量
混合熔融,再分批加入一定量 ,在加热条件下迅速搅拌制得墨绿色
,在加热条件下迅速搅拌制得墨绿色 。已知向
。已知向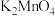 碱性溶液中加酸会生成
碱性溶液中加酸会生成 和
和 在
在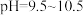 时,反应趋于完全。
时,反应趋于完全。 混合熔融时不能选用瓷坩埚的原因是
混合熔融时不能选用瓷坩埚的原因是_______ 。
(4)测定 粗品的纯度。称取
粗品的纯度。称取 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量 溶液。盖上玻璃塞,充分摇匀后静置
溶液。盖上玻璃塞,充分摇匀后静置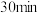 。用
。用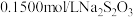 标准溶液滴定生成的
标准溶液滴定生成的 消耗
消耗 标准溶液
标准溶液 。滴定反应为
。滴定反应为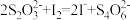 。计算粗品中
。计算粗品中 的质量分数
的质量分数_______ (写出计算过程)。
 及少量
及少量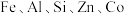 的氧化物)为主要原料可制备
的氧化物)为主要原料可制备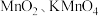 等。制备
等。制备 的实验流程如下:
的实验流程如下:
 生成
生成 的离子方程式为
的离子方程式为(2)已知
 时,
时,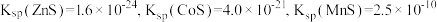 。取一定量“除
。取一定量“除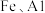 ”后的酸性滤液,分析其中
”后的酸性滤液,分析其中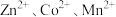 的含量
的含量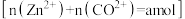 后,加入一定量
后,加入一定量 充分反应,测得金属的沉淀率随加入
充分反应,测得金属的沉淀率随加入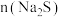 的变化如图所示。
的变化如图所示。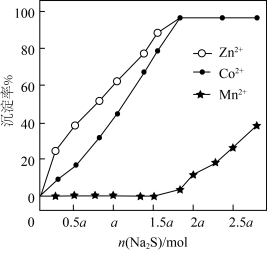
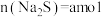 时,测得溶液中
时,测得溶液中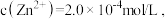 此时
此时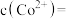
②当
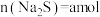 时,
时, 和
和 未完全沉淀的原因是
未完全沉淀的原因是(3)将一定量的
 与稍过量
与稍过量 混合熔融,再分批加入一定量
混合熔融,再分批加入一定量 ,在加热条件下迅速搅拌制得墨绿色
,在加热条件下迅速搅拌制得墨绿色 。已知向
。已知向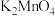 碱性溶液中加酸会生成
碱性溶液中加酸会生成 和
和 在
在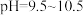 时,反应趋于完全。
时,反应趋于完全。 混合熔融时不能选用瓷坩埚的原因是
混合熔融时不能选用瓷坩埚的原因是(4)测定
 粗品的纯度。称取
粗品的纯度。称取 粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量
粗品置于具塞锥形瓶中,加水润湿后,依次加入足量稀硫酸和过量 溶液。盖上玻璃塞,充分摇匀后静置
溶液。盖上玻璃塞,充分摇匀后静置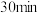 。用
。用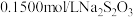 标准溶液滴定生成的
标准溶液滴定生成的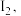 消耗
消耗 标准溶液
标准溶液 。滴定反应为
。滴定反应为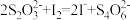 。计算粗品中
。计算粗品中 的质量分数
的质量分数
您最近一年使用:0次
2 . 以软锰矿[主要成分为MnO2,还含有钙镁碳酸盐及少量的有机物(C12H22O11)]为原料制备硫酸锰,进而进一步制备Mn3O4。
(1)制备硫酸锰的流程如下:
①写出用硝酸“酸洗”时,有机物与MnO2反应生成CO2的离子方程式___________ 。
②工业上常采用硝酸酸洗而不采用磷酸酸洗的主要原因是___________ 。
③控制反应温度和SO2流速一定,反应2小时,测得“还原”时锰元素的回收率与“制浆”时液固比的关系如图所示。液固比为20∶1浆料中锰元素回收率低于液固比为10∶1的浆料,原因是___________ 。___________ 。pH在4~6范围内,随溶液pH增大,MnS2O6的生成速率减小,其主要原因是___________ 。
(2)已知:pH在6.4~7.6范围内,MnSO4可被氧气直接氧化得到Mn3O4.实际工业生产时,先向MnSO4溶液中通入氨气生成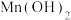 沉淀,再将
沉淀,再将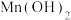 氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。
氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。___________ 。
②实际工业生产中,当氨气超过30mL时,Mn2+的沉淀率下降的主要原因是___________ 。
(1)制备硫酸锰的流程如下:
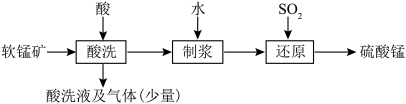
①写出用硝酸“酸洗”时,有机物与MnO2反应生成CO2的离子方程式
②工业上常采用硝酸酸洗而不采用磷酸酸洗的主要原因是
③控制反应温度和SO2流速一定,反应2小时,测得“还原”时锰元素的回收率与“制浆”时液固比的关系如图所示。液固比为20∶1浆料中锰元素回收率低于液固比为10∶1的浆料,原因是

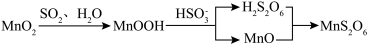
(2)已知:pH在6.4~7.6范围内,MnSO4可被氧气直接氧化得到Mn3O4.实际工业生产时,先向MnSO4溶液中通入氨气生成
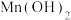 沉淀,再将
沉淀,再将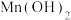 氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。
氧化得到Mn3O4,其他条件一定时,Mn2+的沉淀率随氨气通入量的变化如图所示。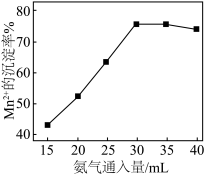
②实际工业生产中,当氨气超过30mL时,Mn2+的沉淀率下降的主要原因是
您最近一年使用:0次
解题方法
3 . CrCl3易溶于水和乙醇,难溶于乙醚,在潮湿空气中易形成CrCl3·6H2O,高温下易被O2氧化。
(1)制备无水CrCl3.实验室用Cr2O3和CCl4在高温下制备无水CrCl3的实验装置如下(加热、夹持及尾气处理装置略去):___________ 。
②若实验过程中管式炉发生堵塞,出现的实验现象是___________ 。
③补充完整实验结束时的操作:停止加热管式炉,撤去水浴装置,___________ ,打开管式炉取出产品。
(2)测定无水CrCl3样品的纯度。准确称取0.2000g样品,配成250mL溶液。取25.00mL溶液于碘量瓶中,加热至沸腾后,加适量NaOH溶液,生成 沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知:
沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知: 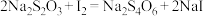 。
。
① 与H2O2反应的离子方程式为
与H2O2反应的离子方程式为___________ 。
②样品中无水CrCl3的质量分数为___________ (写出计算过程)。
(3)补充完整用含铬污泥[含 、
、 及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,
及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,___________ ,抽滤,干燥,得到CrCl3·6H2O晶体。[已知: 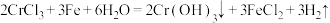 。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
(1)制备无水CrCl3.实验室用Cr2O3和CCl4在高温下制备无水CrCl3的实验装置如下(加热、夹持及尾气处理装置略去):
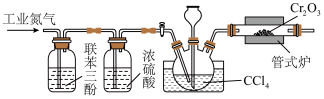
②若实验过程中管式炉发生堵塞,出现的实验现象是
③补充完整实验结束时的操作:停止加热管式炉,撤去水浴装置,
(2)测定无水CrCl3样品的纯度。准确称取0.2000g样品,配成250mL溶液。取25.00mL溶液于碘量瓶中,加热至沸腾后,加适量NaOH溶液,生成
 沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知:
沉淀。冷却后,加足量H2O2至沉淀完全转化为Na2CrO4加热煮沸一段时间,冷却后加入稀H2SO4,再加入足量KI溶液,充分反应后生成Cr3+和I2.用0.02500mol⋅L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液12.00mL。已知: 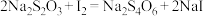 。
。①
 与H2O2反应的离子方程式为
与H2O2反应的离子方程式为②样品中无水CrCl3的质量分数为
(3)补充完整用含铬污泥[含
 、
、 及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤,
及不溶于酸的杂质]制备CrCl3⋅6H2O晶体的实验方案:向含铬污泥中缓慢加入盐酸使固体充分反应,过滤, 。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
。实验中须使用的试剂:铁粉、盐酸、硝酸酸化的硝酸银溶液、蒸馏水、乙醚]
您最近一年使用:0次
4 . 以钛白副产品(含 及少量
及少量 )和
)和 为原料制备的超微细
为原料制备的超微细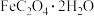 ,可广泛用于新型电池材料、感光材料的生产。
,可广泛用于新型电池材料、感光材料的生产。
已知:①25℃时,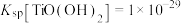 ;
;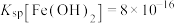 ;
;
②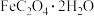 不溶于水,溶于硫酸。
不溶于水,溶于硫酸。
③沉淀速度过快,沉淀的粒径会变大,包裹的杂质会变多。
(1)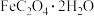 的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到
的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到 溶液。在搅拌下先后加入氨水和草酸溶液,经
溶液。在搅拌下先后加入氨水和草酸溶液,经 调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。
调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。
①加入还原铁粉的作用是___________ ;
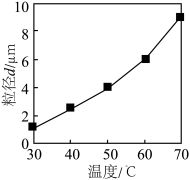
②温度对沉淀粒径的影响如图,加入氨水和草酸溶液过程需控制温度在40℃的原因是___________ ;___________ 。 的结构。
的结构。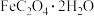 晶体为片层结构,层内每个
晶体为片层结构,层内每个 与2个
与2个 和2个
和2个 相连,形成1个铁氧八面体。在图中补全该结构
相连,形成1个铁氧八面体。在图中补全该结构___________ 。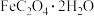 晶体层与层之间的作用力为
晶体层与层之间的作用力为___________ 。 的性质。将
的性质。将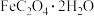 在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率=
在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率= ]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式:
]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式:___________ 。
 及少量
及少量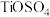 )和
)和 为原料制备的超微细
为原料制备的超微细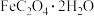 ,可广泛用于新型电池材料、感光材料的生产。
,可广泛用于新型电池材料、感光材料的生产。已知:①25℃时,
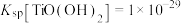 ;
;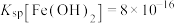 ;
;②
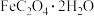 不溶于水,溶于硫酸。
不溶于水,溶于硫酸。③沉淀速度过快,沉淀的粒径会变大,包裹的杂质会变多。
(1)
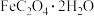 的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到
的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,反应后pH为4~5,过滤得到 溶液。在搅拌下先后加入氨水和草酸溶液,经
溶液。在搅拌下先后加入氨水和草酸溶液,经 调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。
调节pH、过滤、水洗、烘干后得到超微细FeC2O4·2H2O。①加入还原铁粉的作用是
②温度对沉淀粒径的影响如图,加入氨水和草酸溶液过程需控制温度在40℃的原因是
 的结构。
的结构。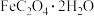 晶体为片层结构,层内每个
晶体为片层结构,层内每个 与2个
与2个 和2个
和2个 相连,形成1个铁氧八面体。在图中补全该结构
相连,形成1个铁氧八面体。在图中补全该结构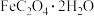 晶体层与层之间的作用力为
晶体层与层之间的作用力为
 的性质。将
的性质。将 在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率=
在氮气的氛围中加热分解。加热过程中固体残留率[固体残留率= ]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式:
]随温度的变化如图所示,B点时,固体只含有一种铁的氧化物,则AB段发生反应的化学方程式: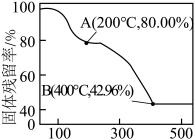
您最近一年使用:0次
5 .  和
和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)碱液吸收。将硝酸工业的尾气(主要为 和
和 )通入
)通入 溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到
溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到 晶体。
晶体。
① 和
和 混合气体与
混合气体与 溶液反应生成
溶液反应生成 的离子方程式为
的离子方程式为______ .
②若使用 溶液代替
溶液代替 溶液,所得晶体中除含有
溶液,所得晶体中除含有 外,还有
外,还有______ (填化学式)。
(2)催化还原。汽车的尾气净化装置如图所示,在催化剂表面上 与
与 反应生成
反应生成 ,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是
,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是______ . 与
与 均转化为
均转化为 ,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。
,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。______ 。
②为使电池持续放电,离子交换膜应为______ 离子交换膜(填“阳”或“阴”)。
(4) 的氧化。已知
的氧化。已知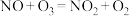 。室温下,固定进入反应器
。室温下,固定进入反应器 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中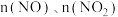 随反应前
随反应前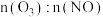 的变化如图所示。当
的变化如图所示。当 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是______ .
 和
和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。(1)碱液吸收。将硝酸工业的尾气(主要为
 和
和 )通入
)通入 溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到
溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到 晶体。
晶体。①
 和
和 混合气体与
混合气体与 溶液反应生成
溶液反应生成 的离子方程式为
的离子方程式为②若使用
 溶液代替
溶液代替 溶液,所得晶体中除含有
溶液,所得晶体中除含有 外,还有
外,还有(2)催化还原。汽车的尾气净化装置如图所示,在催化剂表面上
 与
与 反应生成
反应生成 ,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是
,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是
 与
与 均转化为
均转化为 ,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。
,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。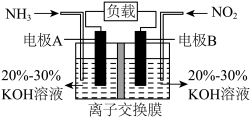
②为使电池持续放电,离子交换膜应为
(4)
 的氧化。已知
的氧化。已知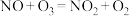 。室温下,固定进入反应器
。室温下,固定进入反应器 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中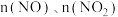 随反应前
随反应前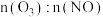 的变化如图所示。当
的变化如图所示。当 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是
您最近一年使用:0次
名校
6 . 粗铜精炼的副产品铜阳极泥中含有Au、Ag、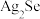 、
、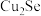 等物质,其含量远高于常规开采的矿石,是提取稀贵金属和硒的重要原料,其中一种分离提取的工艺流程如下:
等物质,其含量远高于常规开采的矿石,是提取稀贵金属和硒的重要原料,其中一种分离提取的工艺流程如下: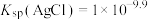
②常温下, 的平衡常数
的平衡常数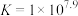
(1)Se与O同族,其基态原子价层电子的运动状态有___________ 种。
(2)“蒸硒”时将铜阳极泥与浓硫酸混合于450~500℃下焙烧,浓硫酸将硒元素氧化为 并蒸出,写出
并蒸出,写出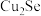 与浓硫酸反应的化学方程式
与浓硫酸反应的化学方程式___________ 。
(3)“分金”时应控制 的用量,原因是为了减少
的用量,原因是为了减少___________ (填化学式)的产生。
(4)“分银”原理为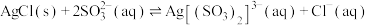 ,常温下该反应的平衡常数为
,常温下该反应的平衡常数为___________ ,若加入1L 溶液充分溶解0.1mol AgCl,理论上
溶液充分溶解0.1mol AgCl,理论上 溶液的浓度须达到
溶液的浓度须达到___________ mol/L(忽略溶解前后溶液的体积变化)。
(5)将滤液2返回“分银”工序循环使用,发现循环多次后银浸出率降低,可能的原因是___________ 。
(6)①粗银电解精炼时需控制电解液的pH为1.5~2,其原因是___________ 。
②银的晶胞结构如图所示,则银原子的配位数是___________ 。
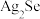 、
、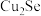 等物质,其含量远高于常规开采的矿石,是提取稀贵金属和硒的重要原料,其中一种分离提取的工艺流程如下:
等物质,其含量远高于常规开采的矿石,是提取稀贵金属和硒的重要原料,其中一种分离提取的工艺流程如下:
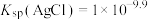
②常温下,
 的平衡常数
的平衡常数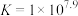
(1)Se与O同族,其基态原子价层电子的运动状态有
(2)“蒸硒”时将铜阳极泥与浓硫酸混合于450~500℃下焙烧,浓硫酸将硒元素氧化为
 并蒸出,写出
并蒸出,写出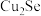 与浓硫酸反应的化学方程式
与浓硫酸反应的化学方程式(3)“分金”时应控制
 的用量,原因是为了减少
的用量,原因是为了减少(4)“分银”原理为
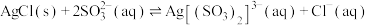 ,常温下该反应的平衡常数为
,常温下该反应的平衡常数为 溶液充分溶解0.1mol AgCl,理论上
溶液充分溶解0.1mol AgCl,理论上 溶液的浓度须达到
溶液的浓度须达到(5)将滤液2返回“分银”工序循环使用,发现循环多次后银浸出率降低,可能的原因是
(6)①粗银电解精炼时需控制电解液的pH为1.5~2,其原因是
②银的晶胞结构如图所示,则银原子的配位数是

您最近一年使用:0次
7 . 开发利用氮的化合物和防治其污染是化学研究的重要课题。
(1)从分子结构与性质的角度解释 可作制冷剂的原因:
可作制冷剂的原因:_______ 。
(2)尿素[结构为 ]是含氮量最高的氮肥。
]是含氮量最高的氮肥。
①尿素分子中 原子采用的杂化方式为
原子采用的杂化方式为_______ 。
②比较 元素与
元素与 元素的第一电离能大小并说明原因
元素的第一电离能大小并说明原因_______ 。
(3) 处理氨氮废水时产生的
处理氨氮废水时产生的 (羟基自由基,不带电)可将氨氮转化为
(羟基自由基,不带电)可将氨氮转化为 。
。
写出 与酸性废水中
与酸性废水中 反应的离子方程式:
反应的离子方程式:_______ 。
(4)石灰乳可将工业尾气中氮氧化物转化为 、
、 等。
等。
① 的空间结构是
的空间结构是_______ 。
② 中的
中的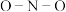 键角大于
键角大于 中的,原因是
中的,原因是_______ 。
(5)通过以下方法测定工业尾气中 的含量:将4L烟气缓慢通入稍过量的酸性
的含量:将4L烟气缓慢通入稍过量的酸性 溶液中,将
溶液中,将 转化为
转化为 ,将溶液加热煮沸一段时间。向冷却后的溶液中加入
,将溶液加热煮沸一段时间。向冷却后的溶液中加入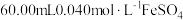 溶液,充分反应后,用
溶液,充分反应后,用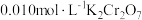 酸性溶液测定剩余的
酸性溶液测定剩余的 ,恰好完全反应时共消耗
,恰好完全反应时共消耗 酸性溶液22.00mL。该过程中发生反应:
酸性溶液22.00mL。该过程中发生反应:
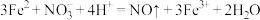
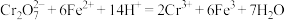
计算该烟气中 的含量
的含量_______ (以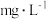 计,写出计算过程)。
计,写出计算过程)。
(1)从分子结构与性质的角度解释
 可作制冷剂的原因:
可作制冷剂的原因:(2)尿素[结构为
 ]是含氮量最高的氮肥。
]是含氮量最高的氮肥。①尿素分子中
 原子采用的杂化方式为
原子采用的杂化方式为②比较
 元素与
元素与 元素的第一电离能大小并说明原因
元素的第一电离能大小并说明原因(3)
 处理氨氮废水时产生的
处理氨氮废水时产生的 (羟基自由基,不带电)可将氨氮转化为
(羟基自由基,不带电)可将氨氮转化为 。
。写出
 与酸性废水中
与酸性废水中 反应的离子方程式:
反应的离子方程式:(4)石灰乳可将工业尾气中氮氧化物转化为
 、
、 等。
等。①
 的空间结构是
的空间结构是②
 中的
中的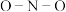 键角大于
键角大于 中的,原因是
中的,原因是(5)通过以下方法测定工业尾气中
 的含量:将4L烟气缓慢通入稍过量的酸性
的含量:将4L烟气缓慢通入稍过量的酸性 溶液中,将
溶液中,将 转化为
转化为 ,将溶液加热煮沸一段时间。向冷却后的溶液中加入
,将溶液加热煮沸一段时间。向冷却后的溶液中加入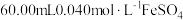 溶液,充分反应后,用
溶液,充分反应后,用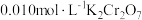 酸性溶液测定剩余的
酸性溶液测定剩余的 ,恰好完全反应时共消耗
,恰好完全反应时共消耗 酸性溶液22.00mL。该过程中发生反应:
酸性溶液22.00mL。该过程中发生反应: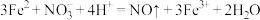
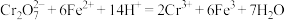
计算该烟气中
 的含量
的含量 计,写出计算过程)。
计,写出计算过程)。
您最近一年使用:0次
8 . 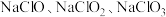 等含氯化合物在生活中有着重要应用。
等含氯化合物在生活中有着重要应用。
(1) 的制备。将
的制备。将 通入
通入 溶液中反应生成
溶液中反应生成 ,该反应为放热反应,温度过高会有副产物
,该反应为放热反应,温度过高会有副产物 生成。
生成。
①提高单位时间内 的产率,可以采取的可行措施为
的产率,可以采取的可行措施为______ 序号)。
A.适当减缓通入 速率 B.充分搅拌浆料 C.加水稀释
速率 B.充分搅拌浆料 C.加水稀释 溶液
溶液
②反应结束后,测得溶液中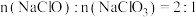 ,则该反应的化学方程式为
,则该反应的化学方程式为______ ;
③用 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。 溶液的初始
溶液的初始 越小,
越小, 转化率越高的原因是
转化率越高的原因是______ ; 的制备。
的制备。 是一种高效的消毒剂,其生产工艺流程如下。
是一种高效的消毒剂,其生产工艺流程如下。 和
和 中
中 的化合价分别为
的化合价分别为______ 、______ ;
②“吸收”时, 不能用
不能用 代替的理由是
代替的理由是______ ;
③实验室可以利用 与
与 反应可以制得
反应可以制得 。若生成
。若生成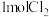 ,反应中转移的电子数为
,反应中转移的电子数为______ 。
 等含氯化合物在生活中有着重要应用。
等含氯化合物在生活中有着重要应用。(1)
 的制备。将
的制备。将 通入
通入 溶液中反应生成
溶液中反应生成 ,该反应为放热反应,温度过高会有副产物
,该反应为放热反应,温度过高会有副产物 生成。
生成。①提高单位时间内
 的产率,可以采取的可行措施为
的产率,可以采取的可行措施为A.适当减缓通入
 速率 B.充分搅拌浆料 C.加水稀释
速率 B.充分搅拌浆料 C.加水稀释 溶液
溶液②反应结束后,测得溶液中
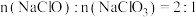 ,则该反应的化学方程式为
,则该反应的化学方程式为③用
 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。 溶液的初始
溶液的初始 越小,
越小, 转化率越高的原因是
转化率越高的原因是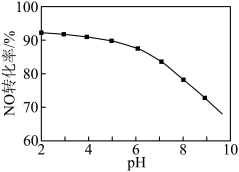
 的制备。
的制备。 是一种高效的消毒剂,其生产工艺流程如下。
是一种高效的消毒剂,其生产工艺流程如下。
 和
和 中
中 的化合价分别为
的化合价分别为②“吸收”时,
 不能用
不能用 代替的理由是
代替的理由是③实验室可以利用
 与
与 反应可以制得
反应可以制得 。若生成
。若生成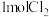 ,反应中转移的电子数为
,反应中转移的电子数为
您最近一年使用:0次
9 . 环境保护是化学的重要任务,请完成下列问题。
(1)采用“联合脱硫脱氮技术”处理烟气(含 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是___________ 。
②反应釜 中
中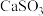 转化为
转化为 反应的化学方程式为
反应的化学方程式为___________ 。
(2)烟气(主要污染物 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
①烟气经 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为___________ 。
②尿素 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为___________ 。
(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为___________ 。
②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量___________ (填“大于”“小于”或“等于”) 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是___________ 。
(1)采用“联合脱硫脱氮技术”处理烟气(含
 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。

 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是②反应釜
 中
中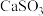 转化为
转化为 反应的化学方程式为
反应的化学方程式为(2)烟气(主要污染物
 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。①烟气经
 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为②尿素
 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用
 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收
 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
您最近一年使用:0次
解题方法
10 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,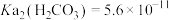 ,
,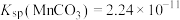
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
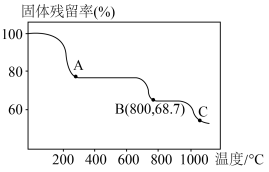
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: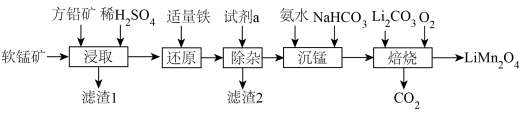
 ,
,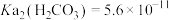 ,
,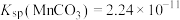
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
您最近一年使用:0次
2024-05-28更新
|
222次组卷
|
2卷引用:江苏省部分学校2024届高三下学期高考模拟化学试题



