真题
解题方法
1 . 实验室模拟“镁法工业烟气脱硫”并制备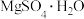 ,其实验过程可表示为
,其实验过程可表示为
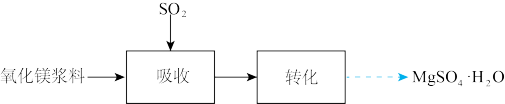
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为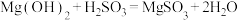 ,其平衡常数K与
,其平衡常数K与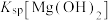 、
、 、
、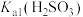 、
、 的代数关系式为
的代数关系式为
___________ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有___________ (填序号)。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入 气体的速率
气体的速率
D.通过多孔球泡向氧化镁浆料中通
(2)在催化剂作用下 被
被 氧化为
氧化为 。已知
。已知 的溶解度为0.57g(20℃),
的溶解度为0.57g(20℃), 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为___________ ;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 被
被 氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中
氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是___________ 。

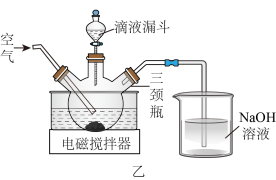
(3)制取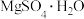 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的
晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与
浆料与 溶液充分反应。
溶液充分反应。 浆料与
浆料与 溶液的加料方式是
溶液的加料方式是___________ ;补充完整制取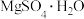 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中,___________ 。(已知: 、
、 在
在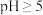 时完全转化为氢氧化物沉淀;室温下从
时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出
饱和溶液中结晶出 ,
, 在150~170℃下干燥得到
在150~170℃下干燥得到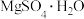 ,实验中需要使用MgO粉末)
,实验中需要使用MgO粉末)
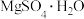 ,其实验过程可表示为
,其实验过程可表示为
(1)在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为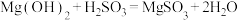 ,其平衡常数K与
,其平衡常数K与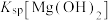 、
、 、
、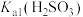 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入
 气体的速率
气体的速率D.通过多孔球泡向氧化镁浆料中通

(2)在催化剂作用下
 被
被 氧化为
氧化为 。已知
。已知 的溶解度为0.57g(20℃),
的溶解度为0.57g(20℃), 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为 被
被 氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中
氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是
(3)制取
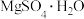 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的
晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与
浆料与 溶液充分反应。
溶液充分反应。 浆料与
浆料与 溶液的加料方式是
溶液的加料方式是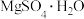 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中, 、
、 在
在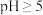 时完全转化为氢氧化物沉淀;室温下从
时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出
饱和溶液中结晶出 ,
, 在150~170℃下干燥得到
在150~170℃下干燥得到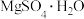 ,实验中需要使用MgO粉末)
,实验中需要使用MgO粉末)
您最近一年使用:0次
真题
解题方法
2 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的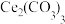 ,其部分实验过程如下:
,其部分实验过程如下:

(1)“酸浸”时 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(2)pH约为7的 溶液与
溶液与 溶液反应可生成
溶液反应可生成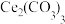 沉淀,该沉淀中
沉淀,该沉淀中 含量与加料方式有关。得到含
含量与加料方式有关。得到含 量较少的
量较少的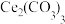 的加料方式为
的加料方式为_______ (填序号)。
A.将 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中
(3)通过中和、萃取、反萃取、沉淀等过程,可制备 含量少的
含量少的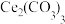 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
 (水层)+3HA(有机层)
(水层)+3HA(有机层)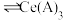 (有机层)+
(有机层)+ (水层)
(水层)
①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是_______ 。
②反萃取的目的是将有机层 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有_______ (填两项)。
③与“反萃取”得到的水溶液比较,过滤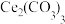 溶液的滤液中,物质的量减小的离子有
溶液的滤液中,物质的量减小的离子有_______ (填化学式)。
(4)实验中需要测定溶液中 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的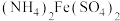 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取
。请补充完整实验方案:①准确量取 溶液[
溶液[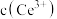 约为
约为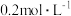 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到
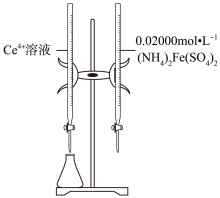
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后定容;②按规定操作分别将
容量瓶中后定容;②按规定操作分别将 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③_______ 。
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的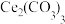 ,其部分实验过程如下:
,其部分实验过程如下:
(1)“酸浸”时
 与
与 反应生成
反应生成 并放出
并放出 ,该反应的离子方程式为
,该反应的离子方程式为(2)pH约为7的
 溶液与
溶液与 溶液反应可生成
溶液反应可生成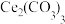 沉淀,该沉淀中
沉淀,该沉淀中 含量与加料方式有关。得到含
含量与加料方式有关。得到含 量较少的
量较少的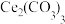 的加料方式为
的加料方式为A.将
 溶液滴加到
溶液滴加到 溶液中 B.将
溶液中 B.将 溶液滴加到
溶液滴加到 溶液中
溶液中(3)通过中和、萃取、反萃取、沉淀等过程,可制备
 含量少的
含量少的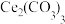 。已知
。已知 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为 (水层)+3HA(有机层)
(水层)+3HA(有机层)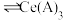 (有机层)+
(有机层)+ (水层)
(水层)①加氨水“中和”去除过量盐酸,使溶液接近中性。去除过量盐酸的目的是
②反萃取的目的是将有机层
 转移到水层。使
转移到水层。使 尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有
尽可能多地发生上述转移,应选择的实验条件或采取的实验操作有③与“反萃取”得到的水溶液比较,过滤
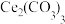 溶液的滤液中,物质的量减小的离子有
溶液的滤液中,物质的量减小的离子有(4)实验中需要测定溶液中
 的含量。已知水溶液中
的含量。已知水溶液中 可用准确浓度的
可用准确浓度的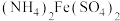 溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为 。请补充完整实验方案:①准确量取
。请补充完整实验方案:①准确量取 溶液[
溶液[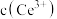 约为
约为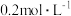 ],加氧化剂将
],加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到
完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后定容;②按规定操作分别将
容量瓶中后定容;②按规定操作分别将 和待测
和待测 溶液装入如图所示的滴定管中:③
溶液装入如图所示的滴定管中:③
您最近一年使用:0次
2022-07-21更新
|
7874次组卷
|
13卷引用:江苏省2022年普通高中学业水平选择性考试
江苏省2022年普通高中学业水平选择性考试(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编(已下线)专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)易错点33 物质的制备-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十三 实验探究中的新思路(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第30讲水的电离和溶液的酸碱性(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建
真题
名校
3 . 以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4脱硫剂,可用于脱除煤气中的H2S。脱硫剂的制备、硫化、再生过程可表示为
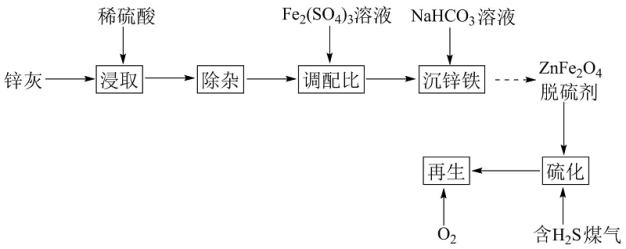
(1)“除杂”包括加足量锌粉、过滤加H2O2氧化等步骤。除Pb2+和Cu2+外,与锌粉反应的离子还有___ (填化学式)。
(2)“调配比”前,需测定ZnSO4溶液的浓度。准确量取2.50mL除去Fe3+的ZnSO4溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,滴加氨水调节溶液pH=10,用0.0150mol·L-1EDTA(Na2H2Y)溶液滴定至终点(滴定反应为Zn2++Y4-=ZnY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。计算ZnSO4溶液的物质的量浓度___ (写出计算过程)。
(3)400℃时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器。
①硫化过程中ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为___ 。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该反应过程可描述为___ 。
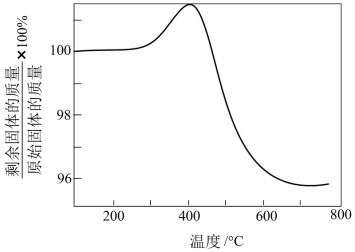
(4)将硫化后的固体在N2:O2=95:5(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是___ 。

(1)“除杂”包括加足量锌粉、过滤加H2O2氧化等步骤。除Pb2+和Cu2+外,与锌粉反应的离子还有
(2)“调配比”前,需测定ZnSO4溶液的浓度。准确量取2.50mL除去Fe3+的ZnSO4溶液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,滴加氨水调节溶液pH=10,用0.0150mol·L-1EDTA(Na2H2Y)溶液滴定至终点(滴定反应为Zn2++Y4-=ZnY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。计算ZnSO4溶液的物质的量浓度
(3)400℃时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器。
①硫化过程中ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该反应过程可描述为
(4)将硫化后的固体在N2:O2=95:5(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是

您最近一年使用:0次
2022-01-04更新
|
6727次组卷
|
8卷引用:2021年新高考江苏化学高考真题
2021年新高考江苏化学高考真题(已下线)黄金卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)2022年江苏卷高考真题变式题14-17(已下线)江苏省2022年普通高中学业水平选择性考试变式题(实验探究题)江苏省常州高级中学 2022~2023学年高一下学期 5月阶段检测化学试题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题
4 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH− 2
2 +H2O
+H2O
2NO2+2OH−
 +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为
,其离子方程式为________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________ 。

(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH−
 2
2 +H2O
+H2O2NO2+2OH−

 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl−和
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是

您最近一年使用:0次
2019-06-10更新
|
7404次组卷
|
32卷引用:2019年江苏省高考化学试题
2019年江苏省高考化学试题江苏省苏州新草桥中学2020届高三上学期10月月考化学试题江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题江苏省启东中学2021届高三上学期期初考试化学试题江苏省苏州市工业园区星海实验中学高一下学期3月月考化学试题(已下线)【苏州新东方】04 吴县中学(已下线)常见无机物的性质江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题江苏省常州市联盟校2023-2024学年高一下学期3月阶段调研化学试题江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——氮及其氧化物的性质(提升练)2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升第2章 化学键化学反应规律 模拟高考——C挑战区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 模拟高考——C挑战区 夯实基础(鲁科版必修2)专题4 化学科学与人类文明——C挑战区 模拟高考(苏教版必修2)(已下线)2020年高考化学押题预测卷01(新课标Ⅰ卷)--《2020年高考押题预测卷》(已下线)专题6.3 化学原理题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019人教版2019必修第二册 第五章 第二~三节综合拔高练重庆市凤鸣山中学2020-2021学年高一下学期期中考试化学试题湖北省广水市普通中学2020-2021学年高一下学期5月月考化学试题(已下线)第12讲 氮及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)广东省潮州市饶平县第二中学2021-2022学年高一下学期月考(一)化学试题海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题黑龙江省大庆市第四中学2018-2019学年高二下学期第三次月考化学试题(已下线)专题17 原理综合题湖北省黄石市第二中学2023-2024学年高二上学期第三次统测化学试题
真题
解题方法
5 . 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型 是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是_____ 。
②共沉淀反应的化学方程式为_____________ 。
③高温成型前,常向 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的 的导电性能外,还能
的导电性能外,还能____________________ 。
(2)废旧锂离子电池的正极材料试样(主要含有 及少量Al、Fe等)可通过下列实验方法回收钴、锂。
及少量Al、Fe等)可通过下列实验方法回收钴、锂。

① 在上述溶解过程中,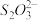 被氧化成
被氧化成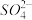 ,
, 在溶解过程中反应的化学方程式为
在溶解过程中反应的化学方程式为________________________________ 。
② 在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为
在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_______ 。(填化学式);在350~400℃范围内,剩余固体的成分为______ 。(填化学式)。

(1)橄榄石型
 是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是
②共沉淀反应的化学方程式为
③高温成型前,常向
 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的 的导电性能外,还能
的导电性能外,还能(2)废旧锂离子电池的正极材料试样(主要含有
 及少量Al、Fe等)可通过下列实验方法回收钴、锂。
及少量Al、Fe等)可通过下列实验方法回收钴、锂。
① 在上述溶解过程中,
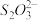 被氧化成
被氧化成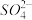 ,
, 在溶解过程中反应的化学方程式为
在溶解过程中反应的化学方程式为②
 在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为
在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为
您最近一年使用:0次
2019-01-30更新
|
900次组卷
|
4卷引用:2010年普通高等学校招生统一考试理综试题化学部分(江苏卷)
真题
名校
6 . 某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
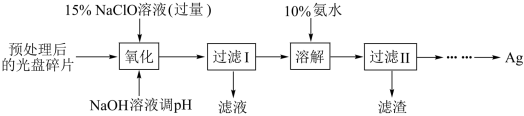
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO=2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O
 + Cl− +2H2O
+ Cl− +2H2O
③常温时N2H4·H2O(水合肼)在碱性条件下能还原 :
:
4 +N2H4·H2O=4Ag↓+N2↑+4
+N2H4·H2O=4Ag↓+N2↑+4 +4NH3↑+H2O
+4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为__________________ 。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________ 。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是____________________ 。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________ 。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为____________________ 。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:_________ (实验中须使用 的试剂有:2 mol·L−1水合肼溶液,1 mol·L−1H2SO4)。

已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO=2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O

 + Cl− +2H2O
+ Cl− +2H2O③常温时N2H4·H2O(水合肼)在碱性条件下能还原
 :
:4
 +N2H4·H2O=4Ag↓+N2↑+4
+N2H4·H2O=4Ag↓+N2↑+4 +4NH3↑+H2O
+4NH3↑+H2O(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:
您最近一年使用:0次
2017-08-08更新
|
3497次组卷
|
8卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题江苏省常州高级中学 2022~2023学年高一下学期 5月阶段检测化学试题(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】(已下线)考点22 工业流程综合——《备战2020年高考精选考点专项突破题集》贵州省岑巩县第二中学2019-2020学年高三上学期期末考试化学试题广东省佛山市第一中学2021-2022学年高三上学期12月模拟考试化学试题
7 . 碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为_________________________ 。
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______ 。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)__________ 。
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为

(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)
您最近一年使用:0次
2017-08-08更新
|
3144次组卷
|
9卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题河北省定州中学2018届高三(承智班)上学期第一次调研化学试题(已下线)《考前20天终极攻略》6月3日 专项三 化学计算(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【教学案】河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题河北省秦皇岛市青龙县2022-2023学年高三上学期期中考试化学试题
8 . 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
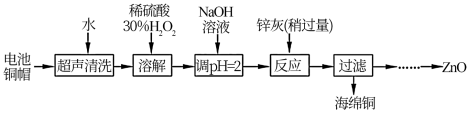
(1)①铜帽溶解时加入H 2 O 2 的目的是____________ (用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2 除去。除去H 2 O 2 的简便方法是___________ 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O +I 2 =2I-+S4O
+I 2 =2I-+S4O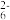
①滴定选用的指示剂为_____ ,滴定终点观察到的现象为 ___________ 。
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会___________ (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①___________ ;② ___________ ;③过滤;④___________ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。

(1)①铜帽溶解时加入H 2 O 2 的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O
 +I 2 =2I-+S4O
+I 2 =2I-+S4O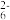
①滴定选用的指示剂为
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
 | 1.1 | 3.2 |
 | 5.8 | 8.8 |
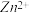 | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①
您最近一年使用:0次
2016-12-09更新
|
770次组卷
|
5卷引用:2012年普通高等学校招生全国统一考试化学(江苏卷)
9 . 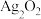 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在 溶液中加入适量
溶液中加入适量 溶液,生成
溶液,生成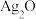 沉淀,保持反应温度为80
沉淀,保持反应温度为80 ,边搅拌边将一定量
,边搅拌边将一定量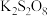 溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8
溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8 Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。
Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是___________ 。
(2)银锌碱性电池的电解质溶液为 溶液,电池放电时正极的
溶液,电池放电时正极的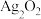 转化为
转化为 ,负极的
,负极的 转化为
转化为 ,写出该电池反应方程式:
,写出该电池反应方程式:___________ 。
(3)准确称取上述制备的样品(设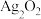 仅含和
仅含和 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为 和
和 ,得到224.0mL
,得到224.0mL (标准状况下)。计算样品中
(标准状况下)。计算样品中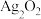 的质量分数
的质量分数_____ (计算结果精确到小数点后两位)。
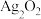 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在 溶液中加入适量
溶液中加入适量 溶液,生成
溶液,生成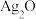 沉淀,保持反应温度为80
沉淀,保持反应温度为80 ,边搅拌边将一定量
,边搅拌边将一定量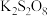 溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8
溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8 Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。
Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
(2)银锌碱性电池的电解质溶液为
 溶液,电池放电时正极的
溶液,电池放电时正极的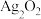 转化为
转化为 ,负极的
,负极的 转化为
转化为 ,写出该电池反应方程式:
,写出该电池反应方程式:(3)准确称取上述制备的样品(设
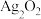 仅含和
仅含和 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为 和
和 ,得到224.0mL
,得到224.0mL (标准状况下)。计算样品中
(标准状况下)。计算样品中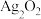 的质量分数
的质量分数
您最近一年使用:0次
2016-12-09更新
|
1397次组卷
|
4卷引用:2011年普通高等学校招生全国统一考试化学卷(江苏)
2011年普通高等学校招生全国统一考试化学卷(江苏)(已下线)2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(已下线)2014-2015学年河南省南阳市新野三中上学期10月月考高二化学试卷【全国百强校】湖南师范大学附属中学2017-2018学年高一下学期期末考试化学试题



