1 . 利用黄铁矿(主要成分为FeS2)与软锰矿(主要成分为MnO2)制备MnSO4·H2O并回收单质硫的部分工艺流程如下:

已知:酸浸液主要含有Mn2+、Fe2+、Fe3+等金属阳离子。
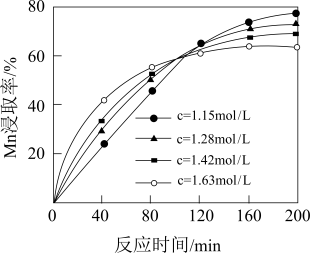
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图所示。
①基态Fe2+的价电子排布式为___________ 。
②酸浸时反应生成Fe3+和S的离子方程式为___________ 。
③100 min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是___________ 。
④酸浸液中还含有Cd2+等重金属阳离子,请结合数据计算说明能否用MnS除去Cd2+?[Ksp(MnS) = 1.2×10-14,Ksp(CdS) = 3.6×10-29]___________ 。
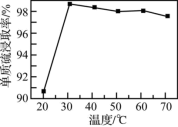
(2)(NH4)2S溶液浸取滤渣时的反应为(n-1) S + S2- = ,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是___________ 。

已知:酸浸液主要含有Mn2+、Fe2+、Fe3+等金属阳离子。
(1)当温度为90℃时,酸浸过程中硫酸浓度c对Mn浸取率的影响如图所示。

①基态Fe2+的价电子排布式为
②酸浸时反应生成Fe3+和S的离子方程式为
③100 min后,Mn浸取率随硫酸浓度增大而呈下降趋势,可能的原因是
④酸浸液中还含有Cd2+等重金属阳离子,请结合数据计算说明能否用MnS除去Cd2+?[Ksp(MnS) = 1.2×10-14,Ksp(CdS) = 3.6×10-29]
(2)(NH4)2S溶液浸取滤渣时的反应为(n-1) S + S2- =
 ,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是
,单质硫浸取率随温度变化曲线如图所示。温度高于30℃,单质硫浸取率下降的可能原因是
您最近一年使用:0次
名校
解题方法
2 . NOx(主要指NO和NO2)和SO2是大气主要污染物。有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=_______ kJ·mol-1。
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物S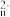 ,S
,S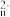 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。

①阳极HS-氧化为S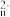 的电极反应式为
的电极反应式为_______ 。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是_______ 。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式_______ 。
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。
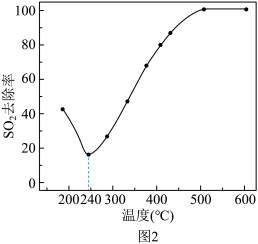
240℃以前,随着温度的升高,SO2去除率降低的原因是_______ 。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是_______ 。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物S
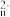 ,S
,S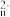 容易被继续氧化而生成硫单质。
容易被继续氧化而生成硫单质。
①阳极HS-氧化为S
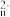 的电极反应式为
的电极反应式为②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。

240℃以前,随着温度的升高,SO2去除率降低的原因是
您最近一年使用:0次
解题方法
3 . 全钒液流电池正极废液中含有的离子是 。以该废液为原料经过氧化、调
。以该废液为原料经过氧化、调 、沉钒、煅烧可以制取
、沉钒、煅烧可以制取 。
。
(1)氧化:向正极废液中加入 将
将 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:________ 。
(2)调 :向氧化后的溶液中加入
:向氧化后的溶液中加入 调节溶液
调节溶液 ,溶液中V(
,溶液中V(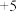 价)会以
价)会以 等形式存在。随pH的升高,溶液中
等形式存在。随pH的升高,溶液中 的值将
的值将________ (填“增大”“减小”或“保持不变”),判断的方法是________ 。
(3)沉钒:不同 时,向溶液中加入
时,向溶液中加入 ,可得到不同类型的含钒沉淀。
,可得到不同类型的含钒沉淀。
①其他条件一定,控制溶液 在2~5之间,向溶液中加入
在2~5之间,向溶液中加入 ,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。
,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。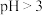 时,
时, 越大,溶液的沉钒率越低的原因是
越大,溶液的沉钒率越低的原因是________ 。
②向 的溶液中(此时
的溶液中(此时 主要以
主要以 存在)加入过量
存在)加入过量 溶液,生成
溶液,生成 沉淀。加入过量
沉淀。加入过量 溶液的目的是。已知:
溶液的目的是。已知: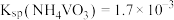 。
。

(4)煅烧:煅烧 固体制取
固体制取 时,需在有氧条件下进行,原因是
时,需在有氧条件下进行,原因是________ 。
(5)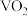 是一种相变材料,其一种晶胞(部分
是一种相变材料,其一种晶胞(部分 原子未标出)的结构如图3所示,在图中合适位置补充其余
原子未标出)的结构如图3所示,在图中合适位置补充其余 原子
原子________ 。
 。以该废液为原料经过氧化、调
。以该废液为原料经过氧化、调 、沉钒、煅烧可以制取
、沉钒、煅烧可以制取 。
。(1)氧化:向正极废液中加入
 将
将 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(2)调
 :向氧化后的溶液中加入
:向氧化后的溶液中加入 调节溶液
调节溶液 ,溶液中V(
,溶液中V(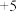 价)会以
价)会以 等形式存在。随pH的升高,溶液中
等形式存在。随pH的升高,溶液中 的值将
的值将(3)沉钒:不同
 时,向溶液中加入
时,向溶液中加入 ,可得到不同类型的含钒沉淀。
,可得到不同类型的含钒沉淀。①其他条件一定,控制溶液
 在2~5之间,向溶液中加入
在2~5之间,向溶液中加入 ,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。
,沉钒率和沉淀的X射线衍射图分别如图1和图2所示。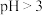 时,
时, 越大,溶液的沉钒率越低的原因是
越大,溶液的沉钒率越低的原因是②向
 的溶液中(此时
的溶液中(此时 主要以
主要以 存在)加入过量
存在)加入过量 溶液,生成
溶液,生成 沉淀。加入过量
沉淀。加入过量 溶液的目的是。已知:
溶液的目的是。已知: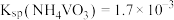 。
。
(4)煅烧:煅烧
 固体制取
固体制取 时,需在有氧条件下进行,原因是
时,需在有氧条件下进行,原因是(5)
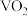 是一种相变材料,其一种晶胞(部分
是一种相变材料,其一种晶胞(部分 原子未标出)的结构如图3所示,在图中合适位置补充其余
原子未标出)的结构如图3所示,在图中合适位置补充其余 原子
原子
您最近一年使用:0次
4 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
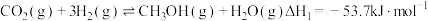
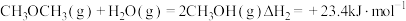
则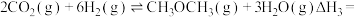
_______ kJ∙mol-1。
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: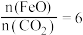 ,则
,则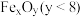 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗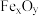
_______  。
。
(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子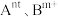 和负离子
和负离子 组成,该物质
组成,该物质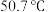 以上形成无序结构(高温相),
以上形成无序结构(高温相), 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示:_______ 。
ii.“高温相”具有良好的离子导电性,其主要原因是_______ 。
(4)铜基催化剂 (
( 为
为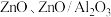 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 上发生反应的总化学方程式
上发生反应的总化学方程式_______ 。
(5)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: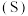 和法拉第效率(
和法拉第效率(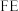 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:
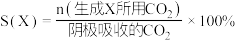

①实验测得,碱性条件生成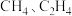 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是_______ 。
②实验测得,酸性条件生成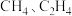 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是_______ 。
(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: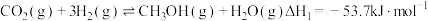
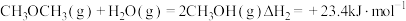
则
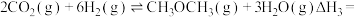
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: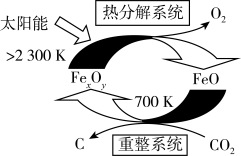
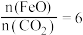 ,则
,则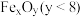 的化学式为
的化学式为 电子,需消耗
电子,需消耗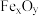
 。
。(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子
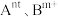 和负离子
和负离子 组成,该物质
组成,该物质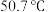 以上形成无序结构(高温相),
以上形成无序结构(高温相), 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示: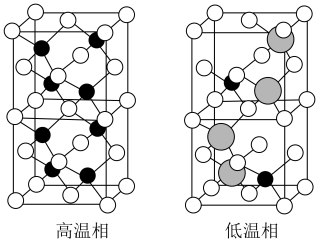
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的 球为
球为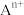 离子,●球为
离子,●球为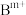 离子。
离子。
ii.“高温相”具有良好的离子导电性,其主要原因是
(4)铜基催化剂
 (
( 为
为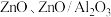 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 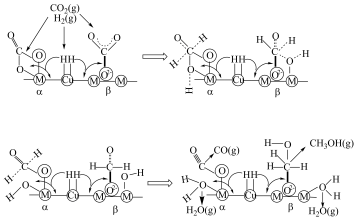
 上发生反应的总化学方程式
上发生反应的总化学方程式(5)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: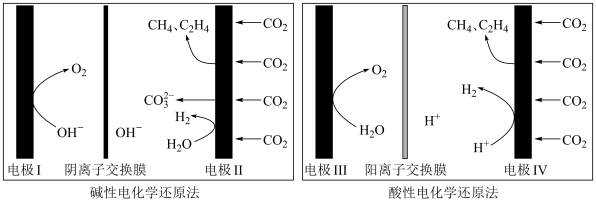
 和法拉第效率(
和法拉第效率( )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下: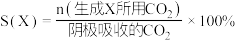

①实验测得,碱性条件生成
 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是②实验测得,酸性条件生成
 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是
您最近一年使用:0次
名校
5 . 氢气是一种理想的绿色清洁能源,氢气的制取是氢能源利用领域的研究热点。
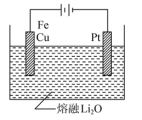
(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为___________ 。
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为___________ 。
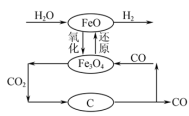
(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是___________ 。
(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。
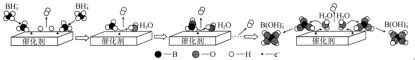
①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有___________ 。
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是___________ 。

(1)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2。
①氧缺位铁酸铜通过两步反应分解水制氢。已知第二步反应为2CuFe2O4=2CuFe2O4-x+xO2↑,则第一步反应的化学方程式为
②CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为

(2)可利用FeO/Fe3O4之间的相互转化,来裂解水制取氢气,其制氢流程如图所示。该工艺制氢的总反应为C(s)+H2O(g)=CO(g)+H2(g),对比水和碳在高温下直接接触反应制氢,分析该工艺制氢的最大优点是

(3)硼氢化钠(NaBH4)的强碱溶液在催化剂作用下与水反应可获取氢气,其可能反应机理如图所示。已知:常温下,NaB(OH)4在水中的溶解度不大,易以NaBO2形式结晶析出。

①若用D2O代替H2O,依据反应机理,则反应后生成的气体中含有
②其他条件相同时,测得平均每克催化剂使用量下,NaBH4的浓度和放氢速率的变化关系如图所示。随着NaBH4浓度的增大,放氢速率先增大后减小,导致放氢速率下降的原因可能是

您最近一年使用:0次
名校
6 . 铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
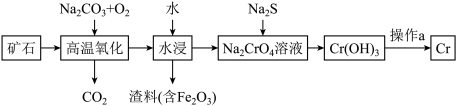
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
①Fe(CrO2)2中各元素化合价均为整数,则铬为___________ 价。
②操作a由两种均发生了化学反应的过程构成,其内容分别是___________ 、与铝粉混合高温下发生铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应的离子方程式___________ 、___________ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出CrO 在酸性条件下被Fe2+还原为Cr3+的离子方程式
在酸性条件下被Fe2+还原为Cr3+的离子方程式___________ 。
②若处理含1molCrO (不考虑其他含铬微粒)的污水时恰好消耗10molFeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗10molFeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为___________ 。
(4)利用K2Cr2O7测定CuI样品中CuI质量分数(杂质不参加反应)的方法如下:称取CuI样品0.600g,向其中加入足量Fe2(SO4)3溶液恰好使其溶解,生成Fe2+、Cu2+和I2。待充分反应后,滴加5.000×10-2mol·L-1K2Cr2O7溶液氧化其中的Fe2+,当恰好完全反应时消耗K2Cr2O7溶液的体积为20.00mL。计算该样品中CuI的质量分数(写出计算过程)_____ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为
②操作a由两种均发生了化学反应的过程构成,其内容分别是
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应的离子方程式
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出CrO
 在酸性条件下被Fe2+还原为Cr3+的离子方程式
在酸性条件下被Fe2+还原为Cr3+的离子方程式②若处理含1molCrO
 (不考虑其他含铬微粒)的污水时恰好消耗10molFeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗10molFeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为(4)利用K2Cr2O7测定CuI样品中CuI质量分数(杂质不参加反应)的方法如下:称取CuI样品0.600g,向其中加入足量Fe2(SO4)3溶液恰好使其溶解,生成Fe2+、Cu2+和I2。待充分反应后,滴加5.000×10-2mol·L-1K2Cr2O7溶液氧化其中的Fe2+,当恰好完全反应时消耗K2Cr2O7溶液的体积为20.00mL。计算该样品中CuI的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
7 . 尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
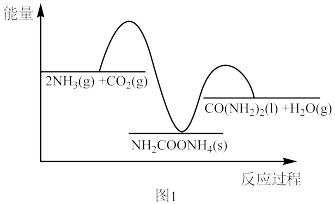
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
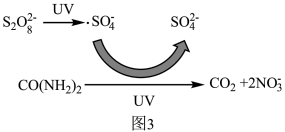
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
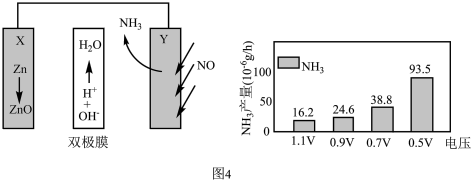
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
8 . 连二亚硫酸钠(Na2S2O4)广泛应用于造纸等行业。Na2S2O4易被氧化,129℃时分解,在碱性条件下较稳定,易溶于水,不溶于乙醇。
实验室用NaBH4碱性溶液和NaHSO3酸性溶液制取Na2S2O4,实验室制备装置如图1所示。

(1)实验前需打开K通入一段时间氮气,其目的是___________ 。
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2,制备Na2S2O4的化学方程式为___________ 。
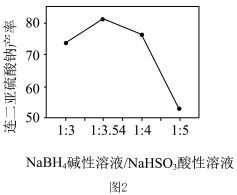
(3)Na2S2O4产率与加入NaBH4溶液与NaHSO3溶液质量比的关系如图2所示,NaBH4碱性溶液与NaHSO3酸性溶液加料质量比增大时,Na2S2O4产率下降的原因是___________ 。
(4)称量5.0g含Na2S2O4•2H2O晶体粗品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,再滴加几滴淀粉溶液,用0.2000mol•L-1标准碘溶液滴定至反应终点,重复实验三次后,平均消耗标准碘溶液20.00mL。有关反应如下:Na2S2O4+2CH2O+H2O=NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O=NaHSO4+4HI+CH2O,计算该粗品中Na2S2O4•2H2O晶体质量分数为___________ 。(写出计算过程)
实验室用NaBH4碱性溶液和NaHSO3酸性溶液制取Na2S2O4,实验室制备装置如图1所示。

(1)实验前需打开K通入一段时间氮气,其目的是
(2)在10℃~35℃下,向盛有一定浓度的NaHSO3溶液容器中滴加NaBH4溶液,生成Na2S2O4和NaBO2,制备Na2S2O4的化学方程式为
(3)Na2S2O4产率与加入NaBH4溶液与NaHSO3溶液质量比的关系如图2所示,NaBH4碱性溶液与NaHSO3酸性溶液加料质量比增大时,Na2S2O4产率下降的原因是

(4)称量5.0g含Na2S2O4•2H2O晶体粗品溶于水配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,再滴加几滴淀粉溶液,用0.2000mol•L-1标准碘溶液滴定至反应终点,重复实验三次后,平均消耗标准碘溶液20.00mL。有关反应如下:Na2S2O4+2CH2O+H2O=NaHSO3•CH2O+NaHSO2•CH2O,NaHSO2•CH2O+2I2+2H2O=NaHSO4+4HI+CH2O,计算该粗品中Na2S2O4•2H2O晶体质量分数为
您最近一年使用:0次
解题方法
9 . KIO3是常见的食盐加碘剂,某小组制备KIO3晶体的流程如下,请回答下列问题:

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为___________ 。
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是___________ (填字母)。
a. b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是___________ 。
(4)步骤⑧后,往滤液中加入一定量___________ ,再次抽滤,可提高产品收率。
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②KIO3在酸性条件下氧化KI的离子方程式为___________ 。
③产品的质量分数为___________ (保留4位有效数字)。
④在确认滴定操作无误的情况下,质量分数异常的原因可能是___________ 。

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是
a.
 b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是
(4)步骤⑧后,往滤液中加入一定量
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②KIO3在酸性条件下氧化KI的离子方程式为
③产品的质量分数为
④在确认滴定操作无误的情况下,质量分数异常的原因可能是
您最近一年使用:0次
名校
解题方法
10 . 钕铁硼磁铁因其超强的磁性被誉为“永磁之王”。一种从钕铁硼废料[含钕( ,质量分数为28.8%)、
,质量分数为28.8%)、 、
、 ]中提取氧化钕的工艺流程如下:
]中提取氧化钕的工艺流程如下: 稳定的化合价为+3价;金属钕的活动性较强,能与酸发生置换反应:
稳定的化合价为+3价;金属钕的活动性较强,能与酸发生置换反应: 难溶于水;硼不与稀硫酸反应,但可溶于氧化性酸。
难溶于水;硼不与稀硫酸反应,但可溶于氧化性酸。
(1)“酸溶”时,不可将稀硫酸换为浓硫酸的原因是_______ 。
(2)在常温下“沉钕”,当 完全沉淀时
完全沉淀时 为2.3,溶液中
为2.3,溶液中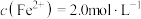 。
。
①写出“沉钕”的化学方程式_______ 。
②通过计算说明:“沉钕”完全时有无 沉淀生成
沉淀生成_______ 。(常温下,Ksp[Fe(OH)2]=8.0×10-16)
③酸溶后需调节溶液的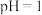 ,若酸性太强,“沉钕”不完全,试分析其原因
,若酸性太强,“沉钕”不完全,试分析其原因_______ 。
(3)焙烧“沉淀”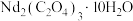 时生成无毒气体,该反应的化学方程式为
时生成无毒气体,该反应的化学方程式为_______ 。
(4)热重法是测量物质的质量与温度关系的方法。草酸钕晶体[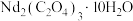 ,式量为732]的热重曲线如图所示,加热到450°C时,只剩余一种盐,该盐的化学式为
,式量为732]的热重曲线如图所示,加热到450°C时,只剩余一种盐,该盐的化学式为_______ 。(写出计算过程)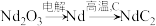 。二碳化钕(
。二碳化钕(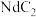 )的晶胞结构与氯化钠相似,但由于哑铃形
)的晶胞结构与氯化钠相似,但由于哑铃形 的存在,使晶胞延同一个方向拉长(如图所示)。则二碳化钕晶体中1个
的存在,使晶胞延同一个方向拉长(如图所示)。则二碳化钕晶体中1个 周围
周围距离最近且等距 的 围成的几何图形为
围成的几何图形为_______ 。
 ,质量分数为28.8%)、
,质量分数为28.8%)、 、
、 ]中提取氧化钕的工艺流程如下:
]中提取氧化钕的工艺流程如下: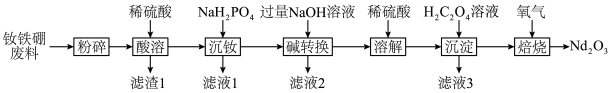
 稳定的化合价为+3价;金属钕的活动性较强,能与酸发生置换反应:
稳定的化合价为+3价;金属钕的活动性较强,能与酸发生置换反应: 难溶于水;硼不与稀硫酸反应,但可溶于氧化性酸。
难溶于水;硼不与稀硫酸反应,但可溶于氧化性酸。(1)“酸溶”时,不可将稀硫酸换为浓硫酸的原因是
(2)在常温下“沉钕”,当
 完全沉淀时
完全沉淀时 为2.3,溶液中
为2.3,溶液中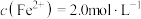 。
。①写出“沉钕”的化学方程式
②通过计算说明:“沉钕”完全时有无
 沉淀生成
沉淀生成③酸溶后需调节溶液的
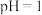 ,若酸性太强,“沉钕”不完全,试分析其原因
,若酸性太强,“沉钕”不完全,试分析其原因(3)焙烧“沉淀”
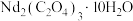 时生成无毒气体,该反应的化学方程式为
时生成无毒气体,该反应的化学方程式为(4)热重法是测量物质的质量与温度关系的方法。草酸钕晶体[
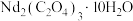 ,式量为732]的热重曲线如图所示,加热到450°C时,只剩余一种盐,该盐的化学式为
,式量为732]的热重曲线如图所示,加热到450°C时,只剩余一种盐,该盐的化学式为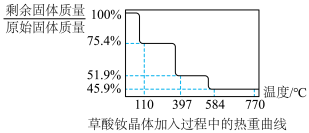
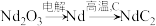 。二碳化钕(
。二碳化钕(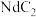 )的晶胞结构与氯化钠相似,但由于哑铃形
)的晶胞结构与氯化钠相似,但由于哑铃形 的存在,使晶胞延同一个方向拉长(如图所示)。则二碳化钕晶体中1个
的存在,使晶胞延同一个方向拉长(如图所示)。则二碳化钕晶体中1个 周围
周围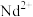 围成的几何图形为
围成的几何图形为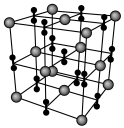
您最近一年使用:0次



