解题方法
1 . 铈可用作优良的环保材料。现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备碳酸铈的工艺流程如下:___________ 。
(2)“酸浸”步骤中产生的气体为___________ (化学式)。
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是___________ (已知Ksp[Fe(OH)3]=8×10-38;Ksp[Ce(OH)3]=1×10-22;lg2=0.3,离子浓度小于1×10-5mol/L认为沉淀完全)。
(4)“沉淀”步骤中发生反应的离子方程式为___________ 。
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为___________ 。
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;___________ 。
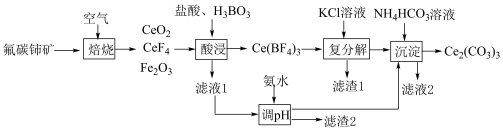
(2)“酸浸”步骤中产生的气体为
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是
(4)“沉淀”步骤中发生反应的离子方程式为
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;
您最近一年使用:0次
名校
2 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: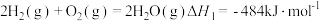
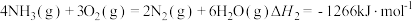
则 的
的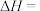
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为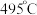 时,
时,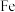 的温度为
的温度为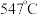 ,而
,而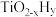 的温度为
的温度为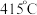 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性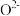 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为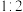 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中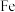 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的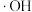 (羟基自由基),
(羟基自由基),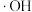 能将
能将 快速氧化为
快速氧化为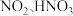 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
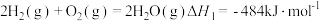
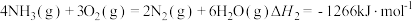
则
 的
的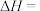
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为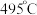 时,
时,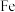 的温度为
的温度为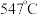 ,而
,而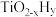 的温度为
的温度为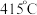 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是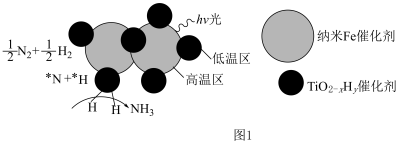
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性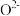 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为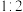 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的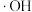 (羟基自由基),
(羟基自由基),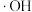 能将
能将 快速氧化为
快速氧化为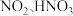 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: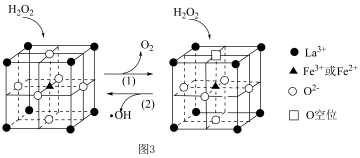
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
3 . 金属钼(Mo)在工业和国防建设中有重要的作用,钼元素的常见化合价为+4、+5、+6.由钼精矿(主要成分是MoS2)制备钼单质和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图所示。___________ 。
(2)操作1是加入碳酸钠溶液碱浸、过滤。在25℃时,碱浸液中,c(MoO )=0.80mol/L,c(
)=0.80mol/L,c( )=0.05mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率是
的去除率是___________ (用百分数表示)。
[已知,在25℃时,Ksp(BaMoO4)=4.0×10−8,Ksp(BaSO4)=1.0×10−10,操作过程中溶液的体积和温度变化可忽略不计]
(3)操作3中,经过滤可得钼酸固体。检验钼酸是否洗涤干净的操作为___________ 。
(4)在碱性条件下,向钼精矿中加入NaClO溶液也可以制备Na2MoO4,同时生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(5)钼单质晶体的一个晶胞如图所示。该晶胞为立方体,Mo原子位于顶点和面心。请在图中用短线连接Mo原子A以及与其距离最近且等距的Mo原子___________ 。

(2)操作1是加入碳酸钠溶液碱浸、过滤。在25℃时,碱浸液中,c(MoO
 )=0.80mol/L,c(
)=0.80mol/L,c( )=0.05mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时, 的去除率是
的去除率是[已知,在25℃时,Ksp(BaMoO4)=4.0×10−8,Ksp(BaSO4)=1.0×10−10,操作过程中溶液的体积和温度变化可忽略不计]
(3)操作3中,经过滤可得钼酸固体。检验钼酸是否洗涤干净的操作为
(4)在碱性条件下,向钼精矿中加入NaClO溶液也可以制备Na2MoO4,同时生成
 ,该反应的离子方程式为
,该反应的离子方程式为(5)钼单质晶体的一个晶胞如图所示。该晶胞为立方体,Mo原子位于顶点和面心。请在图中用短线连接Mo原子A以及与其距离最近且等距的Mo原子

您最近一年使用:0次
2024-02-23更新
|
121次组卷
|
2卷引用:江苏省无锡市第一中学2023-2024学年高三上学期10月份质量检测化学试题
名校
解题方法
4 . 纳米磁性Fe3O4在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米的工艺流程如下:
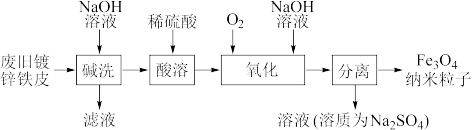
(1)将废旧镀锌铁皮“碱洗”的目的是除油污和___________ 。
(2)“酸溶”后的溶液中阳离子主要有___________ 。
(3)“氧化”时发生的总反应化学方程式为___________ 。在酸性条件下,FeSO4很容易发生如下反应: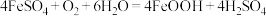 ,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为___________ 。
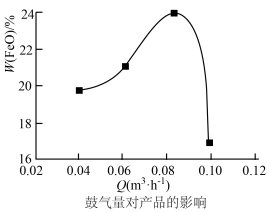
(4)空气的流量影响磁性性能的好坏。由图可知,当空气的鼓入量为0.08m3·h-1时,磁性Fe3O4会混有FeO(纵坐标w为质量分数)。此时实际产品中Fe2+与Fe3+的物质的量之比约为___________ 。
(5)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是___________ 。

(1)将废旧镀锌铁皮“碱洗”的目的是除油污和
(2)“酸溶”后的溶液中阳离子主要有
(3)“氧化”时发生的总反应化学方程式为
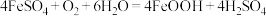 ,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为(4)空气的流量影响磁性性能的好坏。由图可知,当空气的鼓入量为0.08m3·h-1时,磁性Fe3O4会混有FeO(纵坐标w为质量分数)。此时实际产品中Fe2+与Fe3+的物质的量之比约为

(5)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是
您最近一年使用:0次
名校
解题方法
5 . 金矿提金采用氰化工艺,产生的含氰废水需处理后才能排放。
(1)氰化工艺中,金溶解于 溶液生成
溶液生成 。
。
①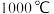 时,
时, 和
和 在催化剂作用下可转化为
在催化剂作用下可转化为 ,
, 与
与 反应可制得
反应可制得 。生成HCN的化学方程式为
。生成HCN的化学方程式为_______ 。
② 含有
含有 键的数目为
键的数目为_______ 。
(2)用 溶液处理含氰废水,使有毒的
溶液处理含氰废水,使有毒的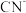 转化为
转化为 等。
等。
①该反应的离子方程式为_______ 。
② 可作为上述反应的催化剂。其他条件相同时,总氰化物(
可作为上述反应的催化剂。其他条件相同时,总氰化物( 等)去除率随溶液初始
等)去除率随溶液初始 变化如图1所示。当溶液初始
变化如图1所示。当溶液初始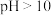 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是_______ 。

(3)焦亚硫酸钠 空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子
空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子 。其他条件相同时,总氰化物去除率随
。其他条件相同时,总氰化物去除率随 初始浓度
初始浓度 变化如图2所示。当
变化如图2所示。当 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是_______ 。

(4)循环流化床烟气脱硫灰的主要成分有 。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。

①图3中1100℃时,残留固体主要成分为_______ ;
②在600~630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少量的 分解导致的,写出该分解反应的化学方程式:
分解导致的,写出该分解反应的化学方程式:_______ 。
③对比图3与图4知,图4中370~420℃曲线上升的原因为_______ 。
(1)氰化工艺中,金溶解于
 溶液生成
溶液生成 。
。①
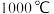 时,
时, 和
和 在催化剂作用下可转化为
在催化剂作用下可转化为 ,
, 与
与 反应可制得
反应可制得 。生成HCN的化学方程式为
。生成HCN的化学方程式为②
 含有
含有 键的数目为
键的数目为(2)用
 溶液处理含氰废水,使有毒的
溶液处理含氰废水,使有毒的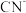 转化为
转化为 等。
等。①该反应的离子方程式为
②
 可作为上述反应的催化剂。其他条件相同时,总氰化物(
可作为上述反应的催化剂。其他条件相同时,总氰化物( 等)去除率随溶液初始
等)去除率随溶液初始 变化如图1所示。当溶液初始
变化如图1所示。当溶液初始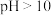 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是
(3)焦亚硫酸钠
 空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子
空气法处理含氰废水部分机理如下,其中[0]代表活性氧原子 。其他条件相同时,总氰化物去除率随
。其他条件相同时,总氰化物去除率随 初始浓度
初始浓度 变化如图2所示。当
变化如图2所示。当 时,总氰化物去除率下降的原因可能是
时,总氰化物去除率下降的原因可能是
(4)循环流化床烟气脱硫灰的主要成分有
 。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
①图3中1100℃时,残留固体主要成分为
②在600~630℃时有一个微弱的SO2峰,可能是由于脱硫灰中少量的
 分解导致的,写出该分解反应的化学方程式:
分解导致的,写出该分解反应的化学方程式:③对比图3与图4知,图4中370~420℃曲线上升的原因为
您最近一年使用:0次
名校
解题方法
6 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
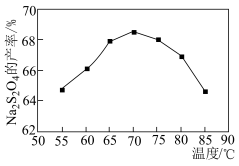
②二价锌在水溶液中的存在形式与pH的关系如图所示。
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近一年使用:0次
2024-02-22更新
|
328次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
名校
解题方法
7 . 利用废旧白铁皮(含Fe、Zn、Fe2O3、ZnO)制备磁性Fe3O4胶体流程如图:

已知:①锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
②在水溶液中Fe2+能与K3[Fe(CN)6]反应生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)“碱溶”的目的是去除油污以及溶解镀锌层,写出NaOH溶液与ZnO反应的化学方程式___________ 。
(2)“部分氧化”阶段,ClO 被Fe2+还原为Cl-,该反应的离子方程式是
被Fe2+还原为Cl-,该反应的离子方程式是___________ 。
(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1:2。检验其中Fe2+可选用的试剂是___________(填字母)。
(4)用___________ 效应可以确定溶液B中是否产生了Fe3O4胶体。

已知:①锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。
②在水溶液中Fe2+能与K3[Fe(CN)6]反应生成蓝色沉淀Fe3[Fe(CN)6]2。
(1)“碱溶”的目的是去除油污以及溶解镀锌层,写出NaOH溶液与ZnO反应的化学方程式
(2)“部分氧化”阶段,ClO
 被Fe2+还原为Cl-,该反应的离子方程式是
被Fe2+还原为Cl-,该反应的离子方程式是(3)经测定溶液B中Fe2+、Fe3+的物质的量之比是1:2。检验其中Fe2+可选用的试剂是___________(填字母)。
| A.NaOH溶液 | B.KSCN溶液 | C.KMnO4溶液 | D.K3[Fe(CN)6]溶液 |
(4)用
您最近一年使用:0次
名校
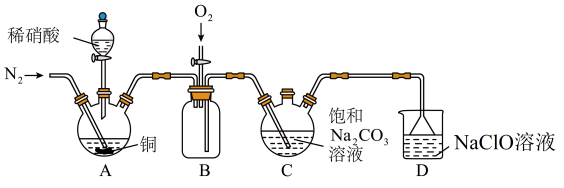
8 . 亚硝酸钠NaNO2主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物制备产品NaNO2。
已知: ,
,
回答下列问题:
(1)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和如图装置(净化装置略去),选出一种可行的方法,写出化学方程式___________ 。
【可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)】
实验时装置B中应间断性通入适量的O2,其目的是___________ 。
(2)装置A中盛装稀硝酸的仪器的名称是___________ ;NO不能单独被纯碱溶液吸收,若要使氮的氧化物完全被纯碱溶液吸收且产品纯度最高,则n(NO):n(NO2)=___________ 。
(3)装置D中倒置漏斗的作用是___________ ,NaClO将NO氧化成NO ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。工业上也用NaClO溶液吸收硝酸尾气,其他条件相同,加入稀盐酸调节NaClO溶液pH会促进NO转化为NO ,原因是
,原因是___________ 。
(4)设计实验探究NaNO2的性质。实验完毕后,从装置C中分离出NaNO2固体粗产品,取少量上述产品配制成溶液,分成2份分别进行甲、乙两组实验,实验操作及现象、结论如表。
①上述实验___________ (填标号)的结论不可靠,理由是___________ 。
②经实验测得实验乙反应后的溶液中氮元素仅以NO 的形式存在,酸性KMnO4溶液与NO
的形式存在,酸性KMnO4溶液与NO 反应的离子方程式为
反应的离子方程式为___________ 。

已知:
 ,
,
回答下列问题:
(1)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和如图装置(净化装置略去),选出一种可行的方法,写出化学方程式

【可供选择的试剂:CuO(s)、NH3(g)、Cl2(g)、O2(g)、饱和NaNO2(aq)、饱和NH4Cl(aq)】
实验时装置B中应间断性通入适量的O2,其目的是
(2)装置A中盛装稀硝酸的仪器的名称是
(3)装置D中倒置漏斗的作用是
 ,写出该反应的离子方程式
,写出该反应的离子方程式 ,原因是
,原因是(4)设计实验探究NaNO2的性质。实验完毕后,从装置C中分离出NaNO2固体粗产品,取少量上述产品配制成溶液,分成2份分别进行甲、乙两组实验,实验操作及现象、结论如表。
| 实验操作及现象 | 结论 | |
| 甲 | 滴加少量酸性KI-淀粉溶液,振荡,溶液变蓝 | 酸性条件下NO 具有氧化性 具有氧化性 |
| 乙 | 滴加少量酸性KMnO4溶液,振荡,紫色褪去 | 酸性条件下NO 具有还原性 具有还原性 |
②经实验测得实验乙反应后的溶液中氮元素仅以NO
 的形式存在,酸性KMnO4溶液与NO
的形式存在,酸性KMnO4溶液与NO 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
名校
9 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
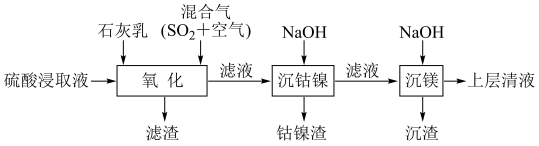
回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为___________ 。(答出一条即可)
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ 。(H2SO5的电离第一步完全,第二步微弱)
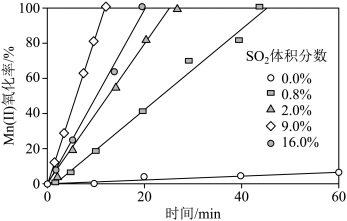
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)将“钴镍渣”酸溶后,进行如下流程:
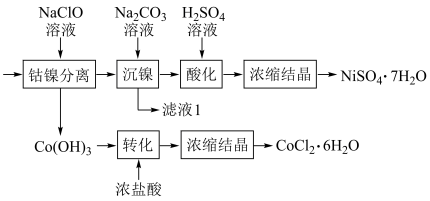
①写出“钴镍分离”时发生反应的离子方程式:___________ 。
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___________ (要求写出计算过程)。[已知:Ksp(NiCO3)=1.0×10-7,沉镍率= ]
]

回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是

(5)将“钴镍渣”酸溶后,进行如下流程:

①写出“钴镍分离”时发生反应的离子方程式:
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率= ]
]
您最近一年使用:0次
名校
解题方法
10 .  在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(1)在 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备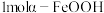 理论上需要
理论上需要 的物质的量为
的物质的量为___________  ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(2) 的结构中,每个
的结构中,每个 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构___________ 。 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。___________ 。
②工业可使用四氯乙烯 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是___________ 。
③部分环状分子(如苯)中由于存在大 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是___________ 。
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(1)在
 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备
 理论上需要
理论上需要 的物质的量为
的物质的量为 ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(2)
 的结构中,每个
的结构中,每个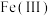 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构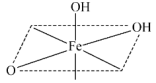
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。
②工业可使用四氯乙烯
 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是③部分环状分子(如苯)中由于存在大
 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是
您最近一年使用:0次
2024-02-13更新
|
708次组卷
|
4卷引用:江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题



