1 . 还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)= 2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________ kJ·mol-1。
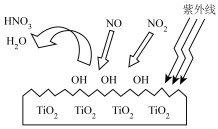
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如图所示,OH与NO2的反应为NO2+OH=HNO3。写出OH与NO反应的化学方程式:___________ 。
(3)下图所示的装置能吸收和转化NO2、NO和SO2。

①阳极区的电极反应式为____ 。
②阴极排出的溶液中含S2O 离子,能吸收NOx气体,生成的SO
离子,能吸收NOx气体,生成的SO 可在阴极区再生。将S2O
可在阴极区再生。将S2O 吸收NO2的离子方程式配平,并在方格内填上相应物质:____ S2O
吸收NO2的离子方程式配平,并在方格内填上相应物质:____ S2O +____NO2+____OH-=____ SO
+____NO2+____OH-=____ SO +____N2+________
+____N2+________________
③已知阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为________ 。
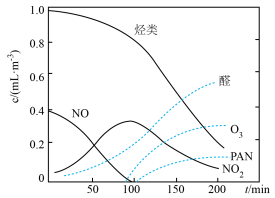
(4)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:________ 。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)= 2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应C(s)+2NO(g)=CO2(g)+N2(g) ΔH=
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如图所示,OH与NO2的反应为NO2+OH=HNO3。写出OH与NO反应的化学方程式:

(3)下图所示的装置能吸收和转化NO2、NO和SO2。

①阳极区的电极反应式为
②阴极排出的溶液中含S2O
 离子,能吸收NOx气体,生成的SO
离子,能吸收NOx气体,生成的SO 可在阴极区再生。将S2O
可在阴极区再生。将S2O 吸收NO2的离子方程式配平,并在方格内填上相应物质:____ S2O
吸收NO2的离子方程式配平,并在方格内填上相应物质:____ S2O +____NO2+____OH-=____ SO
+____NO2+____OH-=____ SO +____N2+________
+____N2+________③已知阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为
(4)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:

您最近一年使用:0次
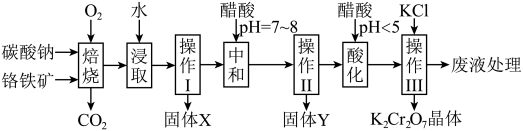
2 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO•Cr2O3+8Na2CO3+7O2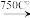 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3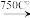 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;
③Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是_____ 。
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是_____
(3)操作III有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、_____ 、过滤、_____ 、干燥。
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量_____ (填写试剂)、溶解、过滤、再通入足量_____ 气体.......灼烧、冷却、称量,得干燥固体m g。计算样品中氢氧化铝的质量分数为_____ (用含m、n的代数式表示)。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为_____ 。(保留3位有效数字)
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O +6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O =2I-+S4O
=2I-+S4O

已知:①4FeO•Cr2O3+8Na2CO3+7O2
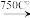 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3
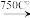 2NaAlO2 +CO2↑;
2NaAlO2 +CO2↑;③Cr2O72-+H2O
 2CrO42-+2H+
2CrO42-+2H+根据题意回答下列问题:
(1)操作I的名称是
(2)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是:Na2Cr207 + 2KCl=K2Cr2O7 ↓+ 2NaCl,该反应在溶液中能发生的理由是
物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度 (g/100g 水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 73 | 376 | |
(3)操作III有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min。然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2SO3标准溶液滴定若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为
已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O =2I-+S4O
=2I-+S4O
您最近一年使用:0次
2016-12-09更新
|
699次组卷
|
2卷引用:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷
3 . 锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是_____________ 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③_________________ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是_________ ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是_____________ 。
(5)步骤Ⅳ中,在_____ (填“阴”或“阳”)极析出Mn,电极反应方程式为_________ 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥_____ mol·L-1。

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是
(4)步骤Ⅲ中,滤渣2的主要成分是
(5)步骤Ⅳ中,在
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥
您最近一年使用:0次
解题方法
4 . 某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2 + FeS + H2SO4=MnSO4 + Fe2(SO4)3 + S + H2O________
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。

a.操作①中加Zn粉后发生反应的离子方程式为______________________________ 。
b.操作②中加入适量X的作用是什么__________ ;X的首选物的化学式是__________ 。
c.操作③中所加碳酸盐的化学式是______________________________ 。
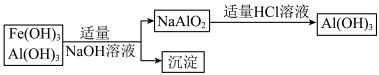
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图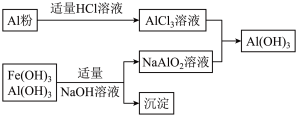
a.AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为________________________ ,若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为_____ 、_____ 。
b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量____ ?
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2 + FeS + H2SO4=MnSO4 + Fe2(SO4)3 + S + H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。

a.操作①中加Zn粉后发生反应的离子方程式为
b.操作②中加入适量X的作用是什么
c.操作③中所加碳酸盐的化学式是
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图

a.AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为
b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量

您最近一年使用:0次
2016-12-09更新
|
424次组卷
|
2卷引用:2015届江苏常州市高三第一次调研试卷化学试卷
解题方法
5 . 有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:

(1)“焙烧1”通入空气的目的是________________ 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式__________ 。
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是_________________ 。
(4)写出“焙烧2”发生反应的化学方程式:_____________________________ 。
(5)Pd中加入王水的反应可以表示为:Pd+HCl+HNO3 → A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为:____________ 。

(1)“焙烧1”通入空气的目的是
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是
(4)写出“焙烧2”发生反应的化学方程式:
(5)Pd中加入王水的反应可以表示为:Pd+HCl+HNO3 → A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为:
您最近一年使用:0次
14-15高三上·江苏南京·阶段练习
解题方法
6 . 硫铁矿烧渣的主要成分为Fe2O3、Fe3O4,以及少量SiO2、Al2O3等。由硫铁矿烧渣制备铁红(Fe2O3)的一种工艺流程如下:

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
(1)“酸浸、过滤”步骤中所得滤液中的金属阳离子有(填离子符号)________________ 。
(2)Fe粉除调pH外,另一个作用是___________ ;Fe粉调节溶液的pH为__________ 。
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为_______________________________ ;
所得滤液的主要溶质是(填化学式)_______________ 。
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为______________________________ 。

已知:还原焙烧时,大部分Fe2O3、Fe3O4转化为FeO。
几种离子开始沉淀和完全沉淀时的pH如下表所示:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
(2)Fe粉除调pH外,另一个作用是
(3)“沉淀、过滤”步骤中生成FeCO3的离子方程式为
所得滤液的主要溶质是(填化学式)
(4)高温条件下,“氧化”步骤中发生反应的化学方程式为
您最近一年使用:0次
2014·江苏扬州·一模
解题方法
7 . 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是_____ (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是_______ 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是__ ;反应Ⅲ的化学方程式为________________ 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是_________________________ 。
② 滴定过程中,至少须平行测定两次的原因是________________________ 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为__________ mol·L-1(用含字母的代数式表示)。

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是
② 滴定过程中,至少须平行测定两次的原因是
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为
您最近一年使用:0次
2016-12-09更新
|
1483次组卷
|
5卷引用:2014届江苏省扬州中学高三年级模拟考试化学试卷
(已下线)2014届江苏省扬州中学高三年级模拟考试化学试卷(已下线)2014届江苏省高三百校联合调研测试(一)化学试卷(已下线)2014届江苏启东中学第二学期期中考试高二实验班化学试卷2017届内蒙古赤峰市宁城县高三上统一考试化学试卷陕西省汉中市龙岗学校2019-2020学年高二上学期期末考试化学试题
8 . 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
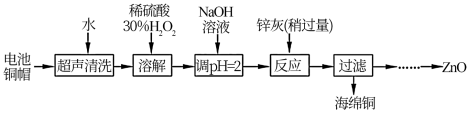
(1)①铜帽溶解时加入H 2 O 2 的目的是____________ (用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2 除去。除去H 2 O 2 的简便方法是___________ 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O +I 2 =2I-+S4O
+I 2 =2I-+S4O
①滴定选用的指示剂为_____ ,滴定终点观察到的现象为 ___________ 。
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会___________ (填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①___________ ;② ___________ ;③过滤;④___________ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。

(1)①铜帽溶解时加入H 2 O 2 的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H 2 O 2 后溶液中Cu 2 + 的含量。
实验操作为:准确量取一定体积的含有Cu 2 + 的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3 标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O
 +I 2 =2I-+S4O
+I 2 =2I-+S4O
①滴定选用的指示剂为
②若滴定前溶液中的H 2 O 2 没有除尽,所测定的Cu 2 + 含量将会
(3)已知pH>11 时Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2- 。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 molL -1 计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
 | 1.1 | 3.2 |
 | 5.8 | 8.8 |
 | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2 、1. 0 molL -1 HNO3 、1. 0 molL -1 NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①
您最近一年使用:0次
2016-12-09更新
|
770次组卷
|
5卷引用:2012年普通高等学校招生全国统一考试化学(江苏卷)
13-14高三上·江苏扬州·阶段练习
解题方法
9 . 多晶硅生产工艺流程如图:
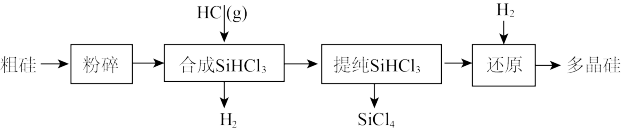
(1)粗硅粉碎的目的是_______ 。分离SiHCl3 (l)和SiCl4(l)的方法为_______ 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)⇌Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K =_______ 。为提高还原时SiHCl3的转化率,可采取的措施有_______ 。
(3)该流程中可以循环使用的物质是_______ 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为_______ 。

(1)粗硅粉碎的目的是
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3 (g)+ H2 (g)⇌Si (s) + 3HCl (g) ΔH >0,其平衡常数表达式为K =
(3)该流程中可以循环使用的物质是
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为
您最近一年使用:0次
2013·江苏·二模
解题方法
10 . “神七”登天谱写了我国航天事业的新篇章。火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂。
(1)已知:N2(g) + 2O2(g) =2NO2(g) ∆H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) ∆H=-534.0 kJ·mol-1
2NO2(g)⇌ N2O4(g) ∆H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:_______ 。
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如表:
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=_______ 。
②温度T1和T2的大小关系是T1_______ T2(填“>”、 “<”或“=”)。
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为_______ 。有人提出,可以设计反应2CO=2C+O2(∆H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由_______ 。
(5)如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。
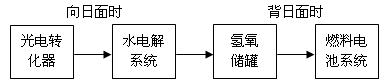
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为_______ mol。
(1)已知:N2(g) + 2O2(g) =2NO2(g) ∆H=+67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) ∆H=-534.0 kJ·mol-1
2NO2(g)⇌ N2O4(g) ∆H=-52.7 kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:
(3)一定条件下,在2L密闭容器中起始投入2 mol NH3和4 mol O2发生反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH<0
测得平衡时数据如表:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
①在温度T1下,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=
②温度T1和T2的大小关系是T1
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应为
(5)如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液。

如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为
您最近一年使用:0次



