名校
1 . 丙烯腈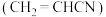 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN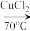 CH2=CHCN
CH2=CHCN
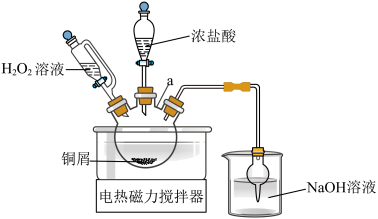
Ⅰ.制备催化剂
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与 在浓盐酸中反应
在浓盐酸中反应
方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示 的名称
的名称___________ 。
②请用离子方程式表达,写出方案1的反应原理___________ 。
(2)用恒压滴液漏斗分批多次滴加 ,且
,且 过量,原因是
过量,原因是___________ 。
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为___________ 。
Ⅱ.合成丙烯腈 ,还含有少量硫化钙
,还含有少量硫化钙
②易挥发,有毒,具有较强的还原性
(4) 的电子式
的电子式___________ 。
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是___________ 。
(6)从下列选择装置D中可盛放的溶液___________。
(7)工业用 含
含 质量分数
质量分数 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈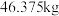 ,计算产率
,计算产率_______ 。(写出计算过程)
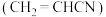 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN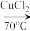 CH2=CHCN
CH2=CHCNⅠ.制备催化剂

(1)通过查阅资料有两种方案可以制备
方案1:铜屑与
 在浓盐酸中反应
在浓盐酸中反应方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示
 的名称
的名称②请用离子方程式表达,写出方案1的反应原理
(2)用恒压滴液漏斗分批多次滴加
 ,且
,且 过量,原因是
过量,原因是(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体
 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为Ⅱ.合成丙烯腈
 ,还含有少量硫化钙
,还含有少量硫化钙②易挥发,有毒,具有较强的还原性
(4)
 的电子式
的电子式(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是
(6)从下列选择装置D中可盛放的溶液___________。
| A.高锰酸钾溶液 | B. 溶液 溶液 | C.饱和食盐水 | D.盐酸溶液 |
(7)工业用
 含
含 质量分数
质量分数 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈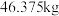 ,计算产率
,计算产率
您最近一年使用:0次
名校
解题方法
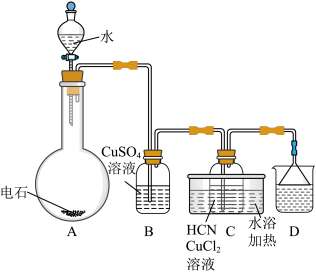
2 . 实验室以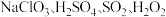 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示:
②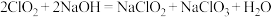
③ 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于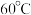 时,
时, 发生分解生成
发生分解生成 和
和 。
。
(1)反应1中 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为___________ 。
(2)在图1所示装置中发生反应2生成 ,反应过程中放出大量的热。
,反应过程中放出大量的热。 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是___________ 。
②装置Ⅱ的作用是___________ 。
(3)反应结束后,为从母液2中获得 晶体,需进行以下操作:
晶体,需进行以下操作:
①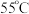 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用___________  热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。
(4) 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:___________ ,用无水乙醇洗涤,干燥得到产品。
(可选用的试剂: 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)
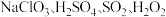 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示: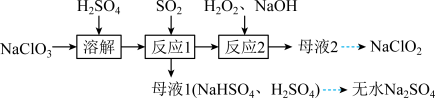

②
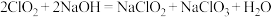
③
 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于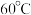 时,
时, 发生分解生成
发生分解生成 和
和 。
。(1)反应1中
 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为(2)在图1所示装置中发生反应2生成
 ,反应过程中放出大量的热。
,反应过程中放出大量的热。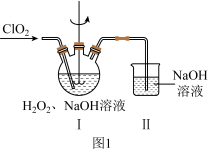
 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是②装置Ⅱ的作用是
(3)反应结束后,为从母液2中获得
 晶体,需进行以下操作:
晶体,需进行以下操作:①
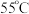 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用 热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。(4)
 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:(可选用的试剂:
 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)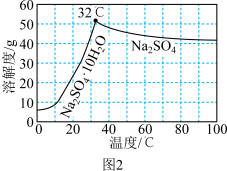
您最近一年使用:0次
名校
解题方法
3 . 实验室利用 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为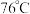 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。
(1)①实验开始先通 ,一段时间后,先加热装置
,一段时间后,先加热装置___________ (填“ ”或“
”或“ ”)。
”)。
装置 内发生反应的化学方程式为
内发生反应的化学方程式为___________ 。
装置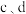 共同起到的作用是
共同起到的作用是___________ 。
②现有含少量杂质的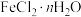 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为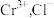 不反应)。
不反应)。
实验Ⅱ:另取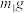 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。
则
___________ ;下列情况会导致 测量值偏小的是
测量值偏小的是___________ (填标号)。
A.样品中含少量 杂质
杂质
B.样品与 反应时失水不充分
反应时失水不充分
 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解
(2)①用上述装置,根据反应 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式___________ ,选择合适仪器并组装蒸馏装置对 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号)。 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在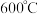 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
该温度下, 与
与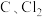 ,反应的总化学方程式为
,反应的总化学方程式为___________ ;
随着温度升高,尾气中 的含量升高,原因是
的含量升高,原因是___________ 。
 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为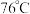 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。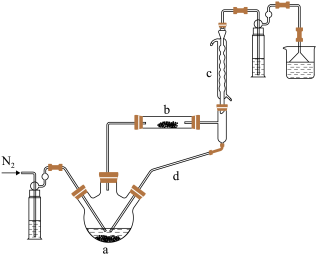
(1)①实验开始先通
 ,一段时间后,先加热装置
,一段时间后,先加热装置 ”或“
”或“ ”)。
”)。装置
 内发生反应的化学方程式为
内发生反应的化学方程式为装置
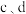 共同起到的作用是
共同起到的作用是②现有含少量杂质的
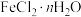 ,为测定
,为测定 值进行如下实验:
值进行如下实验:实验Ⅰ:称取
 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为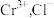 不反应)。
不反应)。实验Ⅱ:另取
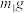 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。则

 测量值偏小的是
测量值偏小的是A.样品中含少量
 杂质
杂质B.样品与
 反应时失水不充分
反应时失水不充分 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解(2)①用上述装置,根据反应
 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在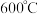 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:| 物质 |  |  |  |  |
| 体积分数 |  | 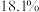 |  |  |
 与
与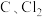 ,反应的总化学方程式为
,反应的总化学方程式为随着温度升高,尾气中
 的含量升高,原因是
的含量升高,原因是
您最近一年使用:0次
名校
解题方法
4 . 氮、磷、砷 、锑
、锑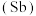 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1) 中
中 键和
键和 键的数目比例是
键的数目比例是___________ ,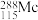 的中子数为
的中子数为___________ 。
(2)①已知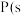 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;
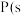 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;
由此推知,其中最稳定的磷单质是___________ 。
②比较氮和磷氢化物的热稳定性:
___________  (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式___________ 。
③ 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。
下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是___________ (填序号)。
 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解
(3)已知 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为___________ 、___________ 。
(4) 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(5)某工厂采用辉铋矿(主要成分为 ,含有
,含有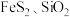 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示: 分解为
分解为 转变为
转变为 ;
;
②金属活动性: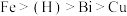 ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
① 在元素周期表中的位置是
在元素周期表中的位置是___________ ,基态原子价层电子排布式为___________ 。
② 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
③滤渣的主要成分为___________ (填化学式)。
④生成气体 的离子方程式为
的离子方程式为___________ 。
⑤加入金属 的目的是
的目的是___________ 。
 、锑
、锑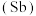 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:(1)
 中
中 键和
键和 键的数目比例是
键的数目比例是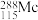 的中子数为
的中子数为(2)①已知
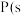 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;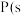 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;由此推知,其中最稳定的磷单质是
②比较氮和磷氢化物的热稳定性:

 (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式③
 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。下列对
 与
与 反应产物的推断正确的是
反应产物的推断正确的是 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解(3)已知
 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为(4)
 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式(5)某工厂采用辉铋矿(主要成分为
 ,含有
,含有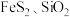 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示:
 分解为
分解为 转变为
转变为 ;
;②金属活动性:
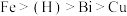 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
 在元素周期表中的位置是
在元素周期表中的位置是②
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为③滤渣的主要成分为
④生成气体
 的离子方程式为
的离子方程式为⑤加入金属
 的目的是
的目的是
您最近一年使用:0次
名校
解题方法
5 . 有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: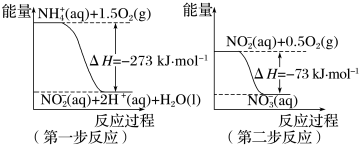
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
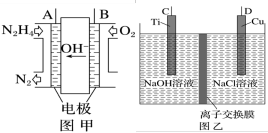
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
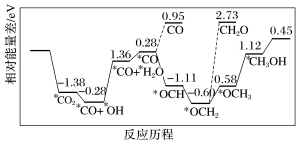
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。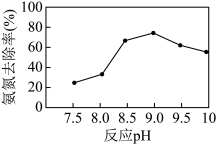
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近一年使用:0次
名校
6 . CoO可用于制取催化剂,可以由含钴废料(主要成分为Co2O3,还含有少量SiO2、Fe2O3、Al2O3 和MgO)经过如下过程进行制取:
①写出“浸取”时Co2O3所发生反应的离子方程式:___________ 。
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为___________ 。
(2)已知:
①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
补充完整由“浸取液”制取CoC2O4·2H2O的实验方案:取一定量的浸取液,___________ ,过滤,向滤液中滴加2 mol·L-1 (NH4)2C2O4溶液……得到CoC2O4·2H2O晶体(实验中须使用的试剂:2 mol·L-1的氨水、5%的H2O2溶液、K3[Fe(CN)6]溶液、1 mol·L-1的NH4F溶液)。
(3)已知:Ksp(CoC2O4)=4×10-8、Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=5×10-5。
①反应Co2++H2C2O4 CoC2O4↓+2H+的平衡常数为
CoC2O4↓+2H+的平衡常数为___________ 。
②制取CoC2O4·2H2O时使用(NH4)2C2O4溶液而不是Na2C2O4溶液的原因是___________ 。
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol·L-1酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至250 mL。
③取25.00 mL溶液,用0.100 0 mol·L-1 FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数,并写出计算过程___________ 。[已知:M(CoC2O4·2H2O)=183]

①写出“浸取”时Co2O3所发生反应的离子方程式:
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为
(2)已知:
①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Co2+ | Mg2+ | |
| 开始沉淀pH | 1.9 | 3.4 | 6.9 | 6.6 | 9.1 |
| 沉淀完全pH | 3.2 | 4.7 | 8.9 | 9.2 | 11.1 |
(3)已知:Ksp(CoC2O4)=4×10-8、Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=5×10-5。
①反应Co2++H2C2O4
 CoC2O4↓+2H+的平衡常数为
CoC2O4↓+2H+的平衡常数为②制取CoC2O4·2H2O时使用(NH4)2C2O4溶液而不是Na2C2O4溶液的原因是
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol·L-1酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至250 mL。
③取25.00 mL溶液,用0.100 0 mol·L-1 FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数,并写出计算过程
您最近一年使用:0次
解题方法
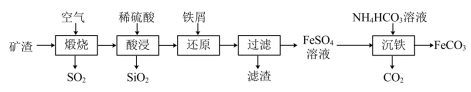
7 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。 的反应外,还发生反应的
的反应外,还发生反应的离子方程式 有___________ 、___________ 。
(2)检验Fe3+是否完全被还原的实验操作是___________ 。
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度___________ 。(写出计算过程)
(4)制备 FeCO3.写出“沉铁”步骤发生反应的离子方程式 :___________ 。
 的反应外,还发生反应的
的反应外,还发生反应的(2)检验Fe3+是否完全被还原的实验操作是
(3)FeSO4溶液浓度的测定。取制得的FeSO4溶液25.00mL,置于锥形瓶中,加入一定量的酸溶液,用0.1000mol/L的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液19.50mL。计算FeSO4溶液的物质的是浓度
(4)制备 FeCO3.写出“沉铁”步骤发生反应的
您最近一年使用:0次
名校
8 . 氰化氢(HCN,一元弱酸,易挥发)主要应用于电镀、采矿、药物合成等工业生产。HCN,CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,___________ 。
(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是___________ 。
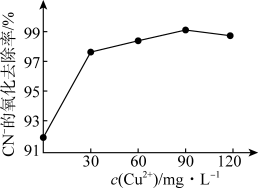
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是___________ 。 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g) NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0
除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是___________ 。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是
 ,其反应的离子方程式为
,其反应的离子方程式为(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g)
 NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近一年使用:0次
名校
解题方法
9 . V2O5(五氧化二钒)可作化学工业中的催化剂。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
②部分含钒物质常温下在水中的溶解性如表所示:
③ +2OH-
+2OH-
 +H2O
+H2O
回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为___________ 。
(2)在第Ⅱ步中需要加入氨水,请结合 +2OH-
+2OH-
 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为___________ 。
(3)需在流动空气中加热NH4VO3的原因可能是___________ 。
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___________ (保留4位有效数字)。(已知:I2+2 Na2S2O3= Na2S4O6+2NaI,写出计算过程)

②部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 +2OH-
+2OH-
 +H2O
+H2O回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为
(2)在第Ⅱ步中需要加入氨水,请结合
 +2OH-
+2OH-
 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为(3)需在流动空气中加热NH4VO3的原因可能是
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为
您最近一年使用:0次
名校
解题方法
10 . 钼(Mo)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1) 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
(3) 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为_______ ,结合图1中信息说明理由:_______ 。 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为_______ (填标号)。
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为: ,放电时负极的电极反应式为
,放电时负极的电极反应式为_______ 。
 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下: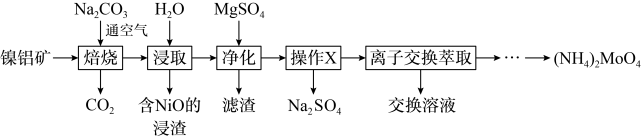
(1)
 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为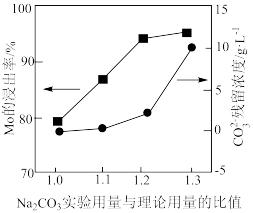
 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为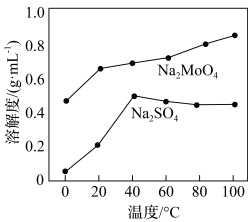
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为:
 ,放电时负极的电极反应式为
,放电时负极的电极反应式为
您最近一年使用:0次



