解题方法
1 . 实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的实验流程如下:___________ 。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是___________ 。
(3)用NaOH溶液调节pH=2的目的是___________ 。
(4)滤渣中的主要物质是___________ (填化学式)。
(5)“沉锌”时生成碱式碳酸锌[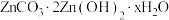 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。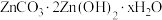 中x的值为
中x的值为___________ (写出计算过程)。
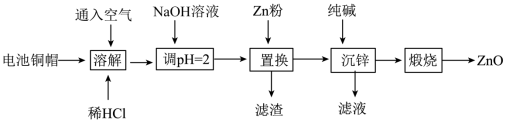
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是
(3)用NaOH溶液调节pH=2的目的是
(4)滤渣中的主要物质是
(5)“沉锌”时生成碱式碳酸锌[
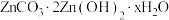 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。
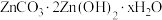 中x的值为
中x的值为
您最近一年使用:0次
名校
2 . 利用含钴废料(主要成分为Co3O4,还含有少量SiO2、Fe2O3、Al2O3等杂质)制备LiCoO2的工艺如下。
回答下列问题:
(1)“酸浸”时_______ (填“可”或“不可”)用SO2代替H2O2。
(2)写出沉钴的离子反应方程式:_______ 。
(3)“调pH”的范围为4.5~7.8,滤液中残留的
_______ 。
(4)“高温焙烧"时的化学方程式:_______ 。

| 金属离子 | Fe2+ | Fe3+ | Al3+ | Co2+ |
| 开始沉淀的pH | 8.5 | 2.2 | 3.4 | 7.8 |
| 完全沉淀[c(金属离子)≤1×10-5mol/L]的pH | 10.0 | 3.0 | 4.5 | 9.4 |
(1)“酸浸”时
(2)写出沉钴的离子反应方程式:
(3)“调pH”的范围为4.5~7.8,滤液中残留的

(4)“高温焙烧"时的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一、请回答下列问题:
(1)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),一定温度下,在容积为10L的恒容密闭容器中进行该反应,起始时充入0.4molCO、0.3molNO,1min达平衡,测得CO的物质的量为0.16mol,则
①从开始到平衡时的反应速率v(CO)=_______ mol·L-1·min-1。
②NO的平衡转化率为_______ 。
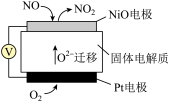
(2)研究在相同时间内不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的可能原因是_______ 。_______ 反应。(填“氧化”或“还原”)
②外电路中,电子流动方向是_______ (填A或B)。
A.从 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极
③ 电极上的电极反应式为
电极上的电极反应式为_______ 。
(4)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的 排放,SCR(选择性催化还原)工作原理如图b所示,NSR(
排放,SCR(选择性催化还原)工作原理如图b所示,NSR( 储存还原)工作原理如图c所示。
储存还原)工作原理如图c所示。 )的水溶液热分解为
)的水溶液热分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
②SCR催化过程中,当燃油中含硫量较高时,尾气中 在
在 作用下会形成
作用下会形成 ,使催化剂中毒,用化学方程式表示
,使催化剂中毒,用化学方程式表示 的形成:
的形成:_______ 。
③NSR转换中,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,图中NO的去除机理可描述为
的储存和还原,图中NO的去除机理可描述为_______ 。
(1)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),一定温度下,在容积为10L的恒容密闭容器中进行该反应,起始时充入0.4molCO、0.3molNO,1min达平衡,测得CO的物质的量为0.16mol,则
①从开始到平衡时的反应速率v(CO)=
②NO的平衡转化率为
(2)研究在相同时间内不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的可能原因是

②外电路中,电子流动方向是
A.从
 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极③
 电极上的电极反应式为
电极上的电极反应式为(4)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的
 排放,SCR(选择性催化还原)工作原理如图b所示,NSR(
排放,SCR(选择性催化还原)工作原理如图b所示,NSR( 储存还原)工作原理如图c所示。
储存还原)工作原理如图c所示。
 )的水溶液热分解为
)的水溶液热分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②SCR催化过程中,当燃油中含硫量较高时,尾气中
 在
在 作用下会形成
作用下会形成 ,使催化剂中毒,用化学方程式表示
,使催化剂中毒,用化学方程式表示 的形成:
的形成:③NSR转换中,通过
 和
和 的相互转化实现
的相互转化实现 的储存和还原,图中NO的去除机理可描述为
的储存和还原,图中NO的去除机理可描述为
您最近一年使用:0次
解题方法
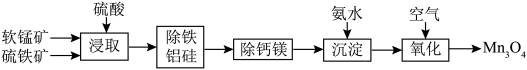
4 . 以软锰矿(主要成分为 ,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分
,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分 )为原料,两矿联合浸取可制备大颗粒的电池用
)为原料,两矿联合浸取可制备大颗粒的电池用 。
。 和
和 颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。
颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。 的电子排布式为:
的电子排布式为:___________ 。
②若 原电池中生成单质S,其电池总反应的离子方程式为
原电池中生成单质S,其电池总反应的离子方程式为___________ 。
③随硫铁矿的增加,锰的浸出率降低,可能的原因是___________ 。
(2)除钙镁:向已除去Fe、Al、Si元素的 溶液中(pH约为5)加入
溶液中(pH约为5)加入 溶液,将
溶液,将 、
、 转化为氟化物沉淀。则
转化为氟化物沉淀。则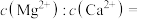
___________ 。
[已知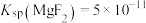 ,
,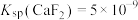 ]
]
(3)氧化:将“沉淀”步骤所得含少量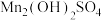 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得 。
。
①写出由 反应得到
反应得到 的化学方程式
的化学方程式___________ 。
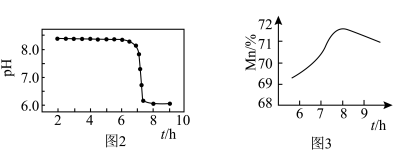
②沉淀加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是___________ 。___________ 。
 ,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分
,还含少量Fe、Si、Al、Ca、Mg等的氧化物)和硫铁矿(主要成分 )为原料,两矿联合浸取可制备大颗粒的电池用
)为原料,两矿联合浸取可制备大颗粒的电池用 。
。
 和
和 颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。
颗粒构成两个原电池反应,其原理如图1所示(部分产物未标出)。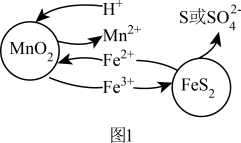
 的电子排布式为:
的电子排布式为:②若
 原电池中生成单质S,其电池总反应的离子方程式为
原电池中生成单质S,其电池总反应的离子方程式为③随硫铁矿的增加,锰的浸出率降低,可能的原因是
(2)除钙镁:向已除去Fe、Al、Si元素的
 溶液中(pH约为5)加入
溶液中(pH约为5)加入 溶液,将
溶液,将 、
、 转化为氟化物沉淀。则
转化为氟化物沉淀。则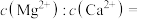
[已知
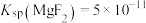 ,
,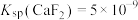 ]
](3)氧化:将“沉淀”步骤所得含少量
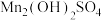 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得 。
。①写出由
 反应得到
反应得到 的化学方程式
的化学方程式②沉淀加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是
您最近一年使用:0次
名校
解题方法
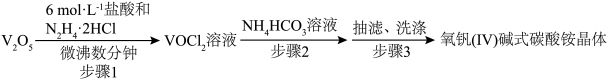
5 . 氧钒(Ⅳ)碱式碳酸铵为紫色晶体,难溶于水,是制备热敏材料VO2的原料,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:
(1)V基态核外电子排布式为_______ 。N2H4·2HCl为离子化合物,1molN2H4·2HCl中含有的σ键数目为________ 。
(2)步骤1中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为______ 。
(3)步骤2可在如图装置(气密性良好)中进行。制备过程中,需向锥形瓶中通入CO2,作用是_________ ,所得紫色晶体残留的杂质离子主要为________ 。________ 。
(1)V基态核外电子排布式为
(2)步骤1中生成VOCl2的同时生成一种无色无污染的气体,该反应的化学方程式为
(3)步骤2可在如图装置(气密性良好)中进行。制备过程中,需向锥形瓶中通入CO2,作用是

您最近一年使用:0次
6 . 实验室模拟“高炉煤气”(主要成分为: 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体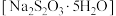 ,其部分实验过程如下:
,其部分实验过程如下: 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: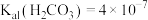 ,
,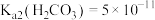 ;
;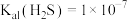 ,
,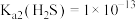 ;
;
(1)用70%硫酸和亚硫酸钠固体制取 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是___________ 。
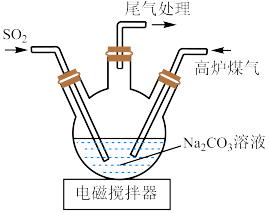
(2)三颈烧瓶中制取 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。
① 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: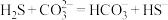 。该反应的平衡常数
。该反应的平衡常数
___________ 。
②写出三颈烧瓶中得到 的化学方程式
的化学方程式___________ 。
(3)尾气中含有大量 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为: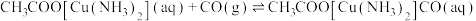
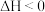
①研究发现尾气中过量 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是___________ 。
②写出吸收液再生的一种方法:___________ ,同时释放 ,达到资源化利用。
,达到资源化利用。
(4) 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: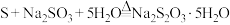 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取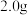 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中,___________ 。(实验中还需要使用的试剂有:乙醇、蒸馏水。)已知: 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:
 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体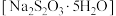 ,其部分实验过程如下:
,其部分实验过程如下: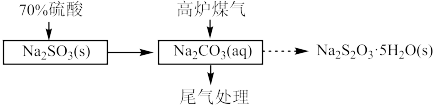
 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: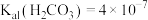 ,
,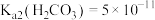 ;
;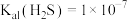 ,
,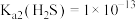 ;
;(1)用70%硫酸和亚硫酸钠固体制取
 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是(2)三颈烧瓶中制取
 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。①
 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: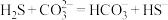 。该反应的平衡常数
。该反应的平衡常数
②写出三颈烧瓶中得到
 的化学方程式
的化学方程式(3)尾气中含有大量
 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为: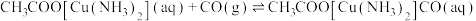
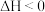
①研究发现尾气中过量
 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是②写出吸收液再生的一种方法:
 ,达到资源化利用。
,达到资源化利用。(4)
 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: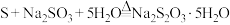 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取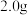 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中, 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:| 温度/℃ | 0 | 10 | 20 | 30 | 40 |
| 溶解度/g | 50.2 | 59.7 | 70.1 | 83.2 | 104 |
您最近一年使用:0次
名校
7 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为_________ (答出一条即可)。
(2)已知:“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),
), 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素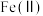 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为________ ;再加入石灰乳,所得滤渣中主要成分是 、
、________ 。
②通入混合气中 的体积分数与
的体积分数与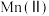 氧化率随时间的变化关系如图所示,
氧化率随时间的变化关系如图所示, ,相同时间内
,相同时间内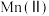 氧化率较低的原因是
氧化率较低的原因是________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是________ 。
(3)将“钴镍渣”酸溶后,进行“钴镍分离”
①写出加入 溶液后生成Co(OH)3沉淀的离子方程式
溶液后生成Co(OH)3沉淀的离子方程式________ 。
②若“镍钴分离”后溶液中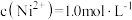 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中 ,则沉镍率=
,则沉镍率=________ 。[已知: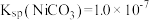 ,沉镍率=
,沉镍率=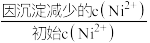 ]
]
(4)据报道,只含镁、镍和碳三种元素的晶体可具有超导性。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(如图),则该晶体中镁、碳、镍三种元素的原子个数比是____ ,晶体中每个镁原子周围距离最近的镍原子有________ 个。
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。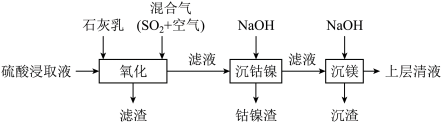
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)已知:“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),
), 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
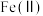 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与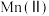 氧化率随时间的变化关系如图所示,
氧化率随时间的变化关系如图所示,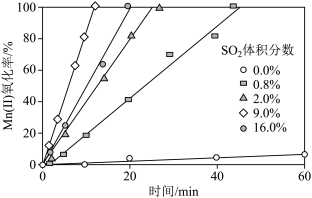
 ,相同时间内
,相同时间内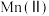 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是(3)将“钴镍渣”酸溶后,进行“钴镍分离”
①写出加入
 溶液后生成Co(OH)3沉淀的离子方程式
溶液后生成Co(OH)3沉淀的离子方程式②若“镍钴分离”后溶液中
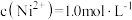 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中 ,则沉镍率=
,则沉镍率=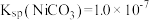 ,沉镍率=
,沉镍率=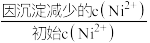 ]
](4)据报道,只含镁、镍和碳三种元素的晶体可具有超导性。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(如图),则该晶体中镁、碳、镍三种元素的原子个数比是
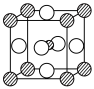
(图中:碳原子用小 球在晶体的体心,镍原子用大
球在晶体的体心,镍原子用大 球,镁原子用大
球,镁原子用大 球)
球)
您最近一年使用:0次
名校
8 . “氨的催化氧化”是工业生产硝酸的重要步骤,某化学课外活动小组设计模拟该实验过程,用水吸收制取硝酸,并用硝酸制取 晶体:
晶体:  制取
制取 和
和 的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为 ________ (写化学式)。
(2)装置A制得的混合气体需要干燥,请选择合适的干燥剂_____ 。 填字母代号
填字母代号
a.浓硫酸 b.无水氯化钙 c.碱石灰
(3)氨气在装置 中发生催化氧化,若条件控制不当,
中发生催化氧化,若条件控制不当, 中可能发生副反应,
中可能发生副反应, 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 ,该副反应的化学方程式为
,该副反应的化学方程式为_____ 。
(4)若产生的氮氧化物尾气 含
含 、
、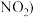 用氨气为还原剂进行催化还原,主要反应如下:
用氨气为还原剂进行催化还原,主要反应如下:
①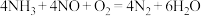 ②
②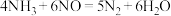
当反应温度过高时, 会发生以下反应:
会发生以下反应:
③ ④
④
随着反应温度升高,脱硝效率降低的原因可能是______ 。
(5)可用 将氮氧化物转化成
将氮氧化物转化成 。向含
。向含 的溶液中加入
的溶液中加入 溶液调节至碱性,
溶液调节至碱性, 转化为去除氮氧化物效果更好的
转化为去除氮氧化物效果更好的 ,再通入
,再通入 气体进行反应。碱性条件下
气体进行反应。碱性条件下 去除
去除 反应的离子方程式为
反应的离子方程式为 ______ 。
(6)设计以某工业废水(含 、
、 、
、 )为原料,制取
)为原料,制取 晶体的实验方案:
晶体的实验方案:_____  的溶解度曲线如图
的溶解度曲线如图 所示;实验中须使用的试剂:稀
所示;实验中须使用的试剂:稀 、
、 溶液
溶液 。
。
 晶体:
晶体: 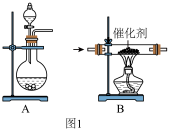
 制取
制取 和
和 的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为
的混合气体,分液漏斗内为浓氨水,则圆底烧瓶中加入的固体药品为 (2)装置A制得的混合气体需要干燥,请选择合适的干燥剂
 填字母代号
填字母代号
a.浓硫酸 b.无水氯化钙 c.碱石灰
(3)氨气在装置
 中发生催化氧化,若条件控制不当,
中发生催化氧化,若条件控制不当, 中可能发生副反应,
中可能发生副反应, 与
与 在加热和催化剂作用下生成
在加热和催化剂作用下生成 ,该副反应的化学方程式为
,该副反应的化学方程式为(4)若产生的氮氧化物尾气
 含
含 、
、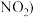 用氨气为还原剂进行催化还原,主要反应如下:
用氨气为还原剂进行催化还原,主要反应如下: ①
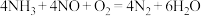 ②
②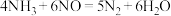
当反应温度过高时,
 会发生以下反应:
会发生以下反应: ③
 ④
④
随着反应温度升高,脱硝效率降低的原因可能是
(5)可用
 将氮氧化物转化成
将氮氧化物转化成 。向含
。向含 的溶液中加入
的溶液中加入 溶液调节至碱性,
溶液调节至碱性, 转化为去除氮氧化物效果更好的
转化为去除氮氧化物效果更好的 ,再通入
,再通入 气体进行反应。碱性条件下
气体进行反应。碱性条件下 去除
去除 反应的离子方程式为
反应的离子方程式为 (6)设计以某工业废水(含
 、
、 、
、 )为原料,制取
)为原料,制取 晶体的实验方案:
晶体的实验方案: 的溶解度曲线如图
的溶解度曲线如图 所示;实验中须使用的试剂:稀
所示;实验中须使用的试剂:稀 、
、 溶液
溶液 。
。
您最近一年使用:0次
9 . 二氧化氯 常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。
常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。
Ⅰ. 的制备:
的制备:
(1)工业上采用亚氯酸钠 溶液和盐酸混合制取
溶液和盐酸混合制取 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(2)用题图1所示装置进行电解(电极不反应),也可制得 。
。
_______ (填“减小”“增大”或“不变”)。
②阴极上产生 的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为_______ 。
Ⅱ. 的用途:
的用途:
(3) 可用于果蔬保鲜。
可用于果蔬保鲜。 使用时常用稳定剂来吸收、转化。不同稳定剂释放出
使用时常用稳定剂来吸收、转化。不同稳定剂释放出 浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是
浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是_______ (填“稳定剂Ⅰ”或“稳定剂Ⅱ”),原因是_______ 。 可用于去除水体中
可用于去除水体中 。某实验小组用弱碱性溶液模拟实际水体消毒过程中
。某实验小组用弱碱性溶液模拟实际水体消毒过程中 和
和 的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。
的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。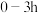 内,发生的主要反应的离子方程式为
内,发生的主要反应的离子方程式为_______ 。
②在 时,耗氯量增幅较大的可能原因是
时,耗氯量增幅较大的可能原因是_______ 。
 常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。
常温常压下为气体,是一种高效的消毒剂,也可用于某些污染物的处理。Ⅰ.
 的制备:
的制备:(1)工业上采用亚氯酸钠
 溶液和盐酸混合制取
溶液和盐酸混合制取 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)用题图1所示装置进行电解(电极不反应),也可制得
 。
。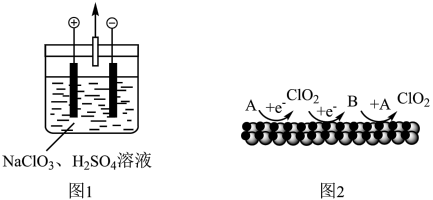

②阴极上产生
 的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
的机理如题图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为Ⅱ.
 的用途:
的用途:(3)
 可用于果蔬保鲜。
可用于果蔬保鲜。 使用时常用稳定剂来吸收、转化。不同稳定剂释放出
使用时常用稳定剂来吸收、转化。不同稳定剂释放出 浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是
浓度随时间变化趋势如题图3所示,其中效果较好的稳定剂是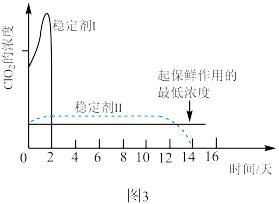
 可用于去除水体中
可用于去除水体中 。某实验小组用弱碱性溶液模拟实际水体消毒过程中
。某实验小组用弱碱性溶液模拟实际水体消毒过程中 和
和 的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。
的反应,实验结果发现溶液中有黑色浑浊产生,溶液中微粒浓度变化如题图4所示。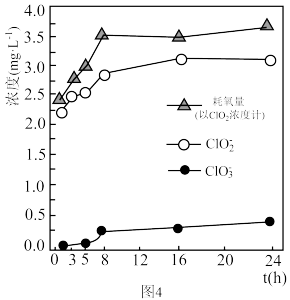
 内,发生的主要反应的离子方程式为
内,发生的主要反应的离子方程式为②在
 时,耗氯量增幅较大的可能原因是
时,耗氯量增幅较大的可能原因是
您最近一年使用:0次
名校
10 . 以黄铁矿(主要成分FeS2))为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。
(1)煅烧前,黄铁矿需要研磨,目的是___________ 。
(2)煅烧黄铁矿的化学方程式是___________ 。
(3)过程①中处理尾气SO2的离子反应方程式为___________ 。
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式___________ 。
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为___________ 。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为___________ 。(请写出计算过程)

(1)煅烧前,黄铁矿需要研磨,目的是
(2)煅烧黄铁矿的化学方程式是
(3)过程①中处理尾气SO2的离子反应方程式为
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
您最近一年使用:0次



