解题方法
1 . 三氧化二镍(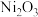 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取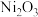 。工艺流程图如下所示:
。工艺流程图如下所示:

已知:i.草酸的钙、镁、镍盐以及 、
、 均难溶于水。
均难溶于水。
ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的 (20℃)如下表:
(20℃)如下表:
请回答下列问题:
(1) 中
中 的化合价为
的化合价为______ ;进行操作b时的温度为______ 。
(2) 、
、 ,
,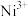 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为______ 。滤渣B中的主要物质是______ 。
(3)滤液B加入 的离子方程式为
的离子方程式为______ 。
(4)草酸镍( )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得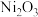 ,同时获得混合气体。
,同时获得混合气体。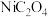 热分解的化学方程式为
热分解的化学方程式为______ 。
(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t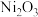 (假设不含杂质),则产率为
(假设不含杂质),则产率为______ (保留3位有效数字)。
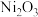 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取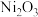 。工艺流程图如下所示:
。工艺流程图如下所示:
已知:i.草酸的钙、镁、镍盐以及
 、
、 均难溶于水。
均难溶于水。ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的
 (20℃)如下表:
(20℃)如下表:金属离子 |
|
|
|
|
|
开始沉淀时( | 7.7 | 7.5 | 2.2 | 12.3 | 9.6 |
完全时( | 9.2 | 9.0 | 3.2 | 微溶 | 11.1 |
(1)
 中
中 的化合价为
的化合价为(2)
 、
、 ,
,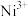 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为(3)滤液B加入
 的离子方程式为
的离子方程式为(4)草酸镍(
 )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得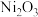 ,同时获得混合气体。
,同时获得混合气体。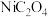 热分解的化学方程式为
热分解的化学方程式为(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t
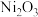 (假设不含杂质),则产率为
(假设不含杂质),则产率为
您最近半年使用:0次
名校
2 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
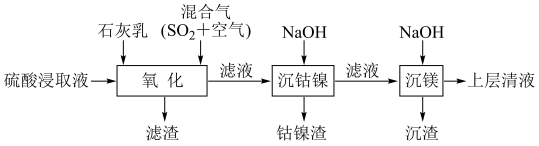
回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为___________ 。(答出一条即可)
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ 。(H2SO5的电离第一步完全,第二步微弱)
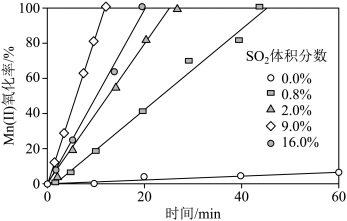
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)将“钴镍渣”酸溶后,进行如下流程:
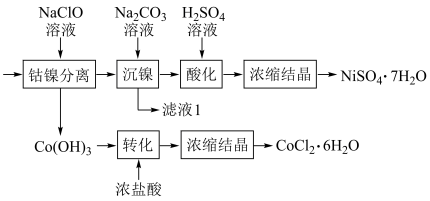
①写出“钴镍分离”时发生反应的离子方程式:___________ 。
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___________ (要求写出计算过程)。[已知:Ksp(NiCO3)=1.0×10-7,沉镍率= ]
]

回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是

(5)将“钴镍渣”酸溶后,进行如下流程:

①写出“钴镍分离”时发生反应的离子方程式:
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率= ]
]
您最近半年使用:0次
名校
解题方法
3 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
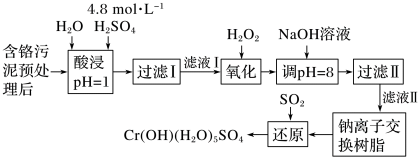
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 、_______ 。(答出两点)
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为_______ 。
(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:_______ 。

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:
您最近半年使用:0次
解题方法
4 . CoC2O4是制备氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、CaO、MgO碳及有机物等)制取CoC2O4的工艺流程如下:
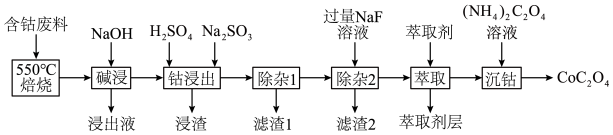
(1)为了加快“碱浸”速率,可采用的方法有________ (写一种即可)。“浸出液”的主要成分是_______ (填化学式)。
(2)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________ 。
(3)“除杂1”过程中,在40~50℃加入H2O2,写出加入H2O2反应的主要离子方程式为_______________ 。
(4)“除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则滤液中c(Mg2+)为______ [已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(5)萃取剂对金属离子的萃取率与pH的关系如图所示,经过萃取可除去Mn2+,需控制溶液的pH范围是__________ (填字母)。
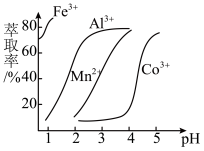
A.1.0~2.0 B.2.0~3.0 C.3.0~3.5

(1)为了加快“碱浸”速率,可采用的方法有
(2)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
(3)“除杂1”过程中,在40~50℃加入H2O2,写出加入H2O2反应的主要离子方程式为
(4)“除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则滤液中c(Mg2+)为
(5)萃取剂对金属离子的萃取率与pH的关系如图所示,经过萃取可除去Mn2+,需控制溶液的pH范围是

A.1.0~2.0 B.2.0~3.0 C.3.0~3.5
您最近半年使用:0次
名校
5 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为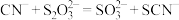 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
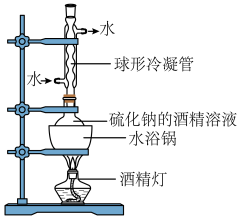
图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是___________ 。
(3)利用图2装置制备 。
。
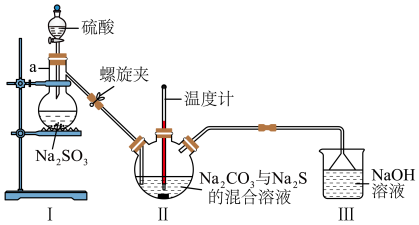
图2
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置 Ⅲ 的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用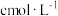 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为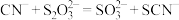 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是
(3)利用图2装置制备
 。
。
图2
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置 Ⅲ 的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用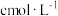 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近半年使用:0次
2024-02-13更新
|
94次组卷
|
2卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
名校
解题方法
6 .  在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(1)在 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备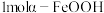 理论上需要
理论上需要 的物质的量为
的物质的量为___________  ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(2) 的结构中,每个
的结构中,每个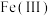 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构___________ 。 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。___________ 。
②工业可使用四氯乙烯 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是___________ 。
③部分环状分子(如苯)中由于存在大 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是___________ 。
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(1)在
 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备
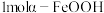 理论上需要
理论上需要 的物质的量为
的物质的量为 ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(2)
 的结构中,每个
的结构中,每个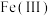 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构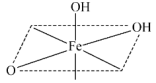
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。
②工业可使用四氯乙烯
 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是③部分环状分子(如苯)中由于存在大
 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是
您最近半年使用:0次
2024-02-13更新
|
618次组卷
|
4卷引用:江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题
名校
7 . 某研究小组利用如图所示装置制备氯气,并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)
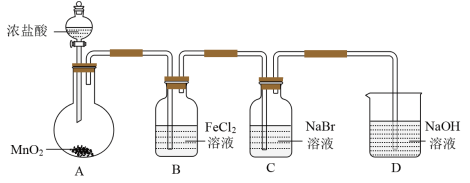
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为_______ 。
(2)B中发生反应的离子方程式为_______ 。
(3)D中发生反应的化学方程式为_______ 。
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:______
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(5)实验1中a试管中反应的离子方程式是_______ 。
(6)通过实验1可以得出的结论是_______ 。
(7)①甲同学认为:实验2观察到_______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是_______ 。
Ⅰ.制备Cl2并进行性质实验(夹持装置和加热仪器略)

(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的方程式为
(2)B中发生反应的离子方程式为
(3)D中发生反应的化学方程式为
(4)常温下KClO3和浓盐酸反应也可以制备氯气,配平化学方程式:
_______KClO3+_______HCl(浓)=_______KCl+_______Cl2↑+_______H2O
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 | 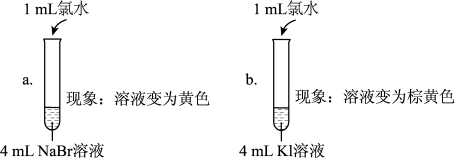 |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验1中a试管中反应的离子方程式是
(6)通过实验1可以得出的结论是
(7)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近半年使用:0次
名校
8 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
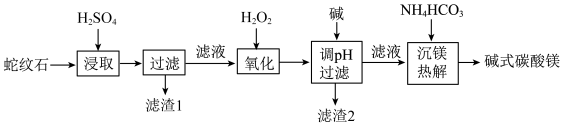
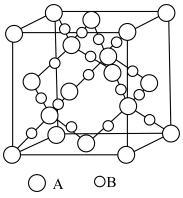
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
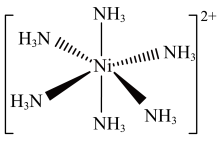
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近半年使用:0次
2024-02-11更新
|
221次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高三上学期高考适应性月考卷(六)理科综合试卷
名校
解题方法
9 . 锰酸锂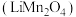 可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为
可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为 ,含少量
,含少量 等杂质)吸收含硫烟气(主要成分
等杂质)吸收含硫烟气(主要成分 )制备
)制备 ,生产流程如下:
,生产流程如下:
②在此流程中部分金属阳离子生成氢氧化物沉淀的 如下表:
如下表:
回答下列问题:
(1)滤渣1为________ (填化学式); 被
被 还原为
还原为 的离子方程式为
的离子方程式为_________ 。
(2)由“滤液1”得到“滤液2”同时回收 的实验方案为[
的实验方案为[ 在
在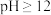 时溶解]:边搅拌边向滤液1中滴加足量
时溶解]:边搅拌边向滤液1中滴加足量___________ ;搅拌,加入 溶液至
溶液至___________ ,过滤得滤液2和固体;向所得固体中加入___________ 溶液至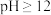 ,搅拌、过滤,再向所得滤液中通入
,搅拌、过滤,再向所得滤液中通入___________ ,___________ 、___________ 、低温烘干得 (实验中须用到的试剂有:
(实验中须用到的试剂有: 溶液、
溶液、 溶液、
溶液、 )。
)。
(3)已知室温下, ,当
,当 时,要使
时,要使 形成沉淀,
形成沉淀,
___________ 。
(4)在实际生产中, 与
与 按物质的量之比
按物质的量之比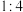 混合后,均匀加热制取
混合后,均匀加热制取 ,反应过程如下:
,反应过程如下:
①升温到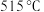 时,
时, 开始分解产生
开始分解产生 ,同时生成固体
,同时生成固体 ,此时比预计
,此时比预计 的分解温度
的分解温度 低得多,原因可能是
低得多,原因可能是___________ 。
②升温到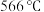 时,
时, 开始分解产生另一种气体
开始分解产生另一种气体 ,完全反应后,
,完全反应后, 恰好与①中产生的
恰好与①中产生的 的物质的量相等,同时得到固体
的物质的量相等,同时得到固体 。则固体
。则固体 的化学式为
的化学式为___________ 。
③升温到 时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的
时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的 。写出该阶段反应的化学方程式:
。写出该阶段反应的化学方程式:___________ 。
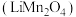 可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为
可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为 ,含少量
,含少量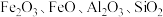 等杂质)吸收含硫烟气(主要成分
等杂质)吸收含硫烟气(主要成分 )制备
)制备 ,生产流程如下:
,生产流程如下: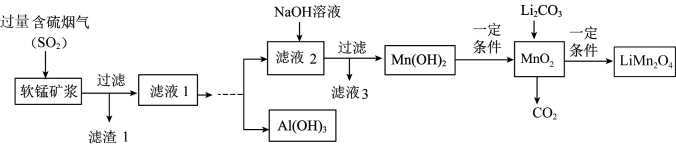
②在此流程中部分金属阳离子生成氢氧化物沉淀的
 如下表:
如下表:| 沉淀物 |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)滤渣1为
 被
被 还原为
还原为 的离子方程式为
的离子方程式为(2)由“滤液1”得到“滤液2”同时回收
 的实验方案为[
的实验方案为[ 在
在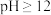 时溶解]:边搅拌边向滤液1中滴加足量
时溶解]:边搅拌边向滤液1中滴加足量 溶液至
溶液至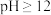 ,搅拌、过滤,再向所得滤液中通入
,搅拌、过滤,再向所得滤液中通入 (实验中须用到的试剂有:
(实验中须用到的试剂有: 溶液、
溶液、 溶液、
溶液、 )。
)。(3)已知室温下,
 ,当
,当 时,要使
时,要使 形成沉淀,
形成沉淀,
(4)在实际生产中,
 与
与 按物质的量之比
按物质的量之比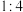 混合后,均匀加热制取
混合后,均匀加热制取 ,反应过程如下:
,反应过程如下:①升温到
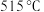 时,
时, 开始分解产生
开始分解产生 ,同时生成固体
,同时生成固体 ,此时比预计
,此时比预计 的分解温度
的分解温度 低得多,原因可能是
低得多,原因可能是②升温到
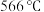 时,
时, 开始分解产生另一种气体
开始分解产生另一种气体 ,完全反应后,
,完全反应后, 恰好与①中产生的
恰好与①中产生的 的物质的量相等,同时得到固体
的物质的量相等,同时得到固体 。则固体
。则固体 的化学式为
的化学式为③升温到
 时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的
时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的 。写出该阶段反应的化学方程式:
。写出该阶段反应的化学方程式:
您最近半年使用:0次
2024-02-10更新
|
220次组卷
|
3卷引用:安徽师范大学附属中学2024届高三1月月考化学试卷
安徽师范大学附属中学2024届高三1月月考化学试卷(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)甘肃省2023-2024学年高三普通高中学业水平选择性考试仿真模拟卷(二)化学试卷
名校
10 . 碳酸锰( )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程: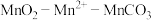
已知: 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。
请回答下列问题:
(1)仪器A的名称为________ 。
(2)在烧瓶中加入一定量的 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式________ ,反应过程中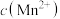 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时,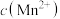 迅速增大的原因是
迅速增大的原因是________ 。
(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为________ 。
(4)实验结束后,将装置A中的混合物过滤,用________ 洗涤滤渣,再低温烘干,即得到干燥的 固体。
固体。
(5)已知 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:________ 。
(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量________ (写出表达式)
 )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程: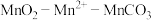
已知:
 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。请回答下列问题:

(1)仪器A的名称为
(2)在烧瓶中加入一定量的
 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式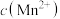 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时,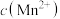 迅速增大的原因是
迅速增大的原因是(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的
 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为(4)实验结束后,将装置A中的混合物过滤,用
 固体。
固体。(5)已知
 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量
您最近半年使用:0次




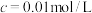 )的
)的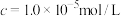 )的
)的

