解题方法
1 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□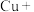 □
□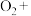 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应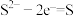 ,
,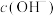 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
| 向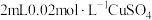 溶液中加入 溶液中加入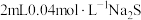 溶液 溶液 | 产生黑色固体 |
| 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为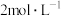 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
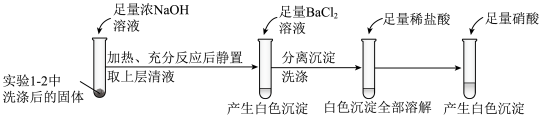
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
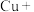 □
□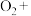 □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
序号 | 实验方案 | 实验现象 | |
3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
3-2 | a: 溶液 溶液b: 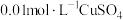 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 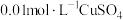 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 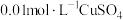 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
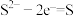 ,
,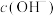 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近半年使用:0次
名校
2 .  可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿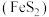 为原料制备
为原料制备 其流程如图。
其流程如图。
回答下列问题:
(1) 的价层电子排布图
的价层电子排布图_______ ,“酸浸”过程中,滤渣1的主要成分为S、_______ (填化学式)。
(2)“酸浸”过程中 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。_______ 。
②80~100min时, 浓度上升的原因可能是
浓度上升的原因可能是_______ 。
(3)“沉铁”过程中依次加入的试剂X、Y为_______ (填字母)。
A.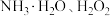 B.
B. C.
C.
(4)“滤液”萃取前调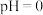 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,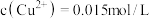 多次萃取后水相中
多次萃取后水相中 为
为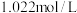 ,则铜的萃取率为
,则铜的萃取率为_______ (结果保留小数点后一位,溶液体积变化忽略不计)。
(5)利用 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:_______ 。
(6)结合图像分析,若要获得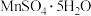 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热_______ 得到_______ ℃饱和溶液,_______ ,过滤酒精洗涤,低温干燥。
 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿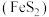 为原料制备
为原料制备 其流程如图。
其流程如图。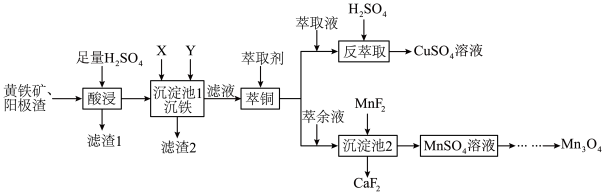
 |  |  |  | |
| 完全沉淀时的pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)
 的价层电子排布图
的价层电子排布图(2)“酸浸”过程中
 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。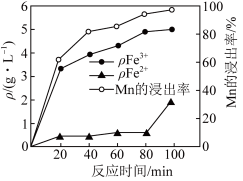
②80~100min时,
 浓度上升的原因可能是
浓度上升的原因可能是(3)“沉铁”过程中依次加入的试剂X、Y为
A.
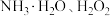 B.
B. C.
C.
(4)“滤液”萃取前调
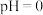 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,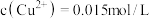 多次萃取后水相中
多次萃取后水相中 为
为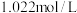 ,则铜的萃取率为
,则铜的萃取率为(5)利用
 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:(6)结合图像分析,若要获得
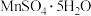 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热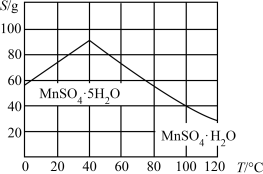
您最近半年使用:0次
3 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验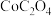 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧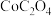 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下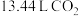 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: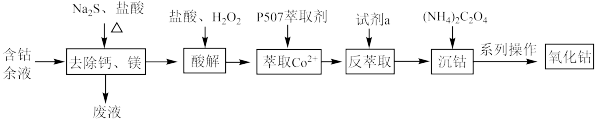
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
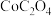 是否洗涤干净
是否洗涤干净(7)空气中煅烧
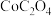 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下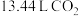 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近半年使用:0次
解题方法
4 . 二氧化硫脲[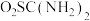 ](
](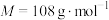 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
](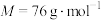 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:
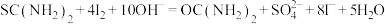
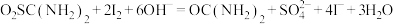

②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:
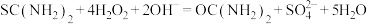


该产品中二氧化硫脲的质量分数为____________ 。
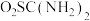 ](
](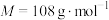 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下: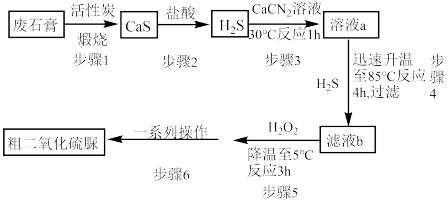

①滤液b主要成份为硫脲[
 ](
](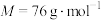 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
 ]。
]。请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
A.装置B中装的X溶液为饱和 溶液 溶液 |
B.装置E中的 与 与 发生氧化还原反应,起到尾气处理的作用 发生氧化还原反应,起到尾气处理的作用 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。涉及到的反应有:
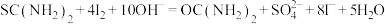
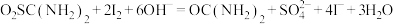

②另取0.1000g产品,加入50.00mL 0.1000
 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。涉及到的反应有:
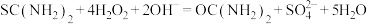


该产品中二氧化硫脲的质量分数为
您最近半年使用:0次
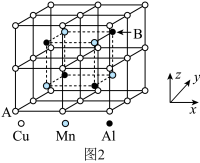
5 . 金属钨是重要的战略资源,由黑钨矿(主要成分为 、
、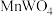 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
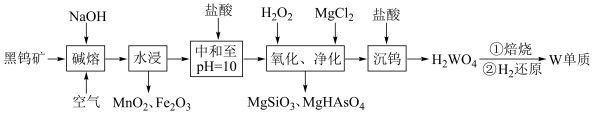
已知:常温下钨酸(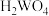 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。
回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第________ 族。 中铁元素的化合价为
中铁元素的化合价为________ 。
(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先________ ,“碱熔”过程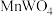 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有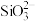 、
、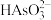 、
、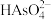 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)沉钨过程中,判断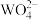 是否沉淀完全的方法是
是否沉淀完全的方法是________ 。
(5)钨酸钙( )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下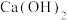 和
和 的饱和溶液中,
的饱和溶液中,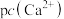 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将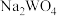 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=________ 。
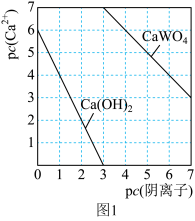
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为________ 。若A原子的坐标参数为(0,0,0),则B原子的坐标参数为________ 。
 、
、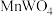 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
已知:常温下钨酸(
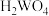 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第
 中铁元素的化合价为
中铁元素的化合价为(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先
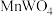 发生反应的化学方程式为
发生反应的化学方程式为(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有
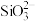 、
、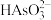 、
、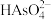 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为(4)沉钨过程中,判断
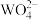 是否沉淀完全的方法是
是否沉淀完全的方法是(5)钨酸钙(
 )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下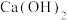 和
和 的饱和溶液中,
的饱和溶液中,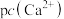 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将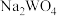 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为

您最近半年使用:0次
6 . 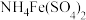 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
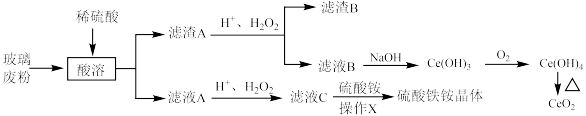
回答下列问题:
(1)“酸溶”中,若使用 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是___________ 。
(2)该生产使用 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是___________ 。
(3)滤渣A转化为滤液B的离子方程式为___________ 。
(4)某同学检验滤液C中是否含有 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论___________ (填“正确”或“错误”),用离子方程式说明:___________ 。
(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有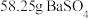 ,每次用
,每次用 的
的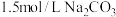 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少___________ 次(假设清洗过程中 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;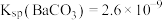 )
)
(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作 为
为___________ 。浓度均为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,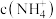 由大到小的顺序为
由大到小的顺序为___________ 。
(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知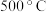 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率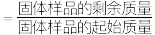
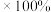 。
。
写出 的化学方程式:
的化学方程式:___________ 。
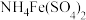 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)“酸溶”中,若使用
 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是(2)该生产使用
 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是(3)滤渣A转化为滤液B的离子方程式为
(4)某同学检验滤液C中是否含有
 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有
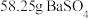 ,每次用
,每次用 的
的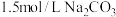 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;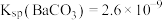 )
)(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作
 为
为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,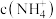 由大到小的顺序为
由大到小的顺序为(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知
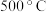 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率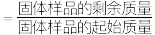
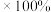 。
。
写出
 的化学方程式:
的化学方程式:
您最近半年使用:0次
7 . 连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。
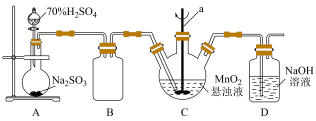
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是_______ 。实验时需要向C中通入稍过量的SO2,目的是________ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为_______ ,判断反应完成的现象是_______ ,待反应结束后经除杂、减压蒸发浓缩、结晶可得产品MnS2O6•nH2O。
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为_______ ;若滴定消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为_______ 。
(5)下列操作会使得测定结果偏大的是_______ 。
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)仪器a的名称为
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为
(5)下列操作会使得测定结果偏大的是
| A.滴定前锥形瓶用蒸馏水洗后未用待测MnSO4溶液润洗 |
| B.滴定前平视读数,滴定结束俯视读数 |
| C.滴定前滴定管中尖嘴处有气泡,滴定后气泡消失 |
| D.对连二硫酸锰产品进行加热操作时加热不充分 |
您最近半年使用:0次
8 . 重铬酸钠(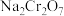 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有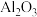 、
、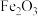 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:

已知: ,
,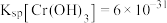
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是________ (填标号)
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式________ 。
(3)为提高铬的“浸出”率,可采取的措施为________ ;浸出液中溶质除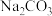 、
、 外,还含有
外,还含有________ (填化学式)。
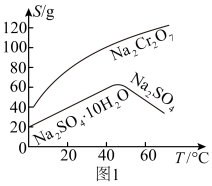
(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是 ,则“操作a”为
,则“操作a”为________ 、________ 、洗涤、干燥。
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
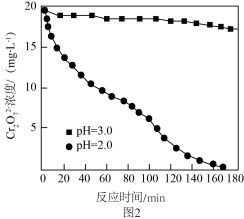
①初始pH为2.0,用铝粉还原 的离子方程式为
的离子方程式为________ 。
②初始pH为3.0,反应180min后,溶液中 浓度仍较高的可能原因是
浓度仍较高的可能原因是________ 。
③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中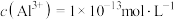 ,则残留的
,则残留的
________  。
。
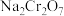 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有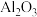 、
、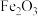 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知:
 ,
,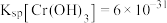
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将
 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式(3)为提高铬的“浸出”率,可采取的措施为
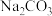 、
、 外,还含有
外,还含有(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是
 ,则“操作a”为
,则“操作a”为
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有
 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原
 的离子方程式为
的离子方程式为②初始pH为3.0,反应180min后,溶液中
 浓度仍较高的可能原因是
浓度仍较高的可能原因是③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中
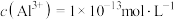 ,则残留的
,则残留的
 。
。
您最近半年使用:0次
解题方法
9 . 三氯化锑 用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为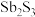 ,还含有
,还含有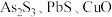 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
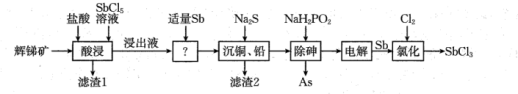
已知:①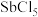 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 和
和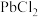 等杂质;
等杂质;
②常温下,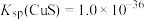 、
、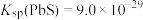 ;
;
③溶液中离子浓度小于或等于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有_____ (填两条)。
(2)“滤渣1”的主要成分有_____ (填化学式);若在实验室模拟分离“滤渣1”和“浸出液”,需要使用到的硅酸盐仪器有_____ 。
(3)“浸出液”中加入适量 的目的是
的目的是_____ (填化学方程式)。
(4)当 共沉淀时,溶液中
共沉淀时,溶液中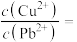
_____ (保留两位有效数字)。
(5)“除砷”时,氧化产物为 ,则
,则 (可溶于水)与
(可溶于水)与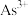 反应的离子方程式为
反应的离子方程式为_____ 。
(6)已知:“电解” 溶液时有
溶液时有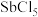 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有_____ 。
 用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为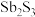 ,还含有
,还含有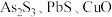 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
已知:①
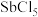 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 和
和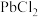 等杂质;
等杂质;②常温下,
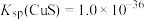 、
、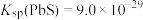 ;
;③溶液中离子浓度小于或等于
 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有
(2)“滤渣1”的主要成分有
(3)“浸出液”中加入适量
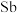 的目的是
的目的是(4)当
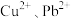 共沉淀时,溶液中
共沉淀时,溶液中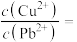
(5)“除砷”时,氧化产物为
 ,则
,则 (可溶于水)与
(可溶于水)与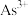 反应的离子方程式为
反应的离子方程式为(6)已知:“电解”
 溶液时有
溶液时有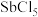 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有
您最近半年使用:0次
10 . 五氧化二钒( )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
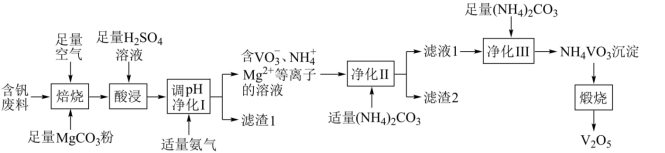
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②25℃时,难溶电解质的溶度积常数如表所示:
请回答下列问题:
(1)写出基态V原子的价层电子排布式:___________ 。
(2)“焙烧”的目的之一是将 转化成
转化成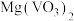 ,请写出转化的化学方程式:
,请写出转化的化学方程式:___________ 。
(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是___________ (写一条即可)。
(4)25℃,“调pH净化Ⅰ”时需将 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度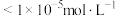 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为___________ 。
(5)“净化Ⅱ”的目的是除 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是___________ 。
(6)“滤液1”中加入 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:___________ 。
(7)煅烧 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是___________ 。
(8)为测定该产品的纯度,某同学准确称取 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成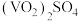 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为___________ 。(计算结果保留两位小数)
 )为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为
)为橙黄色晶性粉末,在冶金、化工、催化等领域有重要应用,也是制备其他钒化合物的重要原料。实验室以含钒废料(主要成分为 ,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备
,还含有Fe、Cu、Mn、Si、AI等元素的氧化物以及有机物)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 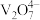 |
| 难溶电解质 |  | 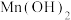 |  |  |  |  |
 | 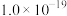 | 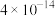 |  |  | 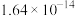 |  |
(1)写出基态V原子的价层电子排布式:
(2)“焙烧”的目的之一是将
 转化成
转化成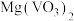 ,请写出转化的化学方程式:
,请写出转化的化学方程式:(3)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(4)25℃,“调pH净化Ⅰ”时需将
 、
、 、
、 三种离子去除干净(浓度
三种离子去除干净(浓度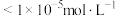 时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为
时视为去除干净)外,还需要考虑V的存在形式,则需调节pH范围为(5)“净化Ⅱ”的目的是除
 、
、 ,若该过程加入过量
,若该过程加入过量 ,可能导致的结果是
,可能导致的结果是(6)“滤液1”中加入
 的目的是将
的目的是将 变成沉淀偏钒酸铵(
变成沉淀偏钒酸铵( ),简称“沉钒”。“沉钒”得到的
),简称“沉钒”。“沉钒”得到的 需进行洗涤、干燥,请写出证明
需进行洗涤、干燥,请写出证明 已洗净的实验操作及现象:
已洗净的实验操作及现象:(7)煅烧
 得到的产物中,可以在该流程中循环利用的物质是
得到的产物中,可以在该流程中循环利用的物质是(8)为测定该产品的纯度,某同学准确称取
 产品1.000g,加入过量稀硫酸使其完全转化成
产品1.000g,加入过量稀硫酸使其完全转化成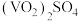 ,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的
,并配成100mL溶液(此溶液pH=1)。取10.00mL溶液用0.1000mol/L的 标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中
标准溶液滴定,滴定到终点时消耗标准液5mL。已知滴定过程中 被氧化为
被氧化为 ,该产品的纯度为
,该产品的纯度为
您最近半年使用:0次






