1 . 金属钨是重要的战略资源,由黑钨矿(主要成分为 、
、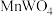 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
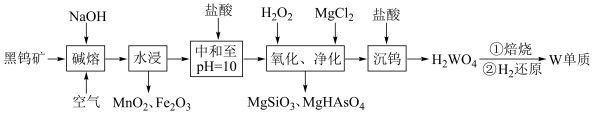
已知:常温下钨酸(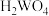 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。
回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第________ 族。 中铁元素的化合价为
中铁元素的化合价为________ 。
(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先________ ,“碱熔”过程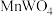 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有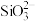 、
、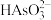 、
、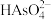 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)沉钨过程中,判断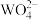 是否沉淀完全的方法是
是否沉淀完全的方法是________ 。
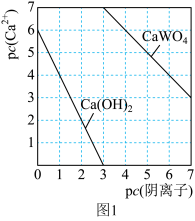
(5)钨酸钙( )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下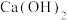 和
和 的饱和溶液中,
的饱和溶液中,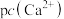 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将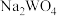 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=________ 。
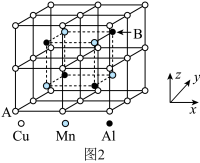
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为________ 。若A原子的坐标参数为(0,0,0),则B原子的坐标参数为________ 。
 、
、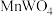 ,含有少量Si、As的化合物)制取金属钨的流程如图所示:
,含有少量Si、As的化合物)制取金属钨的流程如图所示:
已知:常温下钨酸(
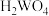 )难溶于水,酸性很弱,其钠盐易溶于水。
)难溶于水,酸性很弱,其钠盐易溶于水。回答下列问题:
(1)已知元素周期表中74号元素钨与铬同族,钨在元素周期表中的位置是第六周期第
 中铁元素的化合价为
中铁元素的化合价为(2)“碱熔”步骤中为提高反应速率,可以将黑钨矿预先
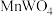 发生反应的化学方程式为
发生反应的化学方程式为(3)上述流程中加盐酸中和至pH=10时,溶液中的杂质阴离子有
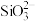 、
、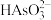 、
、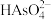 等,则“氧化、净化”过程中,先加入
等,则“氧化、净化”过程中,先加入 发生反应的离子方程式为
发生反应的离子方程式为(4)沉钨过程中,判断
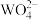 是否沉淀完全的方法是
是否沉淀完全的方法是(5)钨酸钙(
 )和氢氧化钙都是微溶电解质。某温度下
)和氢氧化钙都是微溶电解质。某温度下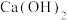 和
和 的饱和溶液中,
的饱和溶液中,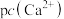 与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将
与pc(阴离子)的关系如图1所示,已知:pc(离子)=-lgc(离子)。该温度下将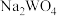 溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
溶液加入石灰乳中得到大量钨酸钙,该反应的平衡常数K=
(6)合金具有比金属单质更优越的性能,Cu-Mn-Al合金为磁性形状记忆合金材料之一,其晶胞结构如图2所示。该合金的化学式为

您最近一年使用:0次
2 . 连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。
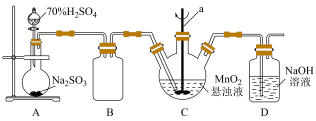
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是_______ 。实验时需要向C中通入稍过量的SO2,目的是________ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为_______ ,判断反应完成的现象是_______ ,待反应结束后经除杂、减压蒸发浓缩、结晶可得产品MnS2O6•nH2O。
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为_______ ;若滴定消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为_______ 。
(5)下列操作会使得测定结果偏大的是_______ 。
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)仪器a的名称为
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为
(5)下列操作会使得测定结果偏大的是
| A.滴定前锥形瓶用蒸馏水洗后未用待测MnSO4溶液润洗 |
| B.滴定前平视读数,滴定结束俯视读数 |
| C.滴定前滴定管中尖嘴处有气泡,滴定后气泡消失 |
| D.对连二硫酸锰产品进行加热操作时加热不充分 |
您最近一年使用:0次
名校
3 . 镓的化合物
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式_____ 。
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态_____ ,画出C和D的结构_____ 。
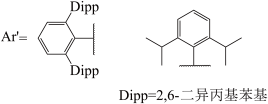
(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式_____ 。
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态

(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式
您最近一年使用:0次
2023-09-07更新
|
296次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高三下学期开学化学试题
名校
解题方法
4 . 回收利用含硫化合物有利于节约资源、保护环境。
(1)一种由含 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(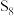 )。该工艺中涉及反应为:
)。该工艺中涉及反应为:
反应1:

反应2: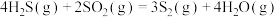
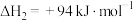
反应3:
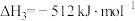
①反应 的△H=
的△H=_______ 。
②如果上述反应均能完全进行,为提高硫磺的产率,该工艺中需要控制的是_______ 。
(2)一种以 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下:写出转化中由
的物质转化关系如下:写出转化中由 制
制 的化学反应方程式:
的化学反应方程式:_______ 。
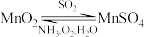
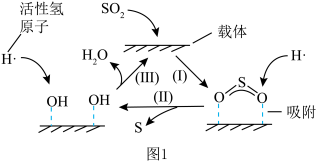
(3)一种以 为催化剂载体、
为催化剂载体、 为催化剂的
为催化剂的 还原烟气中
还原烟气中 制S的反应机理如图1和如图2所示:
制S的反应机理如图1和如图2所示:
①如图1中所示转化可以描述为_______ 。
②如图2中X的电子式为_______ 。
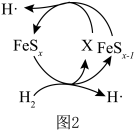
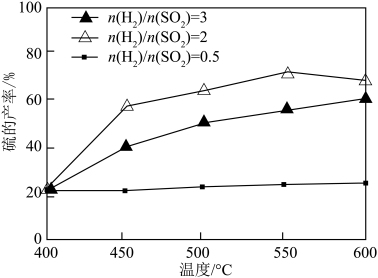
③其他条件一定,改变起始时 与
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如图所示。500℃时,
比值的关系如图所示。500℃时,  比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是_______ 。
(1)一种由含
 的烟气回收硫磺的工艺为:将一部分含
的烟气回收硫磺的工艺为:将一部分含 的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(
的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫磺(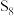 )。该工艺中涉及反应为:
)。该工艺中涉及反应为:反应1:


反应2:
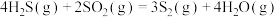
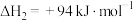
反应3:

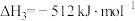
①反应
 的△H=
的△H=②如果上述反应均能完全进行,为提高硫磺的产率,该工艺中需要控制的是
(2)一种以
 为原料,循环吸收烟气中
为原料,循环吸收烟气中 的物质转化关系如下:写出转化中由
的物质转化关系如下:写出转化中由 制
制 的化学反应方程式:
的化学反应方程式: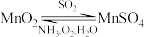
(3)一种以
 为催化剂载体、
为催化剂载体、 为催化剂的
为催化剂的 还原烟气中
还原烟气中 制S的反应机理如图1和如图2所示:
制S的反应机理如图1和如图2所示:①如图1中所示转化可以描述为

②如图2中X的电子式为

③其他条件一定,改变起始时
 与
与 的比例,反应相同时间,测得S的产率与温度和
的比例,反应相同时间,测得S的产率与温度和 比值的关系如图所示。500℃时,
比值的关系如图所示。500℃时,  比值为3时硫的产率小于比值为2时的原因是
比值为3时硫的产率小于比值为2时的原因是
您最近一年使用:0次
2023-04-16更新
|
523次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三下学期2月月考化学试题
名校
解题方法
5 . 某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答:
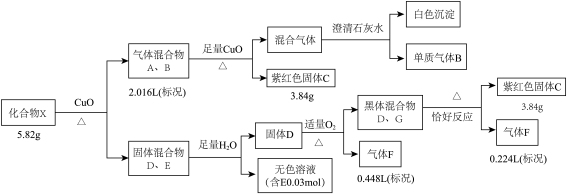
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)气体B的电子式是___________ ,C的化学式是___________ 。
(2)写出固体混合物D、G共热所发生的化学反应方程式___________ 。
(3)无色溶液E中滴加盐酸观察到气泡。收集少量气体通入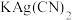 溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)
溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)___________ 。
(4)将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子___________ 。

已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)气体B的电子式是
(2)写出固体混合物D、G共热所发生的化学反应方程式
(3)无色溶液E中滴加盐酸观察到气泡。收集少量气体通入
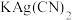 溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)
溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)(4)将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子
您最近一年使用:0次
2023-04-14更新
|
787次组卷
|
3卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三下学期2月月考化学试题
名校
6 . 液态化合物 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
实验1: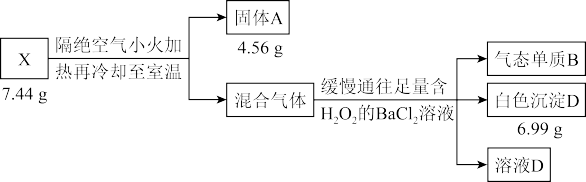
实验2: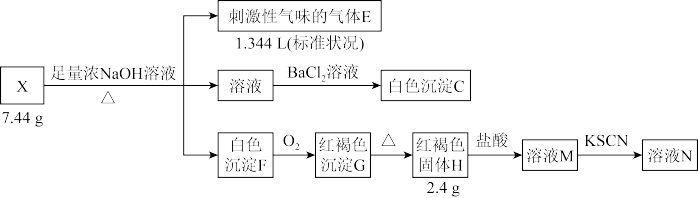
已知:物质 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答:
(1)组成 的元素有
的元素有_______ , 的化学式为
的化学式为_______ 。
(2) 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为_______ 。
(3)溶液 中的溶质有:
中的溶质有: 、
、 、
、_______ (填化学式)。
(4)溶液 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
①向溶液 中加
中加 固体,观察现象;
固体,观察现象;
②向溶液 中加浓
中加浓 溶液,观察现象;
溶液,观察现象;
请设计方案③:_______ (写出操作、现象及相应结论)。
 是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:
是电镀行业的重要试剂,由中学阶段常见的5种元素组成。某小组按如下流程进行实验:实验1:

实验2:

已知:物质
 与
与 溶液的反应属于非氧化还原反应。请回答:
溶液的反应属于非氧化还原反应。请回答:(1)组成
 的元素有
的元素有 的化学式为
的化学式为(2)
 与浓
与浓 溶液共热的化学方程式为
溶液共热的化学方程式为(3)溶液
 中的溶质有:
中的溶质有: 、
、 、
、(4)溶液
 中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:
中存在动态平衡,某同学欲探究物质浓度对该平衡的影响,已有方案:①向溶液
 中加
中加 固体,观察现象;
固体,观察现象;②向溶液
 中加浓
中加浓 溶液,观察现象;
溶液,观察现象;请设计方案③:
您最近一年使用:0次
2022-03-21更新
|
1324次组卷
|
7卷引用:新疆乌鲁木齐市第六十八中学2023-2024学年高三下学期2月月考化学试题
新疆乌鲁木齐市第六十八中学2023-2024学年高三下学期2月月考化学试题浙江省金丽衢十二校,七彩联盟2021-2022学年高三下学期3月阶段性联考化学试题 (已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点02 常见无机物转化及应用-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)化学-2022年高考押题预测卷03(浙江卷)(已下线)化学-2022年高考考前押题密卷(浙江卷)浙江省2022届高三考前第三次模拟考试化学试题
名校
7 . 钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
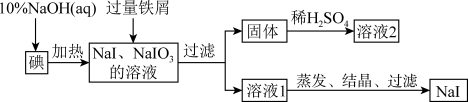
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
2016-12-09更新
|
915次组卷
|
6卷引用:新疆乌鲁木齐市第十二中学2023-2024学年高三下学期2月月考化学试题
解题方法
8 . 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g) SO2C12(g)
SO2C12(g)  H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
(1)化合物SO2Cl2中S元素的化合价是_________ 。
(2)用二氧化锰和浓盐酸制氯气的化学方程式为______________ 。
(3)用如图所示的装置制备SO2Cl2,下列说法正确的是_______ (选填编号)

a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.装置C处吸滤瓶应放在冰水中冷却,更有利于SO2Cl的收集
(4)B处反应管冷却水应从______ (填“m”或“n”)接口通入,
从化学平衡移动角度分析,反应管通水冷却的目的是________________ ,D处U形管中盛放的试剂可以是__________________ 。
(5)向C中所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子只有 、
、 (
( 除外),写出SO2Cl2与H2O反应的化学方程式
除外),写出SO2Cl2与H2O反应的化学方程式___________________________________ 。
(6)已知室温下,Ksp[AgCl]=2.0×10-10,Ksp[Ag2SO4]=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,使 和
和 完全沉淀。当浊液中Ag+浓度为0.1 mol/L时,此浊液中
完全沉淀。当浊液中Ag+浓度为0.1 mol/L时,此浊液中 与
与 的物质的量浓度之比为
的物质的量浓度之比为________________ 。
 SO2C12(g)
SO2C12(g)  H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。
H<0,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。(1)化合物SO2Cl2中S元素的化合价是
(2)用二氧化锰和浓盐酸制氯气的化学方程式为
(3)用如图所示的装置制备SO2Cl2,下列说法正确的是

a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.装置C处吸滤瓶应放在冰水中冷却,更有利于SO2Cl的收集
(4)B处反应管冷却水应从
从化学平衡移动角度分析,反应管通水冷却的目的是
(5)向C中所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子只有
 、
、 (
( 除外),写出SO2Cl2与H2O反应的化学方程式
除外),写出SO2Cl2与H2O反应的化学方程式(6)已知室温下,Ksp[AgCl]=2.0×10-10,Ksp[Ag2SO4]=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,使
 和
和 完全沉淀。当浊液中Ag+浓度为0.1 mol/L时,此浊液中
完全沉淀。当浊液中Ag+浓度为0.1 mol/L时,此浊液中 与
与 的物质的量浓度之比为
的物质的量浓度之比为
您最近一年使用:0次



