解题方法
1 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
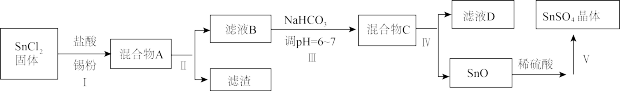
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
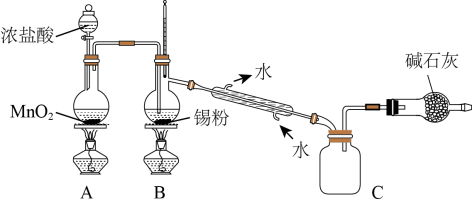
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
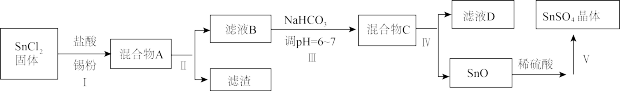
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
255次组卷
|
4卷引用:2015届天津市河西区高三下学期总复习质量调查(二)化学试卷



