解题方法
1 . 碳酸锰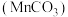 是制造电信器材软磁铁氧体的重要原料。工业上用硫锰矿(主要成分为
是制造电信器材软磁铁氧体的重要原料。工业上用硫锰矿(主要成分为 ,还含少量
,还含少量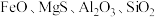 等)制备高纯
等)制备高纯 的流程如下:
的流程如下: 如下表:
如下表:
②室温下, 。回答下列问题:
。回答下列问题:
(1)为了提高硫锰矿在空气中“煅烧”的反应速率,可采取的措施是___________ (任写一种),“尾气”中含有由“煅烧”生成的有害气体的化学式为___________ 。
(2)加入 主要是氧化酸性溶液中的
主要是氧化酸性溶液中的 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(3)加入氨水调节溶液 为5.0,则溶液中
为5.0,则溶液中
___________ (填“>”“<”或“=”)c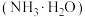 ;溶液中能够完全沉淀的金属离子为
;溶液中能够完全沉淀的金属离子为___________ (填离子符号,金属离子浓度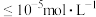 时,视为沉淀完全)。
时,视为沉淀完全)。
(4)室温下“沉镁”时,离子反应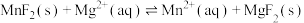 的化学平衡常数
的化学平衡常数
___________ 。
(5)加入 “沉锰”时发生反应的离子方程式为
“沉锰”时发生反应的离子方程式为___________ 。
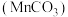 是制造电信器材软磁铁氧体的重要原料。工业上用硫锰矿(主要成分为
是制造电信器材软磁铁氧体的重要原料。工业上用硫锰矿(主要成分为 ,还含少量
,还含少量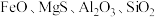 等)制备高纯
等)制备高纯 的流程如下:
的流程如下:
 如下表:
如下表:| 物质 |  |  |  |  |  |
 | 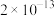 | 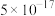 | 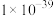 | 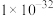 | 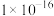 |
 。回答下列问题:
。回答下列问题:(1)为了提高硫锰矿在空气中“煅烧”的反应速率,可采取的措施是
(2)加入
 主要是氧化酸性溶液中的
主要是氧化酸性溶液中的 ,发生反应的离子方程式为
,发生反应的离子方程式为(3)加入氨水调节溶液
 为5.0,则溶液中
为5.0,则溶液中
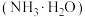 ;溶液中能够完全沉淀的金属离子为
;溶液中能够完全沉淀的金属离子为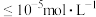 时,视为沉淀完全)。
时,视为沉淀完全)。(4)室温下“沉镁”时,离子反应
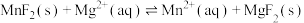 的化学平衡常数
的化学平衡常数
(5)加入
 “沉锰”时发生反应的离子方程式为
“沉锰”时发生反应的离子方程式为
您最近半年使用:0次
解题方法
2 . Ⅰ.有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是___________ 。(写化学式)
(2)步骤②中的离子方程式___________ 。
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:___________ (填“氧化”或“还原”)性;根据上述原理分析,K2FeO4作水处理剂净化水的过程中利用了Fe(OH)3胶体的性质,请写出Fe(OH)3胶体制备的化学方程式:___________ 。
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于___________ (填编号)。
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式___________ 。
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的是
(2)步骤②中的离子方程式
Ⅱ.高铁酸钾(极易溶于水)是优良的水处理剂,其原理如图所示:
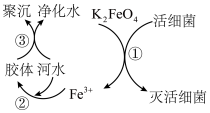
Ⅲ.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3XO2与NaOH反应最多生成两种盐。
(4)H3XO2属于
①一元酸 ②二元酸 ③三元酸
(5)写出 H3XO2溶液与少量NaOH溶液反应的化学方程式
您最近半年使用:0次
解题方法
3 . Ⅰ.为观察亚硫酸钠和浓硫酸的反应现象并探究 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:______ 。
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是____________ 。
(3)装置 产生的现象是
产生的现象是_________________________ ,其中 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为________________________ ,体现了的
______ 性。
(4) 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:____________ 。
Ⅱ.我国国家标准规定葡萄酒中的最大使用量为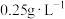 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与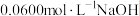 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:
(5)该葡萄酒中 的含量为
的含量为______  ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是________________________ 。
 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是
(3)装置
 产生的现象是
产生的现象是 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为
(4)
 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:Ⅱ.我国国家标准规定葡萄酒中的最大使用量为
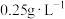 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与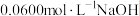 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:(5)该葡萄酒中
 的含量为
的含量为 ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是
您最近半年使用:0次
名校
解题方法
4 . 一氧化二氯( )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: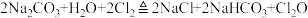 。
。
已知: 的部分性质如表所示
的部分性质如表所示
(1)装置A中仪器a的名称为______________ ,装置A中发生反应的化学方程式为______________ 。
(2)装置B中盛装的试剂的名称为______________ 。
(3)装置E采用冰水混合物冷却的目的是______________ 。
(4)装置F中无水 的作用是
的作用是______________ 。
(5)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的______________ 倍(产物视为 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
(6)某温度下,将氯气通入G装置中,反应得到 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______________ 。
 )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: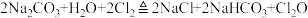 。
。已知:
 的部分性质如表所示
的部分性质如表所示| 物理性质 | 化学性质 |
常温下, 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ |  易溶于水,同时与水反应生成 易溶于水,同时与水反应生成 |
(1)装置A中仪器a的名称为
(2)装置B中盛装的试剂的名称为
(3)装置E采用冰水混合物冷却的目的是
(4)装置F中无水
 的作用是
的作用是(5)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。(6)某温度下,将氯气通入G装置中,反应得到
 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近半年使用:0次
5 . 含SO2和H2S废气的治理可以变废为宝,使硫资源得以利用。
(1)一种处理SO2废气的工艺流程如图所示。________ ;SO2吸收塔中发生反应化学方程式为________ 。
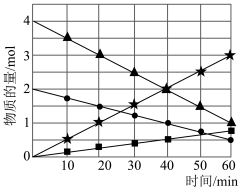
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:________ 。________ 。
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:________ 。(必须使用的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
(1)一种处理SO2废气的工艺流程如图所示。

(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:

②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:
您最近半年使用:0次
解题方法
6 . SO2是硫元素中一种重要物质,在生产生活中有重要用途。
(1)某研究小组用如图装置进行SO2与 溶液反应的相关实验(夹持装置已略去)
溶液反应的相关实验(夹持装置已略去)_________ 。
②根据以上现象,该小组同学认为SO2与 溶液发生氧化还原反应。
溶液发生氧化还原反应。
a.写出SO2与 溶液反应的离子方程式:
溶液反应的离子方程式:_________ 。
b.该小组同学向C试管反应后的溶液中加入硝酸酸化的 溶液,若出现白色沉淀,即可证明反应生成了
溶液,若出现白色沉淀,即可证明反应生成了 。该做法
。该做法_________ (填“合理”或“不合理”),理由是_________ 。
③为了验证SO2具有还原性,实验中可以代替 溶液的试剂有
溶液的试剂有_________ (填字母)。
A.浓硫酸 B.酸性 溶液 C.碘水 D.NaCl溶液
溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(熔点:SO2为 ,
, 为16.8℃,沸点:SO2为-10℃,
为16.8℃,沸点:SO2为-10℃, 为45℃)
为45℃)_________ 。
②装置Ⅱ的作用_________ 。
③甲同学按I、Ⅱ、Ⅲ、IV的顺序连接装置,装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时酸性增强,则该反应的离子方程式是_________ (忽略 的影响)。
的影响)。
(1)某研究小组用如图装置进行SO2与
 溶液反应的相关实验(夹持装置已略去)
溶液反应的相关实验(夹持装置已略去)
②根据以上现象,该小组同学认为SO2与
 溶液发生氧化还原反应。
溶液发生氧化还原反应。a.写出SO2与
 溶液反应的离子方程式:
溶液反应的离子方程式:b.该小组同学向C试管反应后的溶液中加入硝酸酸化的
 溶液,若出现白色沉淀,即可证明反应生成了
溶液,若出现白色沉淀,即可证明反应生成了 。该做法
。该做法③为了验证SO2具有还原性,实验中可以代替
 溶液的试剂有
溶液的试剂有A.浓硫酸 B.酸性
 溶液 C.碘水 D.NaCl溶液
溶液 C.碘水 D.NaCl溶液(2)某同学利用如图所示的装置研究SO2的性质:(熔点:SO2为
 ,
, 为16.8℃,沸点:SO2为-10℃,
为16.8℃,沸点:SO2为-10℃, 为45℃)
为45℃)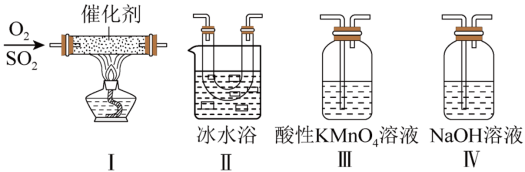
②装置Ⅱ的作用
③甲同学按I、Ⅱ、Ⅲ、IV的顺序连接装置,装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时酸性增强,则该反应的离子方程式是
 的影响)。
的影响)。
您最近半年使用:0次
7 . 在研究前18号元素时发现,随原子序数递增可以将它们排成如图所示的蜗牛形状。图中每个点代表一种元素,其中①代表氢元素。___________ 键(填“离子”或“共价”);
(2)写出由元素①、②、③形成的化合物的电子式___________ 。
(3)Li和元素③在同一族,现代航天工业中选择用 做供氧剂的原因是
做供氧剂的原因是___________ 。
(4)元素④在元素周期表中的位置是___________ 。
(5)自然界磷元素只存在一种稳定的核素 。约里奧-居里夫妇在核反应中用α粒子轰击
。约里奧-居里夫妇在核反应中用α粒子轰击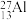 ,得到另一种核素
,得到另一种核素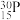 。
。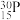 与
与 的关系是
的关系是___________ 。
(6)请设计实验验证元素④的非金属性弱于元素⑤的非金属性___________ (用离子方程式表示)。
(7)向由元素②、③、⑤按原子个数比1∶1∶1组成的化合物水溶液中滴入石蕊试液,溶液变成蓝色,一段时间后溶液颜色褪去,请解释原因___________ 。

(2)写出由元素①、②、③形成的化合物的电子式
(3)Li和元素③在同一族,现代航天工业中选择用
 做供氧剂的原因是
做供氧剂的原因是(4)元素④在元素周期表中的位置是
(5)自然界磷元素只存在一种稳定的核素
 。约里奧-居里夫妇在核反应中用α粒子轰击
。约里奧-居里夫妇在核反应中用α粒子轰击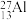 ,得到另一种核素
,得到另一种核素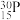 。
。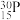 与
与 的关系是
的关系是(6)请设计实验验证元素④的非金属性弱于元素⑤的非金属性
(7)向由元素②、③、⑤按原子个数比1∶1∶1组成的化合物水溶液中滴入石蕊试液,溶液变成蓝色,一段时间后溶液颜色褪去,请解释原因
您最近半年使用:0次
8 . 实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。 的发生装置。
的发生装置。
(1)装置a中,为了使浓盐酸在反应中顺利滴入,应采取的措施是___________ 。
(2)比较制取氯酸钾和次氯酸钠的条件,你得出的结论是___________ 。
(3)将d中余气与f中产生的气体通入e中,产生的现象是___________ ,请用离子方程式表示产生此现象的原因:___________ 、___________ 。
(4)写出装置c中发生反应的化学方程式___________ 。
(5)工业上为了变废为宝,可用多种方式处理硫酸工业排出的尾气(主要含 ),其中之一便是用
),其中之一便是用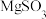 浆液吸收。溶液中
浆液吸收。溶液中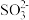 吸收
吸收 的离子方程式为
的离子方程式为___________ (已知20℃时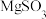 的溶解度为0.57g)。
的溶解度为0.57g)。
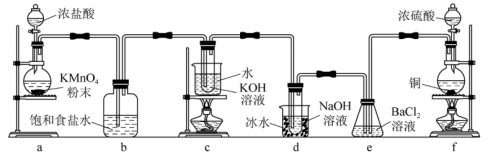
 的发生装置。
的发生装置。(1)装置a中,为了使浓盐酸在反应中顺利滴入,应采取的措施是
(2)比较制取氯酸钾和次氯酸钠的条件,你得出的结论是
(3)将d中余气与f中产生的气体通入e中,产生的现象是
(4)写出装置c中发生反应的化学方程式
(5)工业上为了变废为宝,可用多种方式处理硫酸工业排出的尾气(主要含
 ),其中之一便是用
),其中之一便是用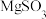 浆液吸收。溶液中
浆液吸收。溶液中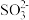 吸收
吸收 的离子方程式为
的离子方程式为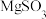 的溶解度为0.57g)。
的溶解度为0.57g)。
您最近半年使用:0次
9 . 近年来,废旧锂离子电池的回收成为目前新能源产业重要的发展方向。某锂离子二次电池的正极材料主要为LiCoO2,还含有少量Al、Fe、Mn、Ni的化合物。通过如图所示的流程利用废旧锂离子电池制备草酸钴晶体(CoC2O4·xH2O),回答下列问题:
(1)LiCoO2中Co的化合价为___________ ,“酸浸还原”中LiCoO2转化为(Co2+,氧化产物是SO2,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)“水解净化”的滤渣主要成分为___________ (填化学式)。
(3)“氧化沉铁锰”的操作为控制体系的pH在4~5,加入NaClO溶液。其中Mn2+转化为MnO2的离子方程式为___________ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因是___________ 。
(4)利用“P507萃取剂”从“滤液”中分离Co2+萃取时,Co、Ni的萃取率和Co/Ni分离因素与水相pH的关系如图所示。
(5)“沉钴”时反应的化学方程式为___________ 。
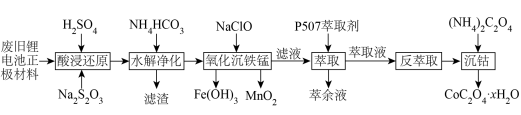
| 离子 | Co2+ | Fe3+ | Fe2+ | Al3+ | Mn2+ | Ni2+ |
| pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
(1)LiCoO2中Co的化合价为
(2)“水解净化”的滤渣主要成分为
(3)“氧化沉铁锰”的操作为控制体系的pH在4~5,加入NaClO溶液。其中Mn2+转化为MnO2的离子方程式为
(4)利用“P507萃取剂”从“滤液”中分离Co2+萃取时,Co、Ni的萃取率和Co/Ni分离因素与水相pH的关系如图所示。
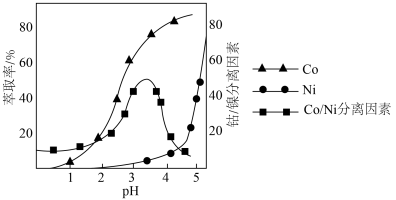
| A.2.5 | B.3.0 | C.3.5 | D.4.0 |
(5)“沉钴”时反应的化学方程式为
您最近半年使用:0次
7日内更新
|
141次组卷
|
2卷引用:2024届内蒙古自治区赤峰市高三下学期三模理科综合试题-高中化学
名校
解题方法
10 . 研究人员拟设计黄铜矿(主要含CuFeS2)制备硝酸铜和绿矾晶体的流程如下:
(1)CuFeS2中铁元素的化合价为___________ 价,已知“焙烧”生成SO2、CuO和Fe2O3,则其化学反应方程式为___________ 。
(2)“置换”步骤中发生的所有反应的离子方程式有___________ 、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑。
(3)流程中“操作 A”所需的玻璃仪器有_____________ 。
(4)“浸洗”步骤中加溶液A 的目的是_______________ 。
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:___________ 。
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为_______________ 。
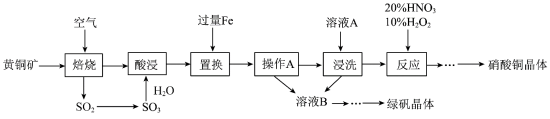
(1)CuFeS2中铁元素的化合价为
(2)“置换”步骤中发生的所有反应的离子方程式有
(3)流程中“操作 A”所需的玻璃仪器有
(4)“浸洗”步骤中加溶液A 的目的是
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为
您最近半年使用:0次



