1 . 根据所学知识,进行作答
(1)2023年第19届杭州亚运会场馆实现 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为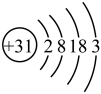 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置___________ 。
(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛 颗粒的供氧装置。
颗粒的供氧装置。
① 中的氧元素的化合价为
中的氧元素的化合价为___________ 价。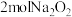 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为___________ L。
②如用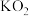 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出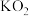 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。
①资料(3)涉及的物质中,属于碱的是___________ (填化学式,下同);属于盐的是___________ 。
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是___________ (用离子方程式表示),但“84消毒液”却不能与“洁厕灵”(浓盐酸)混合使用,原因是___________ (用离子方程式表示)。
(1)2023年第19届杭州亚运会场馆实现
 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛
 颗粒的供氧装置。
颗粒的供氧装置。①
 中的氧元素的化合价为
中的氧元素的化合价为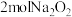 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为②如用
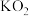 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出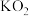 与
与 反应的化学方程式
反应的化学方程式(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由
 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。①资料(3)涉及的物质中,属于碱的是
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是
您最近一年使用:0次
名校
2 . 填空
(1)某一反应体系有反应物和生成物共五种物质: 、
、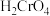 、
、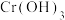 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: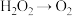
①该反应中的还原剂是______ .
②该反应中,发生还原反应的过程是______ .
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目______ .
④如反应转移了0.3mol电子,则产生的气体在标准状况下体积为______ .
(2)在反应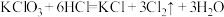 中,还原产物是
中,还原产物是______ ,反应中的氧化剂与还原剂物质的量之比为______ .
(1)某一反应体系有反应物和生成物共五种物质:
 、
、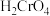 、
、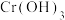 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: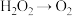
①该反应中的还原剂是
②该反应中,发生还原反应的过程是
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
④如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(2)在反应
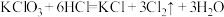 中,还原产物是
中,还原产物是
您最近一年使用:0次
名校
3 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
(2)我国用 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:___________ 。将该反应化学方程式改写为离子方程式:___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下降 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为___________ 。
(5)实验室用下列方法均可制取氯气
①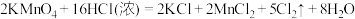 ③
③
②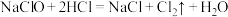 ②
②
③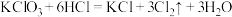 ④
④
若各反应转移的电子数相同,①②③生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的两种产物可能为___________。A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 替代氯气进行消毒,工业上常利用反应
替代氯气进行消毒,工业上常利用反应 制备
制备 ,用单线桥法表示反应中电子得失的方向和数目:
,用单线桥法表示反应中电子得失的方向和数目:(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列6种物质:
),反应体系中涉及下列6种物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下降
 通入KOH溶液里,反应后得到KCl、KClO、
通入KOH溶液里,反应后得到KCl、KClO、 的混合溶液,其中
的混合溶液,其中 与
与 的个数之比为11:1,则
的个数之比为11:1,则 与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为
与KOH反应时,被还原的氯原子和被氧化的氯原子的个数之比为(5)实验室用下列方法均可制取氯气
①
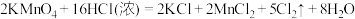 ③
③②
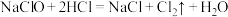 ②
②③
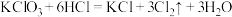 ④
④若各反应转移的电子数相同,①②③生成的氯气质量比为
您最近一年使用:0次
名校
4 . 写出下列方程式
(1)写出下列物质在水中的电离方程式:
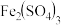
____________________ ,NaHSO4________________ ,
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应____________ ,
氢氧化钡溶液与稀硫酸反应_________ ;
(3)利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

①“酸溶”时,Fe2O3与硫酸反应的化学方程式为__________ 。
②已知滤渣Ⅰ的主要成分是FeS2、S和SiO2;Fe3+被FeS2还原的离子方程式为______ 。
③“氧化”中,生成FeOOH的离子方程式为_______ 。
(1)写出下列物质在水中的电离方程式:
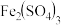
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应
氢氧化钡溶液与稀硫酸反应
(3)利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

①“酸溶”时,Fe2O3与硫酸反应的化学方程式为
②已知滤渣Ⅰ的主要成分是FeS2、S和SiO2;Fe3+被FeS2还原的离子方程式为
③“氧化”中,生成FeOOH的离子方程式为
您最近一年使用:0次
名校
5 . 碳、硅、锗、锡、铅属于同一主族元素,其单质及化合物具有重要的用途。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为_______ ,电池放电时正极质量将_______ 。(填“增大”、“减小”或“不变”)

(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:__________ ;
②写出“复分解”反应的化学方程式:___________ 。
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2 X+6CO。
X+6CO。
①X的化学式为_______ 。
②下列措施不 能提高该反应速率的是_______ (填字母)。
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为_______ 。
(1)铅蓄电池是最早使用的充电电池,其构造示意图如图所示,放电时的离子反应方程式为PbO2+Pb+4H++2
 =2PbSO4+2H2O。该电池的负极为
=2PbSO4+2H2O。该电池的负极为
(2)PbO2可发生如图所示的转化:

①写出“还原”反应的离子方程式:
②写出“复分解”反应的化学方程式:
(3)1400℃~1450℃时,石英、焦炭和氮气可反应生成耐高温、硬度大的化合物X,该反应的化学方程式为3SiO2+6C+2N2
 X+6CO。
X+6CO。①X的化学式为
②下列措施
a.将石英和焦炭充分混合 b.增大N2的浓度 c.将粉末状石英换成块状石英
(4)甲醇是常见的燃料电池原料,CO2催化氢化可合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH<0。在2L容器中充入1molCO2和3moH2的混合气体,反应10min后,气体的总物质的量变为原来的75%。则0~10min内,H2的平均反应速率为
您最近一年使用:0次
2021-05-03更新
|
286次组卷
|
2卷引用:湖南省岳阳临湘市2020-2021学年高一下学期期末考试化学试题
解题方法
6 . 图中两圆相交部分(A、B、C、D)表示铁、稀盐酸、澄清石灰水、氯化铜溶液彼此之间的反应关系,写出对应的离子反应方程式。

(1)A_______ 、B_______ 、C_______ 、D_______
(2)用双线桥标出上述氧化还原反应中电子转移的方向和数目。_______
(3)自来水中的 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。_____ Al+ _____  +
+ ________ = _____ 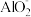 +
+_____ N2↑ +_____

(1)A
(2)用双线桥标出上述氧化还原反应中电子转移的方向和数目。
(3)自来水中的
 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。 +
+ 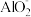 +
+
您最近一年使用:0次
名校
解题方法
7 . 氨气(NH3)是一种无色有刺激性气味的气体,极溶于水,它的水溶液称为氨水,显碱性。氨在化学工业中用作很广泛,例如制化肥、制纯碱等。近年来,氨还用于环境治理。
(1)氨分子中氮、氢元素的质量之比为__ 。
(2)“侯氏制碱法”其中一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,其生成物A也可用作化肥,A中氮元素的质量分数为___ 。
(3)在细菌作用下,用氨处理含甲醇的工业废水,使其变为N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B=3N2↑+5CO2↑+19H2O,其中B物质的化学式是__ 。
(4)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,与出该反应的化学方程式:__ 。
(1)氨分子中氮、氢元素的质量之比为
(2)“侯氏制碱法”其中一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,其生成物A也可用作化肥,A中氮元素的质量分数为
(3)在细菌作用下,用氨处理含甲醇的工业废水,使其变为N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B=3N2↑+5CO2↑+19H2O,其中B物质的化学式是
(4)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,与出该反应的化学方程式:
您最近一年使用:0次
名校
8 . 硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目_________________
(2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是_________ (填字母代号)。
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
产生的气体分别是_______________ ,其物质的量之比是_______________
(3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。___ HNO3+_______ → _______ + _______ +___ NO↑+___ H2O
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______ (填字母代号)。
A.Cu Cu(NO3)2
Cu(NO3)2
B.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
C.Cu CuO
CuO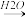 Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2
D.Cu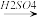 CuSO4
CuSO4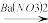 Cu(NO3)2
Cu(NO3)2
(1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目
(2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
产生的气体分别是
(3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是
A.Cu
 Cu(NO3)2
Cu(NO3)2B.Cu
 CuO
CuO Cu(NO3)2
Cu(NO3)2C.Cu
 CuO
CuO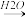 Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2D.Cu
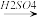 CuSO4
CuSO4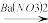 Cu(NO3)2
Cu(NO3)2
您最近一年使用:0次
名校
9 . 化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,常用作脱氧剂利脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为________________ 。
(2)物质氧化性和还原性的强弱是相对的。已知氧化性: KMnO4(H+)>H2O2,请写出 KMnO4(H+)与H2O2反应的离子方程式:________________ 。
(3)向含有nmol溴化亚铁和nmol碘化亚铁的混合溶液中通入2nmol氯气。请写出该过程的离子反应方程式:________________ 。
(4)两份溶液: NH4Al(SO4)2溶液利Ba(OH)2溶液,二者以溶质物质的量之比为2:5混合,请写出离子反应方程式:________________ 。
(1)Na2S2O3还原性较强,常用作脱氧剂利脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为
(2)物质氧化性和还原性的强弱是相对的。已知氧化性: KMnO4(H+)>H2O2,请写出 KMnO4(H+)与H2O2反应的离子方程式:
(3)向含有nmol溴化亚铁和nmol碘化亚铁的混合溶液中通入2nmol氯气。请写出该过程的离子反应方程式:
(4)两份溶液: NH4Al(SO4)2溶液利Ba(OH)2溶液,二者以溶质物质的量之比为2:5混合,请写出离子反应方程式:
您最近一年使用:0次
名校
10 . (I)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。试回答:
(1)软锰矿制备K2MnO4的化学方程式是____________________________ 。
(2)K2MnO4制备KMnO4的离子方程式是__________________________________ 。
(3)KMnO4能与热的稀硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是________________________________________________ 。
(II)检验Na2SO3样品部分被氧化的实验操作及现象_____________________ 。
(III)在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:_______________________ 。
(1)软锰矿制备K2MnO4的化学方程式是
(2)K2MnO4制备KMnO4的离子方程式是
(3)KMnO4能与热的稀硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是
(II)检验Na2SO3样品部分被氧化的实验操作及现象
(III)在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:
您最近一年使用:0次



