解题方法
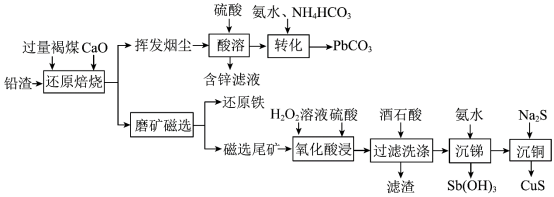
1 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下: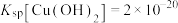 ,
, ,
, 。
。
②金属离子浓度等于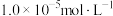 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。
(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]___________ 。
(2)“还原焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)挥发烟尘中的主要氧化物为 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为___________ 。
(4)“氧化酸浸”过程中,若将物质的量为2mol的 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为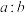 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为___________ mol(用含a、b的式子表示)。
(5)“过滤洗涤”过程中,加入酒石酸(分子式为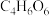 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;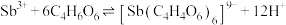 。
。
①上述两个配合物中,提供孤对电子的元素为___________ (填元素符号)。
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为___________ 。
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中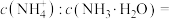
___________ 。
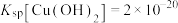 ,
, ,
, 。
。②金属离子浓度等于
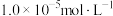 时,可认为其恰好沉淀完全。
时,可认为其恰好沉淀完全。(1)Sb元素的原子序数为51,与氮元素同主族,其基态电子排布式为[Kr]
(2)“还原焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)挥发烟尘中的主要氧化物为
 。“转化”过程中,发生反应的离子方程式为
。“转化”过程中,发生反应的离子方程式为(4)“氧化酸浸”过程中,若将物质的量为2mol的
 合金(其中Cu与Sb物质的量之比为
合金(其中Cu与Sb物质的量之比为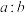 )氧化,至少需要
)氧化,至少需要 的物质的量为
的物质的量为(5)“过滤洗涤”过程中,加入酒石酸(分子式为
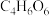 ,结构简式
,结构简式 )发生如下反应:
)发生如下反应: ;
;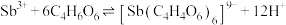 。
。①上述两个配合物中,提供孤对电子的元素为
②“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
(6)“沉锑”过程中,锑恰好沉淀完全时,溶液中
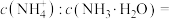
您最近半年使用:0次
解题方法
2 . 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业氧化锌[含有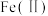 、
、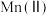 、
、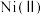 等杂质]的流程如下
等杂质]的流程如下


已知:①在本实验条件下,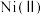 不能被氧化;高锰酸钾的还原产物是
不能被氧化;高锰酸钾的还原产物是 。
。
②不考虑操作过程中引起的质量损失。
回答下列问题:
(1)加稀硫酸酸浸时,常将工业 粉碎,其目的是
粉碎,其目的是_____ 。
(2)过滤时,主要用到的玻璃仪器有烧杯、玻璃棒和________ ,其中玻璃棒的作用为_________ 。
(3)②发生反应的离子方程式有 和
和________ 。
(4)若④中产物仅为 ,则发生反应的离子方程式为
,则发生反应的离子方程式为________ ;取干燥后的滤饼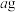 ,煅烧后可得到产品(
,煅烧后可得到产品( )
) ,则
,则 等于
等于_____ (用含a、m的代数式表示)。
(5)④形成的沉淀要水洗,检验沉淀是否洗涤干净的操作和现象是________ 。
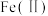 、
、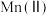 、
、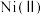 等杂质]的流程如下
等杂质]的流程如下

已知:①在本实验条件下,
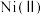 不能被氧化;高锰酸钾的还原产物是
不能被氧化;高锰酸钾的还原产物是 。
。②不考虑操作过程中引起的质量损失。
回答下列问题:
(1)加稀硫酸酸浸时,常将工业
 粉碎,其目的是
粉碎,其目的是(2)过滤时,主要用到的玻璃仪器有烧杯、玻璃棒和
(3)②发生反应的离子方程式有
 和
和(4)若④中产物仅为
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为 ,煅烧后可得到产品(
,煅烧后可得到产品( )
) ,则
,则 等于
等于(5)④形成的沉淀要水洗,检验沉淀是否洗涤干净的操作和现象是
您最近半年使用:0次
解题方法
3 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2.某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。___________ ,装置B中除杂质所用试剂是___________ ,装置D的作用是___________ 。
(2)A中发生反应的离子方程式为___________ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是___________ 。
(4)写出C中总反应的离子方程式:___________ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
(5)根据以上数据,样品中K2FeO4的质量分数为___________ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
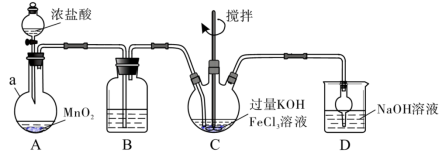
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是
(4)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近半年使用:0次
4 . 联氨 是一种绿色环保还原剂,为二元弱碱,在水中的电离方程式与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,下列说法错误的是
是一种绿色环保还原剂,为二元弱碱,在水中的电离方程式与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,下列说法错误的是
 是一种绿色环保还原剂,为二元弱碱,在水中的电离方程式与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,下列说法错误的是
是一种绿色环保还原剂,为二元弱碱,在水中的电离方程式与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,下列说法错误的是A.向装有少量 的试管中加入联氨溶液,可观察到固体逐渐变黑,发生的反应为 的试管中加入联氨溶液,可观察到固体逐渐变黑,发生的反应为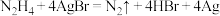 |
B.碱性: |
C.理论上1mol 可处理水中1mol 可处理水中1mol |
D. 是极性分子 是极性分子 |
您最近半年使用:0次
名校
5 . SO2、NOx为常见的空气污染物,会引起酸雨、光化学烟雾等污染问题。为消除燃煤烟气中含有的SO2、NO,研究者以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示:

已知烟气中SO2与NO的体积比为4:1,且吸收后转化为: 、
、 。下列说法正确的是
。下列说法正确的是

已知烟气中SO2与NO的体积比为4:1,且吸收后转化为:
 、
、 。下列说法正确的是
。下列说法正确的是| A.SO2和NO均为酸性氧化物 |
| B.温度越高,“脱硫”“脱硝”效率越高 |
C.SO2在吸收过程中,反应的离子方程式是: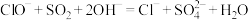 |
D.50℃时,吸收液中烟气转化生成的Cl-和 的物质的量之比13:2 的物质的量之比13:2 |
您最近半年使用:0次
名校
解题方法
6 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
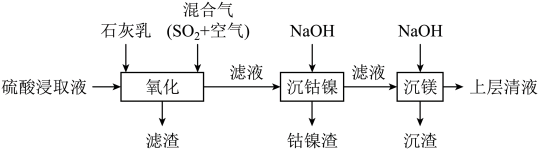
已知:
回答下列问题:
(1)基态Co原子的价层电子轨道表示式为___________ 。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为:___________ ;得到滤渣的主要成分为 、
、___________ (填化学式)。
(3)“沉钴镍”中得到的 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
(4)“沉镁”中为使 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于___________ (精确至0.1)。
(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
(6)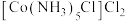 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是___________ 。
 、
、 、
、 、
、 、
、 和
和 )。实现钴、镍、镁元素的回收。
)。实现钴、镍、镁元素的回收。
已知:
| 物质 |  |  |  |  |
 |  | 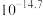 | 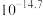 | 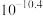 |
(1)基态Co原子的价层电子轨道表示式为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(已知
 的电离方程式为:
的电离方程式为: 、
、 )。“氧化”中先用石灰乳调节
)。“氧化”中先用石灰乳调节 ,再加入“混合气”,
,再加入“混合气”, 被
被 氧化为
氧化为 ,该氧化还原反应过程的离子方程式为:
,该氧化还原反应过程的离子方程式为: 、
、(3)“沉钴镍”中得到的
 在空气中可被氧化成
在空气中可被氧化成 ,该反应的化学方程式为:
,该反应的化学方程式为:(4)“沉镁”中为使
 沉淀完全(25℃),需控制pH不低于
沉淀完全(25℃),需控制pH不低于(5)钴镍渣是湿法炼锌净化渣之一,其中含有少量Co(Ⅱ)、Cd(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)的硫酸盐及氢氧化物。利用以下工艺流程回收金属并制备氧化锌:

下列说法正确的是:___________(填标号)。
| A.粉碎矿渣、升高温度均可以提高“溶浸”率 |
B.通过高温焙烧可以将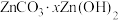 制得氧化锌 制得氧化锌 |
C.根据 中S的化合价分析, 中S的化合价分析, 具有强还原性 具有强还原性 |
D. 可与浓盐酸反应生成 可与浓盐酸反应生成 , , 参与反应可生成 参与反应可生成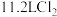 |
(6)
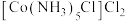 可用作聚氯乙烯的染色剂和稳定剂。氨气中
可用作聚氯乙烯的染色剂和稳定剂。氨气中 的键角比该配合物中
的键角比该配合物中 的键角小,其原因是
的键角小,其原因是
您最近半年使用:0次
名校
7 . 下列有关描述对应的离子方程式书写正确的是
A.食醋除去瓶胆内的水垢: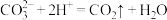 |
B.碳酸氢钙溶液与过量的澄清石灰水混合: |
C.向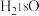 中投入 中投入 固体: 固体: |
D.乙醇被酸性 溶液氧化成乙酸: 溶液氧化成乙酸: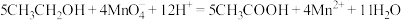 |
您最近半年使用:0次
名校
解题方法
8 . 利用硫铁矿烧渣(主要成分为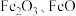 和
和 等)制备
等)制备 的工艺流程如图所示:
的工艺流程如图所示:
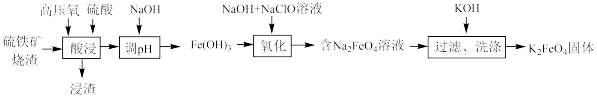
下列说法错误的是
A.“酸浸”时,充入高压氧的目的是增大溶解氧的量,使 充分被氧化 充分被氧化 |
B.浸渣的主要成分为硅酸,若酸浸时不进行过滤,其将会导致 产品纯度降低 产品纯度降低 |
C.“氧化”时,发生反应的离子方程式为 |
D.根据流程可知 的溶解度小于 的溶解度小于 ,洗涤 ,洗涤 固体时可选择 固体时可选择 溶液 溶液 |
您最近半年使用:0次
2024-02-26更新
|
345次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期3月月考化学试题
9 . 全球能源结构正在向多元、清洁、低碳转型。太阳能的利用是热门研究方向之一,例如,可以利用太阳能将水转化为 ,某种光分解水的过程如图所示,下列说法不正确的是
,某种光分解水的过程如图所示,下列说法不正确的是
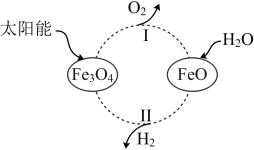
 ,某种光分解水的过程如图所示,下列说法不正确的是
,某种光分解水的过程如图所示,下列说法不正确的是
A.该转化发生的总反应为 |
B.该转化过程中循环利用的物质有 |
C.过程Ⅰ中每产生 ,同时产生 ,同时产生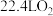 |
D.过程Ⅱ中生成 和 和 的物质的量之比为 的物质的量之比为 |
您最近半年使用:0次
10 . 根据所学知识,进行作答
(1)2023年第19届杭州亚运会场馆实现 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为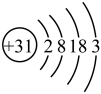 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置___________ 。
(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛 颗粒的供氧装置。
颗粒的供氧装置。
① 中的氧元素的化合价为
中的氧元素的化合价为___________ 价。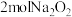 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为___________ L。
②如用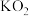 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出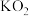 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。
①资料(3)涉及的物质中,属于碱的是___________ (填化学式,下同);属于盐的是___________ 。
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是___________ (用离子方程式表示),但“84消毒液”却不能与“洁厕灵”(浓盐酸)混合使用,原因是___________ (用离子方程式表示)。
(1)2023年第19届杭州亚运会场馆实现
 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛
 颗粒的供氧装置。
颗粒的供氧装置。①
 中的氧元素的化合价为
中的氧元素的化合价为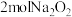 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为②如用
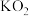 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出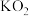 与
与 反应的化学方程式
反应的化学方程式(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由
 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。①资料(3)涉及的物质中,属于碱的是
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是
您最近半年使用:0次



