名校
解题方法
1 . 利用硫铁矿烧渣(主要成分为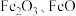 和
和 等)制备
等)制备 的工艺流程如图所示:
的工艺流程如图所示:
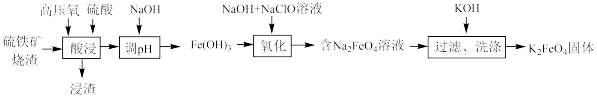
下列说法错误的是
A.“酸浸”时,充入高压氧的目的是增大溶解氧的量,使 充分被氧化 充分被氧化 |
B.浸渣的主要成分为硅酸,若酸浸时不进行过滤,其将会导致 产品纯度降低 产品纯度降低 |
C.“氧化”时,发生反应的离子方程式为 |
D.根据流程可知 的溶解度小于 的溶解度小于 ,洗涤 ,洗涤 固体时可选择 固体时可选择 溶液 溶液 |
您最近一年使用:0次
2024-02-26更新
|
357次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期3月月考化学试题
名校
2 . B、Al、Ga位于元素周期表中ⅢA族。 为无色气体,主要用作有机合成中的催化剂,极易水解生成
为无色气体,主要用作有机合成中的催化剂,极易水解生成 (
( 在水中完全电离为
在水中完全电离为 和
和 )和硼酸(
)和硼酸( )。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯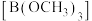 ,硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下
,硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下 和焦炭在氯气的氛围中获得
和焦炭在氯气的氛围中获得 。GaN的结构与晶体硅类似,是第三代半导体研究的热点。下列化学反应表示
。GaN的结构与晶体硅类似,是第三代半导体研究的热点。下列化学反应表示不正确 的是
 为无色气体,主要用作有机合成中的催化剂,极易水解生成
为无色气体,主要用作有机合成中的催化剂,极易水解生成 (
( 在水中完全电离为
在水中完全电离为 和
和 )和硼酸(
)和硼酸( )。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯
)。硼酸是一元弱酸,能溶于水,硼酸和甲醇在浓硫酸存在下生成挥发性的硼酸甲酯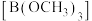 ,硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下
,硼酸甲酯主要用作热稳定剂、木材防腐剂等。高温下 和焦炭在氯气的氛围中获得
和焦炭在氯气的氛围中获得 。GaN的结构与晶体硅类似,是第三代半导体研究的热点。下列化学反应表示
。GaN的结构与晶体硅类似,是第三代半导体研究的热点。下列化学反应表示A.制备 : : |
B. 和NaOH溶液反应: 和NaOH溶液反应: |
C.高温下 、焦炭在氯气中反应: 、焦炭在氯气中反应: |
D.电解 (熔融)制备Al的阳极反应: (熔融)制备Al的阳极反应: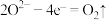 |
您最近一年使用:0次
2023-09-07更新
|
127次组卷
|
2卷引用:湖南省岳阳市第一中学2023-2024学年高三下学期开学化学试题
解题方法
3 .  是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和
是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和 。工业上用硫化碱法制备
。工业上用硫化碱法制备 的反应方程式为:
的反应方程式为: ,实验室用此法制备
,实验室用此法制备 的装置如图所示:
的装置如图所示:

请回答下列问题:
(1)仪器a的名称为_______ 。
(2) 的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开
的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开  ,关闭
,关闭 ,调节
,调节 使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开
使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开  ,关闭
,关闭 、
、 ,原因是
,原因是 _______ ;②将装置C中所得溶液经一系列操作,最后洗涤、干燥,得到 样品。洗涤时为尽可能避免产品损失应选用的试剂是
样品。洗涤时为尽可能避免产品损失应选用的试剂是 _______ 。
a.水 b.乙醇 c.氢氧化钠溶液 d.稀盐酸
制备 的上述装置的明显不足是
的上述装置的明显不足是 _______ 。
(3) 样品纯度的测定:称取
样品纯度的测定:称取 样品,配制成200mL溶液;在锥形瓶中加入
样品,配制成200mL溶液;在锥形瓶中加入

 溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配
溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配  溶液滴定,当
溶液滴定,当 _______ 时达到滴定终点,测得消耗 溶液的体积为
溶液的体积为  ,则样品中硫代硫酸钠的质量分数为
,则样品中硫代硫酸钠的质量分数为 _______  。
。 已知:
已知: 的相对分子质量为158 , 相关反应:
的相对分子质量为158 , 相关反应: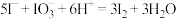 ;
; 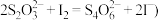
(4) 的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成
的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成 ,反应的离子方程式为
,反应的离子方程式为_______ 。
 是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和
是重要的化工原料,易溶于水,难溶于乙醇,在中性或碱性溶液中稳定存在,在酸性溶液中易生成S和 。工业上用硫化碱法制备
。工业上用硫化碱法制备 的反应方程式为:
的反应方程式为: ,实验室用此法制备
,实验室用此法制备 的装置如图所示:
的装置如图所示:
请回答下列问题:
(1)仪器a的名称为
(2)
 的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开
的制备:①先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开  ,关闭
,关闭 ,调节
,调节 使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开
使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开  ,关闭
,关闭 、
、 ,原因是
,原因是  样品。洗涤时为尽可能避免产品损失应选用的试剂是
样品。洗涤时为尽可能避免产品损失应选用的试剂是 a.水 b.乙醇 c.氢氧化钠溶液 d.稀盐酸
制备
 的上述装置的明显不足是
的上述装置的明显不足是 (3)
 样品纯度的测定:称取
样品纯度的测定:称取 样品,配制成200mL溶液;在锥形瓶中加入
样品,配制成200mL溶液;在锥形瓶中加入

 溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配
溶液和过量的酸性KI溶液,再滴入几滴淀粉溶液,立即用所配  溶液滴定,当
溶液滴定,当  溶液的体积为
溶液的体积为  ,则样品中硫代硫酸钠的质量分数为
,则样品中硫代硫酸钠的质量分数为  。
。 已知:
已知: 的相对分子质量为158 , 相关反应:
的相对分子质量为158 , 相关反应: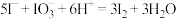 ;
; 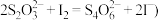
(4)
 的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成
的应用:其溶液可除去漂白的织物及纸浆中残留的氯气,硫代硫酸钠被氧化成 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
4 . 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_______ ,其中氧化剂是_______ 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_______ 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_______ (填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_______ (填序号)。
A. 容器中N2、H2、NH3共存
B. N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D. 容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_______ 。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为_______ 。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。①合成氨的反应中的能量变化如图所示。该反应是

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是
A. 容器中N2、H2、NH3共存
B. N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D. 容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为
您最近一年使用:0次
名校
解题方法
5 . 已知:将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中,部分有关物质转化如图所示。下列说法正确的是
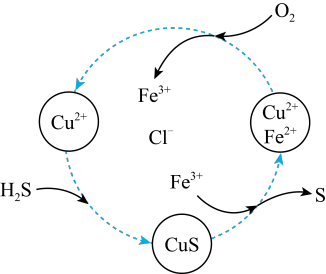
| A.CuCl2溶液和H2S反应的离子方程式为S2−+Cu2+=CuS↓ |
| B.FeCl3在转化过程中发生的反应为Fe3+ +CuS=Fe2++ Cu2++S |
| C.O2在转化过程中发生的反应为O2 +2Fe2+ +4H+=2Fe3++2H2O |
| D.反应过程中的总反应为2H2S+O2=2S↓+2H2O |
您最近一年使用:0次
2022-07-10更新
|
331次组卷
|
4卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期4月期中考试化学试题
6 . 已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
| A.NH4CuSO3中硫元素被还原 |
| B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中硫酸既体现了酸性又体现了氧化性 |
| D.反应中每消耗1molNH4CuSO3,转移的电子数约为3.01×1023 |
您最近一年使用:0次
名校
解题方法
7 . 已知Mn2O 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是
 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是| A.+2 | B.+4 | C.+3 | D.+6 |
您最近一年使用:0次
2022-02-28更新
|
850次组卷
|
36卷引用:湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题
湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题河南省安阳市第三十六中学2017-2018学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题山东省济宁市邹城兖矿一中2020-2021学年度高一9月月考化学试题吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】30广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】9. 2020 高一上 铁路一中 刘惠文 钟欣(已下线)【浙江新东方】双师 (55)宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题河北衡水市第十四中学2020-2021学年高一上学期三调考试化学试题天津市滨海新区2020-2021学年高一上学期期末考试化学试题河北省衡水市武邑武罗学校2020-2021学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期第一次摸底考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第一次月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期竞赛化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题四川省成都市第七中学2021-2022学年高一上学期期中考试化学试题四川省攀枝花市第十五中学校2021-2022学年高一上学期期中考试化学试题安徽省安庆市第十中学2021-2022学年高一上学期10月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学校2022-2023学年高一上学期第二次调研考试化学试题四川省仁寿县铧强中学2021-2022学年高一上学期半期考试化学试题云南省昆明市第八中学2020-2021学年高一上学期期中考试化学试题(已下线)专题七 氧化还原反应天津市宁河区2023-2024学年高一上学期期末考试化学试题
名校
解题方法
8 . 氨气(NH3)是一种无色有刺激性气味的气体,极溶于水,它的水溶液称为氨水,显碱性。氨在化学工业中用作很广泛,例如制化肥、制纯碱等。近年来,氨还用于环境治理。
(1)氨分子中氮、氢元素的质量之比为__ 。
(2)“侯氏制碱法”其中一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,其生成物A也可用作化肥,A中氮元素的质量分数为___ 。
(3)在细菌作用下,用氨处理含甲醇的工业废水,使其变为N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B=3N2↑+5CO2↑+19H2O,其中B物质的化学式是__ 。
(4)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,与出该反应的化学方程式:__ 。
(1)氨分子中氮、氢元素的质量之比为
(2)“侯氏制碱法”其中一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,其生成物A也可用作化肥,A中氮元素的质量分数为
(3)在细菌作用下,用氨处理含甲醇的工业废水,使其变为N2和CO2,从而清除对环境的污染,有关的反应为:6NH3+5CH3OH+12B=3N2↑+5CO2↑+19H2O,其中B物质的化学式是
(4)在400℃左右,有催化剂存在的条件下,用氨气可将有毒气体NO还原为N2和H2O,与出该反应的化学方程式:
您最近一年使用:0次
12-13高一上·湖南岳阳·期末
9 . 洪灾过后,饮用水的杀菌消毒成为抑制大规模传染性疾病爆发的有效方法之一、漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为_______ ;
(2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓) MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是
MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是_______ (填化学式),氧化剂与还原剂的物质的量之比为_______ ,若生成的Cl2在标准状况下的体积为672 ml ,则转移电子_______ mol 。
(3)检验Cl2已集满的方法:_______ 。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
(2)实验室常用软锰矿(主要成分为MnO2)和浓盐酸反应制Cl2,其化学方程式为MnO2+4HCl(浓)
 MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是
MnCl2+Cl2 ↑+ 2H2O,其中,氧化产物是(3)检验Cl2已集满的方法:
您最近一年使用:0次



