名校
解题方法
1 . 以含钼( )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有 、
、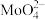 、
、___________ 。欲提高单位时间内钼的浸取率,可以采取的措施有___________ (任写一点)。
(3)除杂。向浸取后的滤液中通入过量 ,过滤。通入过量
,过滤。通入过量 的目的
的目的___________ 。
(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的 小于6,使
小于6,使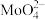 转化为
转化为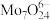 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为___________ 。
(5)应用。将 制成
制成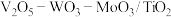 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度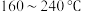 之间,
之间, 转化率不高的原因是
转化率不高的原因是___________ 。
 )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: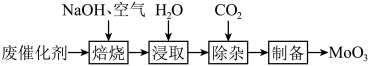
 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有
 、
、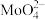 、
、(3)除杂。向浸取后的滤液中通入过量
 ,过滤。通入过量
,过滤。通入过量 的目的
的目的(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的
 小于6,使
小于6,使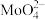 转化为
转化为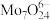 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为(5)应用。将
 制成
制成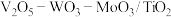 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度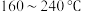 之间,
之间, 转化率不高的原因是
转化率不高的原因是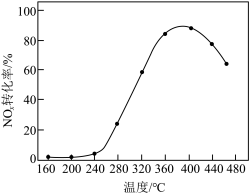
您最近一年使用:0次
2024-01-28更新
|
834次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题2024届江苏省连云港市高三第一次调研考试(一模)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
2 . 已知离子方程式:As2S3+H2O+NO →AsO
→AsO +SO
+SO +NO↑+___________(未配平),下列说法错误的是
+NO↑+___________(未配平),下列说法错误的是
 →AsO
→AsO +SO
+SO +NO↑+___________(未配平),下列说法错误的是
+NO↑+___________(未配平),下列说法错误的是| A.配平后H2O的化学计量数为4 |
| B.反应后溶液呈酸性 |
| C.配平后氧化剂与还原剂的化学计量数之比为3∶28 |
D.氧化产物为AsO 和SO 和SO |
您最近一年使用:0次
2023-08-17更新
|
730次组卷
|
2卷引用:湖南省株洲市第二中学2023-2024学年高一上学期第一次适应性检测化学试题
名校
解题方法
3 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
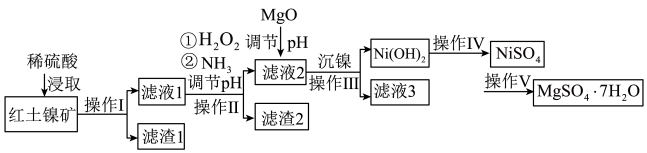
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;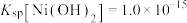 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;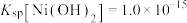 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1018次组卷
|
7卷引用:湖南省株洲市炎陵县2023-2024学年高二下学期开学化学试题
名校
4 . 过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在储存运输过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
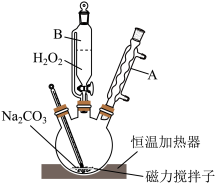
(1)装置中仪器B的名称为_______ ;仪器A的进水口为_______ (“上口”或“下口”)。
(2) 按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30% H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
(3)反应过程中要控制温度不能太高,原因是_______ 。
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是_______ 。
(5)过碳酸钠样品中H2O2含量的测定。
取b g 2Na2CO3∙3H2O2(M=314 g∙mol−1)配成100 mL溶液,取25.00 mL溶液于锥形瓶,加入足量稀硫酸,用0.04000 mol∙L−1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。(已知:5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)
①实验达到滴定终点的现象是_______ 。
②该过氧碳酸钠的产品纯度为_______ (用字母表示)。
③滴定时间过长,测得过碳酸钠产品纯度将_______ (填“偏高”、“偏低”或“无影响”)。

(1)装置中仪器B的名称为
(2) 按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30% H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
| A.FeCl3 | B.Na2SiO3 | C.MnO2 | D.Na2SO3 |
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是
(5)过碳酸钠样品中H2O2含量的测定。
取b g 2Na2CO3∙3H2O2(M=314 g∙mol−1)配成100 mL溶液,取25.00 mL溶液于锥形瓶,加入足量稀硫酸,用0.04000 mol∙L−1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。(已知:5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)
①实验达到滴定终点的现象是
②该过氧碳酸钠的产品纯度为
③滴定时间过长,测得过碳酸钠产品纯度将
您最近一年使用:0次
2022-09-14更新
|
682次组卷
|
5卷引用:湖南省株洲市攸县第四中学2022-2023学年高三上学期第三次月考化学试题
湖南省株洲市攸县第四中学2022-2023学年高三上学期第三次月考化学试题辽宁省六校2023届高三上学期开学考试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题(已下线)2022年辽宁高考真题化学试题变式题(实验综合题)
名校
解题方法
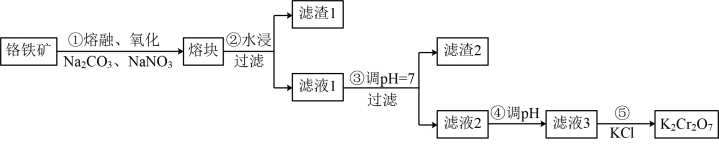
5 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为: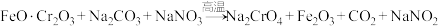
上述反应配平后 与
与 的系数比为
的系数比为___________ 。
(2)滤渣1中含量最多的金属元素是___________ ,滤渣2的主要成分是___________ 及含硅杂质。
(3)步骤④调滤液2的 使之变
使之变___________ (填“大”或“小”),原因是___________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。

向“滤液3”中加入适量 ,蒸发浓缩,冷却结晶,过滤得到
,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到
固体。冷却到___________ (填标号)得到的 固体产品最多。
固体产品最多。
a. 80℃ b. 60℃ c. 40℃ d. 10℃
 ,还含有硅、铝等杂质。制备流程如图所示:
,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:
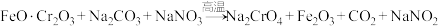
上述反应配平后
 与
与 的系数比为
的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的
 使之变
使之变(4)有关物质的溶解度如图所示。

向“滤液3”中加入适量
 ,蒸发浓缩,冷却结晶,过滤得到
,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到
固体。冷却到 固体产品最多。
固体产品最多。a. 80℃ b. 60℃ c. 40℃ d. 10℃
您最近一年使用:0次
2022-09-12更新
|
326次组卷
|
2卷引用:湖南省株洲市攸县第三中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
6 . 以铝土矿粉(主要含Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐);为原料生产Al2O3和Fe3O4的部分流程如下:

| A.“焙烧I”时,加入少量CaO可提高矿粉中硫的去除率 |
B.用NaOH溶液吸收过量SO2的离子方程式为: 2OH- +SO2=SO +H2O +H2O |
| C.滤液中通入足量CO2,过滤后可得到Al2O3 |
| D.无氧条件下进行“焙烧II”时,理论上消耗的n(FeS2):n(Fe2O3)=1:16 |
您最近一年使用:0次
2022-04-09更新
|
1198次组卷
|
11卷引用:湖南省株洲市第二中学2022届高三下学期期中考试化学试题
湖南省株洲市第二中学2022届高三下学期期中考试化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项05 氧化还原反应-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)山东省潍坊市2022届高三下学期5月模拟考试(一)化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题进阶训练7(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(不定项选择题)(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆和田地区第二中学2022-2023学年高一上学期11月期中考试化学试题(已下线)单项选择题1-5
名校
解题方法
7 . 按要求回答下列问题:
(1)3S+6KOH K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为
K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为_______ 。
(2)下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有_______ 。
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
(3)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:
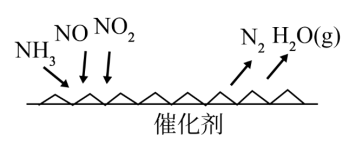
①该反应的还原剂为_______ 。
②写出烟气中NO2与足量氨气反应的化学方程式_______ 。
(4)“地康法”制取氯气的总反应方程式4HCl+O2=2H2O+2Cl2,其反应原理如图所示:
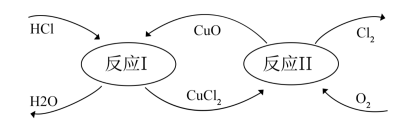
反应I:CuO+2HCl=CuCl2+H2O
反应Ⅱ:..
反应Ⅱ的化学方程式为_______ 。
(1)3S+6KOH
 K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为
K2SO3+2K2S+3H2O,被氧化的S和被还原的S质量比为(2)下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的方案有
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
(3)NH3催化还原氮氧化物可用于烟气中氮氧化物脱除,反应原理如图所示:

①该反应的还原剂为
②写出烟气中NO2与足量氨气反应的化学方程式
(4)“地康法”制取氯气的总反应方程式4HCl+O2=2H2O+2Cl2,其反应原理如图所示:

反应I:CuO+2HCl=CuCl2+H2O
反应Ⅱ:..
反应Ⅱ的化学方程式为
您最近一年使用:0次
2021-11-30更新
|
172次组卷
|
2卷引用:湖南省株洲市攸县第三中学2022-2023学年高一上学期期中考试化学试题
8 . 如图是某化学反应的微观示意图。下列有关说法正确的是


| A.该反应是复分解反应 |
B.反应方程式为NH3+O2 H2O+N2 H2O+N2 |
| C.生成物丙、丁的质量比为9:14 |
| D.反应前后只有一种元素的化合价不变 |
您最近一年使用:0次
2021-08-31更新
|
198次组卷
|
6卷引用:湖南省株洲市第二中学2023-2024学年高一上学期第二次适应性检测化学试题
名校
解题方法
9 . CuS、Cu2S用于处理酸性废水中的Cr2O 反应如下:
反应如下:
反应I: CuS+Cr2O +H+ →Cu2++SO
+H+ →Cu2++SO +Cr3++H2O(未配平)
+Cr3++H2O(未配平)
反应II:Cu2S+ Cr2O +H+→Cu2++SO
+H+→Cu2++SO +Cr3++H2O(未配平)
+Cr3++H2O(未配平)
下列说法正确的是
 反应如下:
反应如下:反应I: CuS+Cr2O
 +H+ →Cu2++SO
+H+ →Cu2++SO +Cr3++H2O(未配平)
+Cr3++H2O(未配平) 反应II:Cu2S+ Cr2O
 +H+→Cu2++SO
+H+→Cu2++SO +Cr3++H2O(未配平)
+Cr3++H2O(未配平)下列说法正确的是
| A.反应I和II中各有 2种元素的化合价发生变化 |
| B.反应II中还原剂与氧化剂的物质的量之比为3:5 |
C.处理1molCr2O 时反应I、II中消耗H+的物质的量相等 时反应I、II中消耗H+的物质的量相等 |
D.质量相同时,Cu2S能去除更多的Cr2O |
您最近一年使用:0次
2020-12-05更新
|
224次组卷
|
8卷引用:湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题
湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)【南昌新东方】4. 2020 高一上 南大附中 期中 项金辉安徽省六安市城南中学2021届高三上学期第二次月考化学试题四川省内江市威远中学2020-2021学年高一下学期期中考试化学试题河南省信阳市2021-2022学年高三上学期第一次教学质量检测化学试题(已下线)专题04 氧化还原反应及其应用(练)-2023年高考化学二轮复习讲练测(新高考专用)湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题





 )时的pH
)时的pH

