名校
1 . KBr可用于测定苯酚样品的纯度:取0.47g苯酚试样,用NaOH溶液溶解后配制成250mL溶液;取该溶液25.00mL,加入25.00mL 0.02mol/L的KBrO3(含过量KBr)标准溶液,然后加入适量盐酸,充分反应后再加足量KI溶液;用0.10mol/L Na2S2O3溶液滴定至淡黄色,加入指示剂,继续滴定至终点,用去Na2S2O3溶液6.00mL(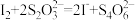 )。测定过程中物质的转化关系如下,下列说法正确的是
)。测定过程中物质的转化关系如下,下列说法正确的是
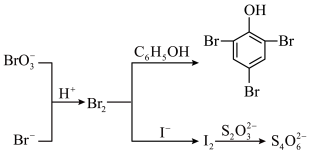
 )。测定过程中物质的转化关系如下,下列说法正确的是
)。测定过程中物质的转化关系如下,下列说法正确的是
| A.生成的Br2与苯酚发生加成反应,生成白色沉淀 |
| B.Na2S2O3在酸性条件下不稳定,因此滴定时需要在强碱性条件下进行 |
C.KBrO3和KBr在盐酸溶液中发生的反应为: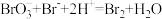 |
| D.滴定时可以选择淀粉为指示剂,滴定终点的现象为滴入最后半滴Na2S2O3溶液时,溶液恰好蓝色褪去,且30秒不变化 |
您最近半年使用:0次
2023-08-29更新
|
110次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
2 . 铬酸钠( )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(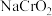 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为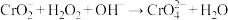 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是
 )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(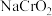 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为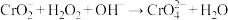 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是| A.反应物中Cr元素的化合价为+4 |
B. 是还原剂 是还原剂 |
| C.该反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.生成2mol水分子时,转移3mol电子 |
您最近半年使用:0次
2023-08-20更新
|
353次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
3 . 海水中溴元素主要以 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
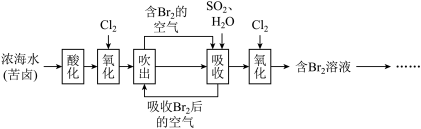
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:___________ ,此反应中SO2做___________ (填氧化剂或还原剂)。
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+_______________
当有3molBr2参加反应,发生转移的电子的物质的量为___________ 。
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

①反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是___________ ;2min时,反应是否达到化学平衡状态___________ (填“是”或“否”)。
②关于该反应下列说法不正确的是___________ 。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+________
当有3molBr2参加反应,发生转移的电子的物质的量为
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

①反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是
②关于该反应下列说法不正确的是
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
您最近半年使用:0次
2023-07-20更新
|
88次组卷
|
3卷引用:湖南省张家界市2022-2023学年高一下学期期末考试化学试题
名校
解题方法
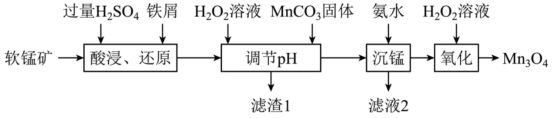
4 .  可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
 时,相关金属离子
时,相关金属离子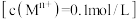 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有___________ (任写一种即可)。“酸浸、还原”后溶液中含有的金属阳离子主要有___________ (填离子符号),铁屑与 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“调节 ”时,加入
”时,加入 溶液的目的是
溶液的目的是___________ ,“调节 ”的范围为
”的范围为___________ 。
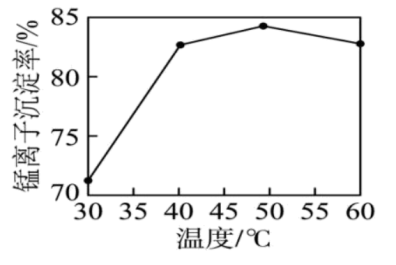
(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。 后,溶液温度越高,锰离子的沉淀率越低,原因是
后,溶液温度越高,锰离子的沉淀率越低,原因是___________ 。
(4) 时,
时, ,
, 沉淀完全,则
沉淀完全,则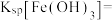
___________ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
 时,相关金属离子
时,相关金属离子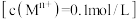 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 3.4 | 8.1 |
沉淀完全的 | 2.8 | 8.3 | 4.7 | 10.1 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“调节
 ”时,加入
”时,加入 溶液的目的是
溶液的目的是 ”的范围为
”的范围为(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。
 后,溶液温度越高,锰离子的沉淀率越低,原因是
后,溶液温度越高,锰离子的沉淀率越低,原因是
(4)
 时,
时, ,
, 沉淀完全,则
沉淀完全,则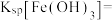
您最近半年使用:0次
2023-05-08更新
|
277次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
5 . Na2FeO4具有强氧化性,是一种新型的绿色非氯净水消毒剂,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3。可用Fe(OH)3与NaClO在强碱性条件下制取,某实验小组利用如图所示实验装置,制取Na2FeO4,并验证其处理含CN-废水的能力。

Ⅰ.制取Na2FeO4
(1)仪器D的名称为_____ 。洗气瓶B中盛有的试剂为_____ 。实验开始,先打开分液漏斗_____ (填“A”或“C”)的活塞。
(2)写出大试管中发生反应的离子方程式:_____ 。
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、______ 。
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO 和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有______ (填序号,下同)。

②计算NaCN溶液中CN-的去除率为______ (保留两位有效数字)。

Ⅰ.制取Na2FeO4
(1)仪器D的名称为
(2)写出大试管中发生反应的离子方程式:
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO
 和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有

②计算NaCN溶液中CN-的去除率为
您最近半年使用:0次
2023-03-15更新
|
580次组卷
|
4卷引用:湖南省张家界市2023届高三下学期模拟考试化学试题
解题方法
6 . 二氧化氯(ClO2)是一种高效消毒灭菌剂,可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
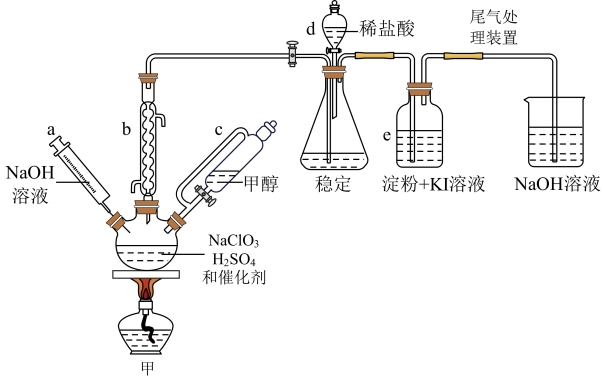
已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I−+8H+=2Cl−+5I2+4H2O
③有关物质沸点如下表;
请回答:
(1)仪器b的名称是_______ ;比较仪器c和d,实验中c的优点是:_______ 。
(2)根据反应条件判断制备装置甲中需改进的一项措施是_______ 。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:_______ 。该制备法可选用不同的还原性物质作为还原剂,例如草酸(草酸的氧化产物为CO2),相比甲醇法,草酸法的优点是_______ 。
(4)下列有关说法正确的是_______。
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加到锥形瓶,再加3mL稀 ;
;
Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用a mol∙L−1的 标准溶液滴定(
标准溶液滴定( ),共用去bmLNa2S2O3溶液:实验测得所通入的ClO2的质量为
),共用去bmLNa2S2O3溶液:实验测得所通入的ClO2的质量为_______ g。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I−+8H+=2Cl−+5I2+4H2O
③有关物质沸点如下表;
| 物质 | CH3OH | HCOOH | ClO2 |
| 沸点 | 64.7℃ | 100.8℃ | 11℃ |
(1)仪器b的名称是
(2)根据反应条件判断制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:
(4)下列有关说法正确的是_______。
| A.装置e主要用于检验是否有Cl2生成 |
B.在ClO2释放实验中,发生的离子反应方程式是:4H++5 =Cl-+4ClO2↑+2H2O =Cl-+4ClO2↑+2H2O |
| C.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2 |
| D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍 |
Ⅰ.将足量KI用100mL水溶解后加到锥形瓶,再加3mL稀
 ;
;Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用a mol∙L−1的
 标准溶液滴定(
标准溶液滴定( ),共用去bmLNa2S2O3溶液:实验测得所通入的ClO2的质量为
),共用去bmLNa2S2O3溶液:实验测得所通入的ClO2的质量为
您最近半年使用:0次
名校
解题方法
7 . 在有机碳源和微生物作用下,大气中氮可以实现平衡循环,过程如图所示。下列说法正确的是
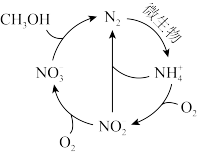
| A.图示所有含氮微粒中N的化合价只有0、+3、+5 |
B.循环转化过程中NO 被甲醇氧化为N2 被甲醇氧化为N2 |
C.温度越高,N2转化成NH 的速率越快 的速率越快 |
D.NH 与NO 与NO 反应的离子方程式为:NH 反应的离子方程式为:NH +NO +NO =N2↑+2H2O =N2↑+2H2O |
您最近半年使用:0次
2022-04-22更新
|
617次组卷
|
5卷引用:湖南省张家界市2022-2023学年高一下学期期末考试化学试题
湖南省张家界市2022-2023学年高一下学期期末考试化学试题江苏省宿迁市泗阳县2021-2022学年高一下学期期中调研化学试题(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题江苏省扬州市邗江区第一中学2023-2024学年高一下学期3月考试化学试题
名校
8 . 由重晶石矿(主要成分是BaSO4,还含有SiO2等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
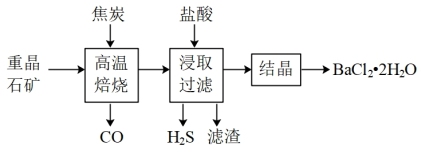
下列说法正确的是

下列说法正确的是
| A.为提高原料的利用率,“高温焙烧”前原料需经研磨处理 |
| B.“高温焙烧”和“结晶”两处操作均需用到蒸发皿 |
| C.在“高温焙烧”焦炭和BaSO4的反应中,氧化剂与还原剂的物质的量之比为4:1 |
| D.因盐酸具有挥发性,上述流程中须用硫酸代替盐酸进行浸取 |
您最近半年使用:0次
2022-01-11更新
|
599次组卷
|
8卷引用:湖南省张家界市慈利县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省张家界市慈利县第一中学2021-2022学年高三下学期期中考试化学试题江苏省南京市、盐城市2021-2022学年高三第一次模拟考试化学试题江苏省南京市第一中学2021-2022学年高二下学期期中考试化学试题(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)江苏省南通市通州区金沙中学2021-2022学年高二下学期第一次调研考试化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题6-10)(已下线)题型26 碱土金属元素及其化合物江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
9 . 某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如图:(已知乳酸酸性强于碳酸)
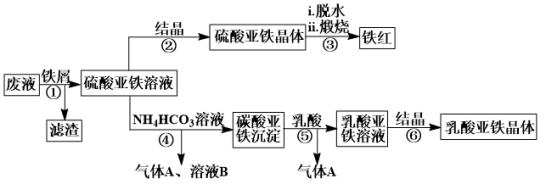
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO ;
;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为___ ,分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___ ;步骤②中得到纯净硫酸亚铁晶体的操作为蒸发浓缩、___ 、___ 。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为___ 。
(3)步骤④的离子方程式是___ 。
(4)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000mol•L-1KMnO4溶液25.00mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)__ 。

已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO
 ;
;②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(3)步骤④的离子方程式是
(4)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000mol•L-1KMnO4溶液25.00mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)
您最近半年使用:0次
2021-09-07更新
|
259次组卷
|
2卷引用:湖南省张家界市第一中学2022届高三下学期期中考试化学试题
名校
解题方法
10 . 2020年8月初,黎巴嫩首都贝鲁特港口发生大规模爆炸,该爆炸是由于储存在仓库的2750吨硝酸铵引起的。已知爆炸时硝酸铵按下式分解: 4NH4NO3=3N2↑+2NO2↑+8H2O↑, 则该反应中被氧化和被还原的N原子数之比为
| A.1:1 | B.1:2 | C.1:3 | D.3:1 |
您最近半年使用:0次
2020-12-16更新
|
471次组卷
|
21卷引用:湖南省张家界市民族中学2020-2021学年高一10月月考化学试题
湖南省张家界市民族中学2020-2021学年高一10月月考化学试题吉林省白城市大安一中2020-2021学年高一上学期第一次月考化学试题福建省莆田第二十五中学2021届高三上学期月考二化学试题(已下线)【新东方】【2020】【高一上】【第一次月考】【YDC】【化学】湖南省邵东县第一中学2020-2021学年高一上学期第一次月考化学试题辽宁省大连市育明高级中学2020-2021学年高一上学期月考化学试题(已下线)【浙江新东方】25安徽师范大学附属中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP425】【化学】.(已下线)【浙江新东方】67.(已下线)【浙江新东方】78福建省福州市八县(市)协作校2021届高三上学期期中考试化学试题河南省鹤壁市高级中学2020-2021学年高一上学期第三次段考化学试题江苏省海安高级中学2020~2021学年高一上学期阶段检测(一)化学试题山东省嘉祥县第一中学2020-2021学年高一上学期10月月考化学试题安徽省池州市江南教育集团2021届高三上学期1月月考化学试题湖南省长沙市雅礼中学2021-2022学牟高二下学期入学考试化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一上学期第一次月考化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高一上学期9月月考化学试题甘肃省张掖市2022-2023学年高一上学期适应性模拟考试化学试题浙江省杭州学军中学海创园学校2023-2024学年高一上学期期中考试化学试题



