名校
1 . KBr可用于测定苯酚样品的纯度:取0.47g苯酚试样,用NaOH溶液溶解后配制成250mL溶液;取该溶液25.00mL,加入25.00mL 0.02mol/L的KBrO3(含过量KBr)标准溶液,然后加入适量盐酸,充分反应后再加足量KI溶液;用0.10mol/L Na2S2O3溶液滴定至淡黄色,加入指示剂,继续滴定至终点,用去Na2S2O3溶液6.00mL(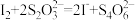 )。测定过程中物质的转化关系如下,下列说法正确的是
)。测定过程中物质的转化关系如下,下列说法正确的是
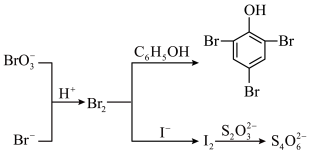
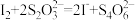 )。测定过程中物质的转化关系如下,下列说法正确的是
)。测定过程中物质的转化关系如下,下列说法正确的是
| A.生成的Br2与苯酚发生加成反应,生成白色沉淀 |
| B.Na2S2O3在酸性条件下不稳定,因此滴定时需要在强碱性条件下进行 |
C.KBrO3和KBr在盐酸溶液中发生的反应为: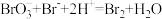 |
| D.滴定时可以选择淀粉为指示剂,滴定终点的现象为滴入最后半滴Na2S2O3溶液时,溶液恰好蓝色褪去,且30秒不变化 |
您最近一年使用:0次
2023-08-29更新
|
112次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
2 . 铬酸钠( )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(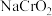 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为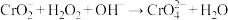 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是
 )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(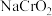 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为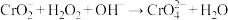 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是| A.反应物中Cr元素的化合价为+4 |
B. 是还原剂 是还原剂 |
| C.该反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.生成2mol水分子时,转移3mol电子 |
您最近一年使用:0次
2023-08-20更新
|
362次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
3 . 海水中溴元素主要以 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
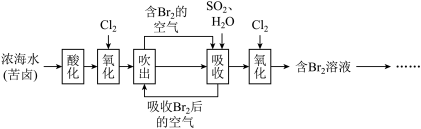
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:___________ ,此反应中SO2做___________ (填氧化剂或还原剂)。
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+_______________
当有3molBr2参加反应,发生转移的电子的物质的量为___________ 。
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

①反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是___________ ;2min时,反应是否达到化学平衡状态___________ (填“是”或“否”)。
②关于该反应下列说法不正确的是___________ 。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
(1)将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:
(2)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,完成下列化学方程式:
_______Br2+_______Na2CO3——______NaBrO3+_______CO2+________
当有3molBr2参加反应,发生转移的电子的物质的量为
(3)用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2。现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。

①反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是
②关于该反应下列说法不正确的是
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
您最近一年使用:0次
2023-07-20更新
|
98次组卷
|
3卷引用:湖南省张家界市2022-2023学年高一下学期期末考试化学试题
名校
解题方法
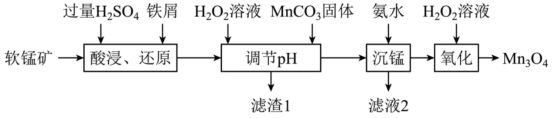
4 .  可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
 时,相关金属离子
时,相关金属离子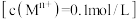 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
(1)“酸浸、还原”时,为了加快化学反应速率,可以采取的措施有___________ (任写一种即可)。“酸浸、还原”后溶液中含有的金属阳离子主要有___________ (填离子符号),铁屑与 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“调节 ”时,加入
”时,加入 溶液的目的是
溶液的目的是___________ ,“调节 ”的范围为
”的范围为___________ 。
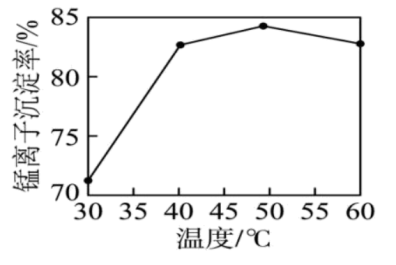
(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。 后,溶液温度越高,锰离子的沉淀率越低,原因是
后,溶液温度越高,锰离子的沉淀率越低,原因是___________ 。
(4) 时,
时, ,
, 沉淀完全,则
沉淀完全,则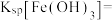
___________ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
 时,相关金属离子
时,相关金属离子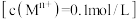 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 3.4 | 8.1 |
沉淀完全的 | 2.8 | 8.3 | 4.7 | 10.1 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“调节
 ”时,加入
”时,加入 溶液的目的是
溶液的目的是 ”的范围为
”的范围为(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。
 后,溶液温度越高,锰离子的沉淀率越低,原因是
后,溶液温度越高,锰离子的沉淀率越低,原因是
(4)
 时,
时, ,
, 沉淀完全,则
沉淀完全,则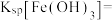
您最近一年使用:0次
2023-05-08更新
|
278次组卷
|
2卷引用:湖南省张家界市慈利县第一中学2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
5 . Na2FeO4具有强氧化性,是一种新型的绿色非氯净水消毒剂,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3。可用Fe(OH)3与NaClO在强碱性条件下制取,某实验小组利用如图所示实验装置,制取Na2FeO4,并验证其处理含CN-废水的能力。

Ⅰ.制取Na2FeO4
(1)仪器D的名称为_____ 。洗气瓶B中盛有的试剂为_____ 。实验开始,先打开分液漏斗_____ (填“A”或“C”)的活塞。
(2)写出大试管中发生反应的离子方程式:_____ 。
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、______ 。
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO 和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有______ (填序号,下同)。

②计算NaCN溶液中CN-的去除率为______ (保留两位有效数字)。

Ⅰ.制取Na2FeO4
(1)仪器D的名称为
(2)写出大试管中发生反应的离子方程式:
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO
 和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有

②计算NaCN溶液中CN-的去除率为
您最近一年使用:0次
2023-03-15更新
|
582次组卷
|
4卷引用:湖南省张家界市2023届高三下学期模拟考试化学试题
名校
6 . 由重晶石矿(主要成分是BaSO4,还含有SiO2等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
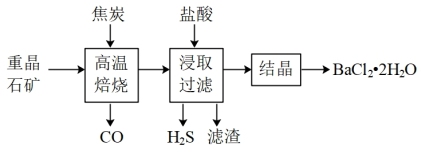
下列说法正确的是

下列说法正确的是
| A.为提高原料的利用率,“高温焙烧”前原料需经研磨处理 |
| B.“高温焙烧”和“结晶”两处操作均需用到蒸发皿 |
| C.在“高温焙烧”焦炭和BaSO4的反应中,氧化剂与还原剂的物质的量之比为4:1 |
| D.因盐酸具有挥发性,上述流程中须用硫酸代替盐酸进行浸取 |
您最近一年使用:0次
2022-01-11更新
|
607次组卷
|
8卷引用:湖南省张家界市慈利县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省张家界市慈利县第一中学2021-2022学年高三下学期期中考试化学试题江苏省南京市、盐城市2021-2022学年高三第一次模拟考试化学试题江苏省南京市第一中学2021-2022学年高二下学期期中考试化学试题(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)江苏省南通市通州区金沙中学2021-2022学年高二下学期第一次调研考试化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(选择题6-10)(已下线)题型26 碱土金属元素及其化合物江苏省南通市海安市实验中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
7 . 2020年8月初,黎巴嫩首都贝鲁特港口发生大规模爆炸,该爆炸是由于储存在仓库的2750吨硝酸铵引起的。已知爆炸时硝酸铵按下式分解: 4NH4NO3=3N2↑+2NO2↑+8H2O↑, 则该反应中被氧化和被还原的N原子数之比为
| A.1:1 | B.1:2 | C.1:3 | D.3:1 |
您最近一年使用:0次
2020-12-16更新
|
472次组卷
|
21卷引用:湖南省张家界市民族中学2020-2021学年高一10月月考化学试题
湖南省张家界市民族中学2020-2021学年高一10月月考化学试题吉林省白城市大安一中2020-2021学年高一上学期第一次月考化学试题福建省莆田第二十五中学2021届高三上学期月考二化学试题(已下线)【新东方】【2020】【高一上】【第一次月考】【YDC】【化学】湖南省邵东县第一中学2020-2021学年高一上学期第一次月考化学试题辽宁省大连市育明高级中学2020-2021学年高一上学期月考化学试题(已下线)【浙江新东方】25安徽师范大学附属中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP425】【化学】.(已下线)【浙江新东方】67.(已下线)【浙江新东方】78福建省福州市八县(市)协作校2021届高三上学期期中考试化学试题河南省鹤壁市高级中学2020-2021学年高一上学期第三次段考化学试题江苏省海安高级中学2020~2021学年高一上学期阶段检测(一)化学试题山东省嘉祥县第一中学2020-2021学年高一上学期10月月考化学试题安徽省池州市江南教育集团2021届高三上学期1月月考化学试题湖南省长沙市雅礼中学2021-2022学牟高二下学期入学考试化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一上学期第一次月考化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高一上学期9月月考化学试题甘肃省张掖市2022-2023学年高一上学期适应性模拟考试化学试题浙江省杭州学军中学海创园学校2023-2024学年高一上学期期中考试化学试题



