解题方法
1 . 按要求写出或完成下列方程式。(共15分)
(1)HNO3的电离方程式:___________ 。
(2)Na2CO3的电离方程式:___________ 。
(3)Zn与HCl反应的离子方程式:___________ 。
(4)HCl和NaOH反应的离子方程式:___________ 。
(5)将下列方程式配平:___________ 。
_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑
(1)HNO3的电离方程式:
(2)Na2CO3的电离方程式:
(3)Zn与HCl反应的离子方程式:
(4)HCl和NaOH反应的离子方程式:
(5)将下列方程式配平:
_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑
您最近一年使用:0次
2 . 从某废液(含有Fe3+、Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得的纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
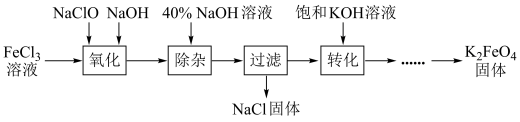
已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是_________ 和_________ 。
(2)检验废液中含有Fe2+选用的试剂是__________ (填化学式)。
(3)“氧化”过程反应的离子方程式为__________ 。
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用______ 溶解,然后______ ,过滤。
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
已知溶液中的某离子浓度小于1×10-5 mol/L时就认为该离子沉淀完全。加双氧水的目的是_________ ;若溶液中CuSO4的浓度为3.0mol/L,通过计算说明此方法可除去粗CuSO4·5H2O晶体中FeSO4·7H2O的理由:___________ 。

已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是
(2)检验废液中含有Fe2+选用的试剂是
(3)“氧化”过程反应的离子方程式为
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 3×10-20 |
您最近一年使用:0次
名校
解题方法
3 . 钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:

已知: 与C、
与C、 在600℃的沸腾炉中充分反应后,尾气中每产生
在600℃的沸腾炉中充分反应后,尾气中每产生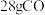 同时生成
同时生成 。
。
(1)尾气中CO与 的物质的量之比为
的物质的量之比为___________ ;氯化过程中氧化剂是___________ (填化学式)。
(2)该温度下, 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为___________ 。
(3)随着温度升高,尾气中CO的含量升高,原因是___________ 。
(4)写出流程中加入Mg冶炼Ti的化学方程式___________ ,该过程要在氩气(Ar)气体氛围中进行的理由是___________ 。
 ,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
已知:
 与C、
与C、 在600℃的沸腾炉中充分反应后,尾气中每产生
在600℃的沸腾炉中充分反应后,尾气中每产生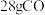 同时生成
同时生成 。
。(1)尾气中CO与
 的物质的量之比为
的物质的量之比为(2)该温度下,
 与C、
与C、 反应的总化学方程式为
反应的总化学方程式为(3)随着温度升高,尾气中CO的含量升高,原因是
(4)写出流程中加入Mg冶炼Ti的化学方程式
您最近一年使用:0次
2023-12-24更新
|
358次组卷
|
3卷引用:湖南省郴州市“十校联盟”2023-2024学年高一上学期期末模拟考试化学试题
名校
4 . 引火铁是一种活性很强的铁粉,一般用于焊接铁轨等。某课外活动小组利用图1装置将普通铁粉在酒精喷灯加热条件下与水蒸气反应得到 和
和 ,再利用图2装置将制得的
,再利用图2装置将制得的 与
与 反应制备颗粒很细、活性很强的引火铁(加热及夹持装置省略)。
反应制备颗粒很细、活性很强的引火铁(加热及夹持装置省略)。

回答下列问题:
(1)图1中玻璃仪器a的名称是_______ 。实验时将普通铁粉装入试管A中的具体操作是_______ 。
(2)试管A中发生反应的化学方程式为_______ ,其中发生还原反应的物质的化学式是_______ ,当有 生成时,发生氧化反应的物质的质量是
生成时,发生氧化反应的物质的质量是_______ 。
(3)图2中,从仪器Ⅰ中加入稀硫酸,在装置H中发生反应,排出装置E中的空气,再用酒精灯加热E,在点燃酒精灯之前需要进行的操作是_______ 。装置E、H中发生反应的反应类型有_______ (填序号)。
①复分解反应 ②氧化还原反应 ③置换反应 ④非氧化还原反应
其中装置H中发生反应的离子方程式是_______ 。
 和
和 ,再利用图2装置将制得的
,再利用图2装置将制得的 与
与 反应制备颗粒很细、活性很强的引火铁(加热及夹持装置省略)。
反应制备颗粒很细、活性很强的引火铁(加热及夹持装置省略)。
回答下列问题:
(1)图1中玻璃仪器a的名称是
(2)试管A中发生反应的化学方程式为
 生成时,发生氧化反应的物质的质量是
生成时,发生氧化反应的物质的质量是(3)图2中,从仪器Ⅰ中加入稀硫酸,在装置H中发生反应,排出装置E中的空气,再用酒精灯加热E,在点燃酒精灯之前需要进行的操作是
①复分解反应 ②氧化还原反应 ③置换反应 ④非氧化还原反应
其中装置H中发生反应的离子方程式是
您最近一年使用:0次
名校
5 . 对物质进行分类是研究物质性质的重要方法。现有如下几种物质:①氢气 ②氧气 ③氧化铜 ④稀盐酸 ⑤氯酸钾 ⑥烧碱 ⑦二氧化锰 ⑧氯化银 ⑨氢氧化铁胶体。回答下列问题:
(1)属于混合物的是_______ (填序号,下同),属于盐的是_______ 。
(2)相互间能发生化合反应的组合是_______ ,相互间能发生复分解反应的组合是_______ 。
(3)⑤在⑦存在下加热时发生反应的化学方程式为_______ ,⑦的作用是_______ 。
(4)⑤易溶于水,其在水溶液中的电离方程式为_______ 。
(5)按照交叉分类法判断,③⑦⑧属于同一类物质的标准是_______ (填字母)。
A.氧化物 B.黑色物质 C.难溶于水的化合物
(1)属于混合物的是
(2)相互间能发生化合反应的组合是
(3)⑤在⑦存在下加热时发生反应的化学方程式为
(4)⑤易溶于水,其在水溶液中的电离方程式为
(5)按照交叉分类法判断,③⑦⑧属于同一类物质的标准是
A.氧化物 B.黑色物质 C.难溶于水的化合物
您最近一年使用:0次
名校
6 . NiFe基催化剂是碱性条件下活性最高的催化剂之一,在NiFe基催化剂自修复水氧化循环中, 发生的一步反应为
发生的一步反应为 (未配平),下列说法正确的是
(未配平),下列说法正确的是
 发生的一步反应为
发生的一步反应为 (未配平),下列说法正确的是
(未配平),下列说法正确的是A. 中铁元素化合价的绝对值与基态铁原子的价电子数相等 中铁元素化合价的绝对值与基态铁原子的价电子数相等 |
| B.反应中FeOOH是氧化产物 |
C.生成22.4L 时,转移4mol电子 时,转移4mol电子 |
D.配平后, 与 与 的化学计量数之比为2∶3 的化学计量数之比为2∶3 |
您最近一年使用:0次
2023-05-27更新
|
218次组卷
|
4卷引用:湖南省郴州市九校联盟2023届高三适应考试化学试卷题
解题方法
7 .  是一种广谱型消毒剂,将逐渐代替氯气用于饮用水的消毒。如图是实验室制取纯净
是一种广谱型消毒剂,将逐渐代替氯气用于饮用水的消毒。如图是实验室制取纯净 并进一步制取、收集
并进一步制取、收集 的装置(夹持装置省略)。
的装置(夹持装置省略)。
已知: 是黄绿色、有刺激性气味的气体,熔点为―59℃,沸点为11℃:
是黄绿色、有刺激性气味的气体,熔点为―59℃,沸点为11℃: 的熔点为―101℃,沸点为―34℃。
的熔点为―101℃,沸点为―34℃。

I. 的制取
的制取
(1)写出装置A中烧瓶内发生反应的化学方程式:______ 。
(2)C装置所盛试剂是______ 。
Ⅱ. 的制取
的制取
(3)装置D用于 制取,请写出D中发生反应的化学方程式
制取,请写出D中发生反应的化学方程式______ 。
(4)连续两次冰水浴的目的是______ 。
Ⅲ. 的应用
的应用
(5)自来水厂用 处理后的水中,要求
处理后的水中,要求 的浓度为0.10~0.80
的浓度为0.10~0.80 。水质检验员用碘量法测定水中
。水质检验员用碘量法测定水中 的浓度发生如下反应:
的浓度发生如下反应:
① ②
②
若水样的体积为1.0L,共消耗了 的
的 8.0mL,则水样中
8.0mL,则水样中 的浓度为
的浓度为______  。
。
 是一种广谱型消毒剂,将逐渐代替氯气用于饮用水的消毒。如图是实验室制取纯净
是一种广谱型消毒剂,将逐渐代替氯气用于饮用水的消毒。如图是实验室制取纯净 并进一步制取、收集
并进一步制取、收集 的装置(夹持装置省略)。
的装置(夹持装置省略)。已知:
 是黄绿色、有刺激性气味的气体,熔点为―59℃,沸点为11℃:
是黄绿色、有刺激性气味的气体,熔点为―59℃,沸点为11℃: 的熔点为―101℃,沸点为―34℃。
的熔点为―101℃,沸点为―34℃。
I.
 的制取
的制取(1)写出装置A中烧瓶内发生反应的化学方程式:
(2)C装置所盛试剂是
Ⅱ.
 的制取
的制取(3)装置D用于
 制取,请写出D中发生反应的化学方程式
制取,请写出D中发生反应的化学方程式(4)连续两次冰水浴的目的是
Ⅲ.
 的应用
的应用(5)自来水厂用
 处理后的水中,要求
处理后的水中,要求 的浓度为0.10~0.80
的浓度为0.10~0.80 。水质检验员用碘量法测定水中
。水质检验员用碘量法测定水中 的浓度发生如下反应:
的浓度发生如下反应:①
 ②
②
若水样的体积为1.0L,共消耗了
 的
的 8.0mL,则水样中
8.0mL,则水样中 的浓度为
的浓度为 。
。
您最近一年使用:0次
8 . 二氧化氯是一种高效消毒灭菌剂,但其稳定性较差,故常采用 和
和 混合溶液将其吸收转化为
混合溶液将其吸收转化为 保存。现利用如下装置及试剂制备
保存。现利用如下装置及试剂制备 。
。
已知:①纯的或浓度较大的 易分解爆炸;
易分解爆炸; 极易溶于水,与
极易溶于水,与 碱性条件下会剧烈反应并放出大量的热。
碱性条件下会剧烈反应并放出大量的热。
② 饱和溶液在温度低于38℃时析出的晶体是
饱和溶液在温度低于38℃时析出的晶体是 ,高于38℃时析出的晶体是
,高于38℃时析出的晶体是 ,高于60℃时
,高于60℃时 分解成
分解成 和
和 。
。

回答下列问题:
(1)装置A中 的作用是
的作用是___________ 。
(2)装置A中发生反应的化学方程式为___________ ,上述装置存在一处缺陷,会导致 产率降低,改进的方法是
产率降低,改进的方法是___________ 。
(3)实验过程中持续通入 的速度不能太慢也不能太快的原因是
的速度不能太慢也不能太快的原因是___________ 。
(4)从 溶液中获得
溶液中获得 固体,完成下列操作:①减压,55℃蒸发结晶;②趁热过滤;③无水乙醇洗涤;④
固体,完成下列操作:①减压,55℃蒸发结晶;②趁热过滤;③无水乙醇洗涤;④___________ ,得到成品。
(5) 纯度的测定:用“间接碘量法”测定样品(杂质不发生反应)的纯度,过程如下:取样品
纯度的测定:用“间接碘量法”测定样品(杂质不发生反应)的纯度,过程如下:取样品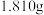 配制成
配制成 溶液,从中取出
溶液,从中取出 ;加入足量
;加入足量 固体和适量稀
固体和适量稀 ,再滴加几滴淀粉溶液(已知:
,再滴加几滴淀粉溶液(已知: ),然后用
),然后用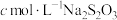 标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为
标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为 (已知:
(已知: 。样品中
。样品中 的纯度为
的纯度为___________ %(用含c、V的代数式表示)。下列滴定操作会导致测量结果偏低的是___________ (填字母)。
a、锥形瓶洗涤后没有干燥 b、滴定时锥形瓶中有液体溅出
c、滴定终点时仰视读数 d、滴定管滴定前没有气泡,滴定后尖嘴处出现气泡
(6)目前已开发出用电解法制取 的新工艺如图所示:
的新工艺如图所示:

①图中用石墨做电极,在一定条件下电解饱和食盐水制取 。产生
。产生 的电极反应式为
的电极反应式为___________ 。
②b极区
___________ (填“增大”“减小”或“不变”)
 和
和 混合溶液将其吸收转化为
混合溶液将其吸收转化为 保存。现利用如下装置及试剂制备
保存。现利用如下装置及试剂制备 。
。已知:①纯的或浓度较大的
 易分解爆炸;
易分解爆炸; 极易溶于水,与
极易溶于水,与 碱性条件下会剧烈反应并放出大量的热。
碱性条件下会剧烈反应并放出大量的热。②
 饱和溶液在温度低于38℃时析出的晶体是
饱和溶液在温度低于38℃时析出的晶体是 ,高于38℃时析出的晶体是
,高于38℃时析出的晶体是 ,高于60℃时
,高于60℃时 分解成
分解成 和
和 。
。
回答下列问题:
(1)装置A中
 的作用是
的作用是(2)装置A中发生反应的化学方程式为
 产率降低,改进的方法是
产率降低,改进的方法是(3)实验过程中持续通入
 的速度不能太慢也不能太快的原因是
的速度不能太慢也不能太快的原因是(4)从
 溶液中获得
溶液中获得 固体,完成下列操作:①减压,55℃蒸发结晶;②趁热过滤;③无水乙醇洗涤;④
固体,完成下列操作:①减压,55℃蒸发结晶;②趁热过滤;③无水乙醇洗涤;④(5)
 纯度的测定:用“间接碘量法”测定样品(杂质不发生反应)的纯度,过程如下:取样品
纯度的测定:用“间接碘量法”测定样品(杂质不发生反应)的纯度,过程如下:取样品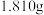 配制成
配制成 溶液,从中取出
溶液,从中取出 ;加入足量
;加入足量 固体和适量稀
固体和适量稀 ,再滴加几滴淀粉溶液(已知:
,再滴加几滴淀粉溶液(已知: ),然后用
),然后用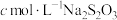 标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为
标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为 (已知:
(已知: 。样品中
。样品中 的纯度为
的纯度为a、锥形瓶洗涤后没有干燥 b、滴定时锥形瓶中有液体溅出
c、滴定终点时仰视读数 d、滴定管滴定前没有气泡,滴定后尖嘴处出现气泡
(6)目前已开发出用电解法制取
 的新工艺如图所示:
的新工艺如图所示:
①图中用石墨做电极,在一定条件下电解饱和食盐水制取
 。产生
。产生 的电极反应式为
的电极反应式为②b极区

您最近一年使用:0次
9 . 合质金,也称矿产金,大多与其他金属伴生,由于产于不同的矿山而所含的其他金属成分不同,一般金含量在50%~90%之间。以高银合质金作为原料(含有 、
、 、
、 、
、 等单质及
等单质及 、
、 的化合物)快速提取金和银的工艺流程如图所示:
的化合物)快速提取金和银的工艺流程如图所示:
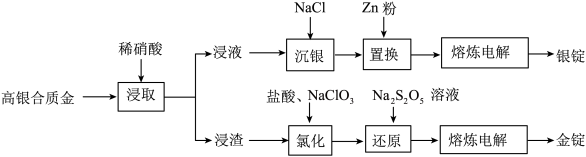
回答下列问题:
(1)“浸取”时,单质 溶解的化学方程式为
溶解的化学方程式为___________ 。
(2)已知:25℃时, 。实验测得,沉银前浸液中
。实验测得,沉银前浸液中 ,现取
,现取 浸液,加入
浸液,加入 溶液沉银,忽略溶液的体积变化,完全沉银后,溶液中
溶液沉银,忽略溶液的体积变化,完全沉银后,溶液中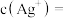
___________ ,若继续加入 溶液,是否有白色沉淀生成:
溶液,是否有白色沉淀生成:___________ (填“是”或“否”)。
(3)氯化工艺中盐酸和 接触会产生氯自由基
接触会产生氯自由基 ,
, 具有强氧化性,能与
具有强氧化性,能与 反应生成
反应生成 ,写出产生氯自由基
,写出产生氯自由基 的离子方程式:
的离子方程式:___________ 。
(4)还原时,在50~60℃下滴加还原剂 溶液,主要发生反应的化学方程式:
溶液,主要发生反应的化学方程式:
①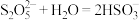
②___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
请完成反应②离子方程式___________ ;当转移 电子时,生成还原产物的质量为
电子时,生成还原产物的质量为___________ g。
 、
、 、
、 、
、 等单质及
等单质及 、
、 的化合物)快速提取金和银的工艺流程如图所示:
的化合物)快速提取金和银的工艺流程如图所示:
回答下列问题:
(1)“浸取”时,单质
 溶解的化学方程式为
溶解的化学方程式为(2)已知:25℃时,
 。实验测得,沉银前浸液中
。实验测得,沉银前浸液中 ,现取
,现取 浸液,加入
浸液,加入 溶液沉银,忽略溶液的体积变化,完全沉银后,溶液中
溶液沉银,忽略溶液的体积变化,完全沉银后,溶液中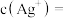
 溶液,是否有白色沉淀生成:
溶液,是否有白色沉淀生成:(3)氯化工艺中盐酸和
 接触会产生氯自由基
接触会产生氯自由基 ,
, 具有强氧化性,能与
具有强氧化性,能与 反应生成
反应生成 ,写出产生氯自由基
,写出产生氯自由基 的离子方程式:
的离子方程式:(4)还原时,在50~60℃下滴加还原剂
 溶液,主要发生反应的化学方程式:
溶液,主要发生反应的化学方程式:①
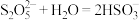
②___________
 ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
请完成反应②离子方程式
 电子时,生成还原产物的质量为
电子时,生成还原产物的质量为
您最近一年使用:0次
名校
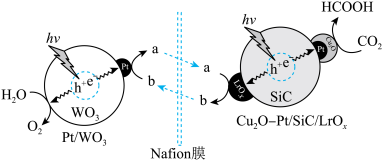
10 . 我国科研人员通过控制光沉积的方法构建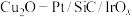 型复合材料光催化剂,其中
型复合材料光催化剂,其中 和
和 渗透Nafion膜可协同
渗透Nafion膜可协同 、
、 分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是
分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是
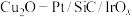 型复合材料光催化剂,其中
型复合材料光催化剂,其中 和
和 渗透Nafion膜可协同
渗透Nafion膜可协同 、
、 分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是
分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是
A.图中a、b分别代表 、 、 |
| B.反应过程中光能全部转化为化学能 |
C.总反应方程式为 |
| D.反应过程中涉及到非极性键、极性键的断裂和形成 |
您最近一年使用:0次
2023-01-12更新
|
185次组卷
|
3卷引用:湖南省郴州市第一中学2023届高三下学期第四次月考化学试题



